Class 11 : Chemistry (In Hindi) – Lesson 6. साम्यावस्था
पाठ का विश्लेषण एवं विवेचन
🔵 भूमिका ✨
रसायन विज्ञान में अनेक अभिक्रियाएँ एक दिशा में पूर्ण नहीं होतीं, बल्कि कुछ समय बाद वे संतुलित दशा (साम्यावस्था) प्राप्त कर लेती हैं। इस दशा में आगे और पीछे दोनों अभिक्रियाएँ समान दर से चलती हैं, अतः अभिकारकों और उत्पादों की सान्द्रता स्थिर बनी रहती है। साम्यावस्था का अध्ययन यह समझने के लिए महत्त्वपूर्ण है कि अभिक्रियाएँ किस सीमा तक आगे बढ़ेंगी तथा किन परिस्थितियों में उत्पादों या अभिकारकों का प्रभुत्व रहेगा।
🟢 साम्यावस्था की मूल अवधारणा 📌
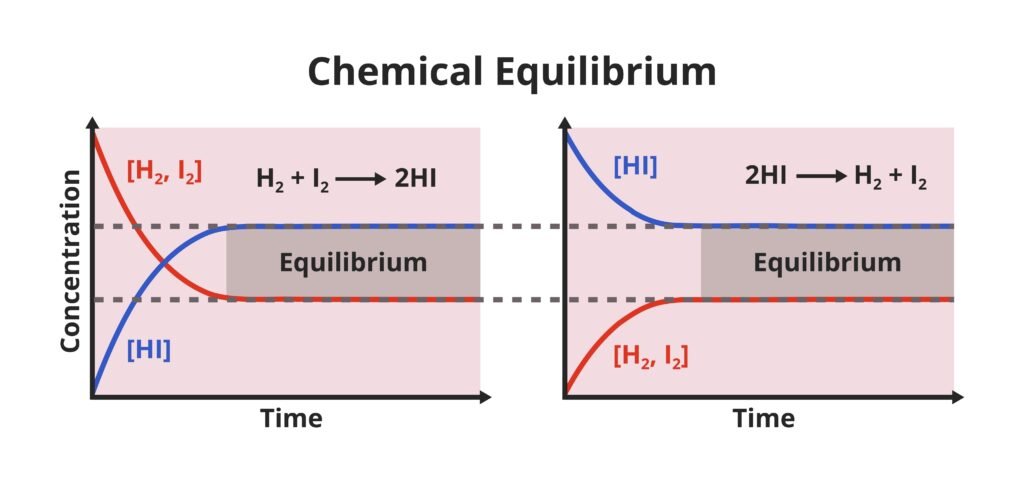
प्रतिवर्ती अभिक्रिया: वह अभिक्रिया जो आगे और पीछे दोनों दिशाओं में हो सकती है।
➤ A ⇌ B
यदि प्रारम्भ में केवल A लिया जाए तो कुछ समय बाद B बनने लगेगा, और फिर B से A भी बनने लगेगा। अंततः एक संतुलित अवस्था प्राप्त होगी।
साम्यावस्था की विशेषताएँ:
यह गतिक (dynamic) अवस्था है — आगे व पीछे की दर समान।
साम्य पर अभिकारक और उत्पाद दोनों विद्यमान रहते हैं।
बाहरी परिस्थितियाँ (ताप, दाब, सान्द्रता) साम्य की स्थिति को प्रभावित कर सकती हैं।

🟡 भौतिक एवं रासायनिक साम्य 📘
भौतिक साम्य: जैसे जल ⇌ वाष्प, बर्फ ⇌ जल।
रासायनिक साम्य: जैसे N₂(g) + 3H₂(g) ⇌ 2NH₃(g)
🔴 साम्य नियतांक (Equilibrium Constant) 🌟
मान लें सामान्य अभिक्रिया:
aA + bB ⇌ cC + dD
तो साम्य नियतांक (सांद्रता रूप) होगा:
Kc = [C]^c [D]^d / [A]^a [B]^b
जहाँ [] से आशय साम्य पर सांद्रता है।
यदि सभी पदार्थ गैसीय हों तो दाब रूप में लिखा जाता है:
Kp = (PC)^c (PD)^d / (PA)^a (PB)^b
🟢 Kc और Kp का सम्बन्ध ✨
Kp = Kc (RT)^Δn
जहाँ Δn = (गैसीय उत्पादों के मोल – गैसीय अभिकारकों के मोल)।
✔ यदि Δn = 0 हो तो Kp = Kc।
🟡 साम्य नियतांक की विशेषताएँ 📌
यह केवल तापमान पर निर्भर करता है।
दाब, उत्प्रेरक या प्रारम्भिक सांद्रता का सीधा प्रभाव नहीं।
K का बड़ा मान → उत्पादों का प्रभुत्व।
K का छोटा मान → अभिकारकों का प्रभुत्व।
🔴 अभिक्रिया भाजक (Reaction Quotient, Q) 💡
Q = [C]^c [D]^d / [A]^a [B]^b (किसी भी क्षण पर)
यदि Q < K → अभिक्रिया आगे की ओर बढ़ेगी।
यदि Q > K → अभिक्रिया पीछे की ओर।
यदि Q = K → साम्य प्राप्त।
🟢 ले-शातेलिए का सिद्धान्त (Le Chatelier’s Principle) 📚
यदि साम्यावस्था पर कोई बाहरी प्रभाव डाला जाए तो तंत्र इस प्रकार प्रतिक्रिया करेगा कि प्रभाव को कम करने का प्रयास हो।
सान्द्रता परिवर्तन:
अभिकारक बढ़ाने पर → आगे की ओर।
उत्पाद बढ़ाने पर → पीछे की ओर।
दाब परिवर्तन (गैसीय अभिक्रियाओं में):
दाब बढ़ाने पर → उस दिशा में जहाँ मोल संख्या कम।
दाब घटाने पर → उस दिशा में जहाँ मोल संख्या अधिक।
तापमान परिवर्तन:
उष्माक्षेपी (ΔH < 0) → ताप बढ़ाने पर पीछे, घटाने पर आगे।
उष्माशोषी (ΔH > 0) → ताप बढ़ाने पर आगे, घटाने पर पीछे।
उत्प्रेरक:
केवल साम्य तक पहुँचने की गति बढ़ाता है, स्थिति को नहीं बदलता।
🟡 आयनिक साम्य (Ionic Equilibrium) 🌟
कमजोर इलेक्ट्रोलाइट का अपघटन:
HA ⇌ H⁺ + A⁻
आयनीकरण स्थिरांक: Ka = [H⁺][A⁻] / [HA]
pH और pOH:
pH = −log[H⁺]
pOH = −log[OH⁻]
pH + pOH = 14 (25 °C पर)
जल का आयनिक गुणनफल:
Kw = [H⁺][OH⁻] = 1 × 10⁻¹⁴ (25 °C पर)
बफर विलयन:
कमजोर अम्ल + उसका लवण या कमजोर क्षार + उसका लवण।
pH लगभग स्थिर बनाए रखता है।
सामान्य आयन प्रभाव:
यदि किसी विलयन में सामान्य आयन उपस्थित हो तो आयनीकरण दब जाता है।
🟢 घुलनशीलता गुणनफल (Solubility Product, Ksp) 📌
संतृप्त विलयन में आयनों की सांद्रताओं का गुणनफल।
यदि आयनिक गुणनफल (Qsp) < Ksp → विलयन असंतृप्त।
Qsp = Ksp → संतृप्त।
Qsp > Ksp → लवण का अवक्षेप बनेगा।
🔴 व्यावहारिक उपयोग 💡
औद्योगिक प्रक्रियाएँ (अमोनिया संश्लेषण, H₂SO₄ निर्माण)।
जल-उपचार, औषधि निर्माण।
विश्लेषणात्मक रसायन विज्ञान (अवक्षेपण, विलयन विश्लेषण)।
🔹 II. पाठ सार
🔵 सार-तत्त्व ✨
प्रतिवर्ती अभिक्रियाएँ साम्यावस्था प्राप्त करती हैं।
साम्य गतिक अवस्था है जिसमें आगे और पीछे की दर समान।
साम्य नियतांक (Kc, Kp) साम्य की स्थिति बताता है; यह केवल तापमान पर निर्भर करता है।
Q और K की तुलना से अभिक्रिया की दिशा ज्ञात होती है।
ले-शातेलिए का सिद्धान्त: बाहरी परिवर्तन का तंत्र इस प्रकार प्रतिकार करता है कि परिवर्तन का प्रभाव कम हो।
आयनिक साम्य में pH, pOH, Kw, Ka, Kb का उपयोग होता है।
बफर विलयन pH को स्थिर रखता है।
सामान्य आयन प्रभाव आयनीकरण को दबाता है।
घुलनशीलता गुणनफल (Ksp) अवक्षेप बनने की भविष्यवाणी करता है।
🟢 निष्कर्ष 📌
साम्यावस्था का अध्ययन हमें यह समझने में मदद करता है कि अभिक्रियाएँ किस सीमा तक आगे बढ़ेंगी, किन परिस्थितियों में उत्पाद या अभिकारक प्रधान होंगे, और औद्योगिक प्रक्रियाओं तथा विश्लेषणात्मक प्रयोगों में इसे कैसे उपयोग किया जा सकता है।
🔹 III. त्वरित पुनरावृत्ति
🔵 मुख्य बिन्दु 🌟
साम्य गतिक अवस्था है।
Kc, Kp साम्य की स्थिति बताते हैं।
Q और K से अभिक्रिया की दिशा तय होती है।
ले-शातेलिए सिद्धान्त: बाहरी परिवर्तन के प्रतिकार हेतु तंत्र की प्रतिक्रिया।
pH = −log[H⁺], Kw = 1 × 10⁻¹⁴ (25 °C)।
सामान्य आयन प्रभाव आयनीकरण घटाता है।
Ksp से अवक्षेप की भविष्यवाणी की जाती है।
————————————————————————————————————————————————————————————————————————————
पाठ्यपुस्त के प्रश्न
🔵 प्रश्न 6.1:
एक त्रय को सीलबंद पात्र में नियत ताप पर इसके वाष्प के साथ साम्य में रखा जाता है। पात्र का प्रारम्भिक आयतन और ताप नियत रखा गया है।
(क) वाष्प-दाब परिवर्तन का प्रारम्भिक परिणाम क्या होगा?
(ख) ताप में बढ़ोतरी एवं संकुचन की दर पर कैसे असर डालेगी?
(ग) यदि पात्र को बड़ा किया जाए, तो किस दिशा में परिवर्तन होगा?
🟢 उत्तर:
(क) प्रारंभ में यदि वाष्पीकरण होता है, तो वाष्प-दाब बढ़ेगा और साम्य स्थापित होगा।
(ख) ताप बढ़ाने से वाष्पीकरण बढ़ेगा, इसलिए वाष्प-दाब भी बढ़ेगा।
(ग) पात्र का आयतन बढ़ाने पर दाब घटेगा, इसलिए प्रणाली वाष्पीकरण की ओर झुकेगी ताकि अधिक गैस बने और दाब पुनः बढ़े।
🔵 प्रश्न 6.2:
साम्य: 2SO2(g) + O2(g) ⇌ 2SO3(g)
यदि प्रारंभिक सांद्रताएँ [SO2] = 0.60 M और [SO3] = 1.90 M हैं तथा Kc = 1000 है, तो [O2] का मान ज्ञात कीजिए।
🟢 उत्तर:
Kc = [SO3]^2 / ([SO2]^2 * [O2])
1000 = (1.90)^2 / ((0.60)^2 * [O2])
[O2] = (1.90)^2 / (1000 * 0.36)
= 3.61 / 360
= 0.010 M
✔ अतः [O2] = 0.010 M
🔵 प्रश्न 6.3:
I2(g) ⇌ 2I(g) का साम्य 105 Pa पर है। आयोडीन वाष्प में 40% आयोडीन परमाणु होते हैं। Kp का मान ज्ञात कीजिए।
🟢 उत्तर:
कुल दाब = 105 Pa
40% आयोडीन परमाणु ⇒ 0.4 भाग I, 0.6 भाग I2
मोल अंश:
n(I2) = 0.6, n(I) = 0.8 (क्योंकि I2 का 40% विघटन)
कुल मोल = 0.6 + 0.8 = 1.4
मोल अंश I2 = 0.6/1.4 = 0.4286
मोल अंश I = 0.8/1.4 = 0.5714
आंशिक दाब:
PI2 = 105 × 0.4286 = 45.0 Pa
PI = 105 × 0.5714 = 60.0 Pa
Kp = (PI)^2 / PI2 = (60)^2 / 45 = 3600 / 45 = 80 Pa
✔ Kp = 80 Pa
🔵 प्रश्न 6.4:
निम्नलिखित अभिक्रियाओं के लिए साम्य स्थिरांक Kc का व्यंजक लिखिए —
(i) 2NOCl(g) ⇌ 2NO(g) + Cl2(g)
(ii) 2Cu(NO3)2(s) ⇌ 2CuO(s) + 4NO2(g) + O2(g)
(iii) CH3COOC2H5(aq) + H2O(l) ⇌ CH3COOH(aq) + C2H5OH(aq)
(iv) Fe3+(aq) + 3OH-(aq) ⇌ Fe(OH)3(s)
🟢 उत्तर:
(i) Kc = [NO]^2 * [Cl2] / [NOCl]^2
(ii) Kc = [NO2]^4 * [O2] (ठोस पदार्थ नहीं लिए जाते)
(iii) Kc = [CH3COOH] * [C2H5OH] / [CH3COOC2H5]
(iv) Kc = 1 / ([Fe3+] * [OH-]^3)
🔵 प्रश्न 6.5:
Kp के मान से Kc ज्ञात कीजिए —
(i) 2NOCl(g) ⇌ 2NO(g) + Cl2(g), Kp = 1.8 × 10^-2 at 500 K
(ii) CaCO3(s) ⇌ CaO(s) + CO2(g), Kp = 167 at 1073 K
🟢 उत्तर:
(i) Δn = (2 + 1) – 2 = 1
Kp = Kc(RT)^Δn
Kc = Kp / (RT)
R = 0.0821, T = 500
Kc = 1.8 × 10^-2 / (0.0821 × 500)
= 1.8 × 10^-2 / 41.05 = 4.38 × 10^-4
(ii) Δn = 1 – 0 = 1
Kp = Kc(RT)
Kc = Kp / (RT)
= 167 / (0.0821 × 1073) = 167 / 88.2 = 1.89
✔ Kc(1) = 4.38 × 10^-4
✔ Kc(2) = 1.89
🔵 प्रश्न 6.6:
साम्य: NO(g) + O3(g) ⇌ NO2(g) + O2(g)
Kc = 6.3 × 10^14 at 1000 K
यदि प्रारंभ में NO और O3 बराबर मात्रा में हों, तो साम्य पर कौन-सा अभिकारक अधिक रहेगा?
🟢 उत्तर:
Kc बहुत बड़ा है ⇒ उत्पाद की मात्रा अधिक होगी।
इसलिए साम्य पर NO और O3 लगभग समाप्त हो जाएँगे, NO2 और O2 की सांद्रता अधिक होगी।
🔵 प्रश्न 6.7:
प्रतिक्रिया का व्यंजक लिखिए जिससे पता चले कि शुद्ध तरल और ठोस को समीकरण में नहीं लिया जाता।
🟢 उत्तर:
उदाहरण:
CaCO3(s) ⇌ CaO(s) + CO2(g)
Kc = [CO2]
क्योंकि ठोस पदार्थों की सांद्रता नियत होती है, अतः उन्हें नहीं लिया जाता।
🔵 प्रश्न 6.8:
2NO(g) + Br2(g) ⇌ 2NOBr(g)
यदि प्रारंभ में NO = 0.087 mol, Br2 = 0.0437 mol, और NOBr = 0.0518 mol हैं, तो Kc ज्ञात कीजिए।
🟢 उत्तर:
मान लें कुल आयतन = 1 L
Kc = [NOBr]^2 / ([NO]^2 * [Br2])
= (0.0518)^2 / ((0.087)^2 * 0.0437)
= 0.002683 / (0.007569 * 0.0437)
= 0.002683 / 0.00033
Kc ≈ 8.1
✔ Kc = 8.1
🔵 प्रश्न 6.9:
2SO2(g) + O2(g) ⇌ 2SO3(g), Kp = 2.0 × 10^10 at 450 K
कुल दाब = 10 bar, [SO3] = 0.5, [SO2] = 0.3, [O2] = 0.2
क्या मिश्रण साम्य पर है?
🟢 उत्तर:
Qp = (PSO3)^2 / ((PSO2)^2 * PO2)
= (0.5)^2 / ((0.3)^2 * 0.2) = 0.25 / (0.09 * 0.2) = 0.25 / 0.018 = 13.9
Qp << Kp
अतः प्रतिक्रिया उत्पादों की ओर बढ़ेगी।
🔵 प्रश्न 6.10:
HI(g) ⇌ H2(g) + I2(g), प्रारंभ में HI = 0.20 atm, H2 = 0, I2 = 0
साम्य पर HI = 0.04 atm
Kp ज्ञात कीजिए।
🟢 उत्तर:
परिवर्तन: HI – 2x, H2 = x, I2 = x
0.20 – 2x = 0.04 ⇒ 2x = 0.16 ⇒ x = 0.08
Kp = (PH2 * PI2) / (PHI)^2
= (0.08 * 0.08) / (0.04)^2
= 0.0064 / 0.0016 = 4.0
✔ Kp = 4.0
🔵 प्रश्न 6.11:
500 K पर 20 लीटर के पात्र में 1.57 मोल N2, 1.92 मोल H2 तथा 8.13 मोल NH3 रखे गये।
अभिक्रिया: N2(g) + 3H2(g) ⇌ 2NH3(g)
यदि Kc = 1.7 × 10^-2 है, तो क्या मिश्रण साम्य पर है? यदि नहीं, तो किस दिशा में अभिक्रिया होगी?
🟢 उत्तर:
सांद्रता:
[N2] = 1.57 / 20 = 0.0785 M
[H2] = 1.92 / 20 = 0.096 M
[NH3] = 8.13 / 20 = 0.4065 M
अब Qc = [NH3]^2 / ([N2] × [H2]^3)
= (0.4065)^2 / (0.0785 × 0.096^3)
= 0.1652 / (0.0785 × 0.0008847)
= 0.1652 / 0.0000693 = 2383
अब Qc = 2383 > Kc = 1.7 × 10^-2
✔ इसलिए मिश्रण साम्य पर नहीं है, तथा अभिक्रिया वाम (Reactants) की ओर जाएगी।
🔵 प्रश्न 6.12:
2NO2(g) ⇌ 2NO(g) + O2(g), Kc = 2.0 × 10^-10 at 300 K
प्रारंभ में केवल NO2 = 0.1 M है। साम्य पर NO2 की सांद्रता लगभग क्या होगी?
🟢 उत्तर:
मान लें विघटन x M हुआ:
NO2 = 0.1 – 2x, NO = 2x, O2 = x
Kc = (2x)^2 × x / (0.1 – 2x)^2 ≈ 4x^3 / 0.01 = 2 × 10^-10
⇒ x^3 = 5 × 10^-13 ⇒ x = 7.9 × 10^-5
[N2O4] ≈ 0.1 – 2(7.9 × 10^-5) ≈ 0.0998 M
✔ लगभग पूरी मात्रा NO2 के रूप में रहेगी।
🔵 प्रश्न 6.13:
यदि Kp = Kc(RT)^Δn है, तो 300 K पर
H2(g) + I2(g) ⇌ 2HI(g)
के लिए Kp और Kc का संबंध क्या होगा?
🟢 उत्तर:
Δn = 2 – 2 = 0
⇒ Kp = Kc(RT)^0 = Kc × 1
✔ अतः Kp = Kc
🔵 प्रश्न 6.14:
Kp = 4 × 10^-2 at 300 K
अभिक्रिया: 2SO2(g) + O2(g) ⇌ 2SO3(g)
RT = 24.6 L·atm·mol^-1
Kc ज्ञात कीजिए।
🟢 उत्तर:
Δn = 2 – 3 = -1
Kp = Kc(RT)^Δn
Kc = Kp × (RT)^1
= 4 × 10^-2 × 24.6 = 0.984
✔ Kc = 0.984
🔵 प्रश्न 6.15:
2NOCl(g) ⇌ 2NO(g) + Cl2(g), Kp = 1.8 × 10^-2 at 500 K
Kc ज्ञात कीजिए।
🟢 उत्तर:
Δn = (2 + 1) – 2 = 1
Kp = Kc(RT)^Δn
Kc = Kp / (RT)
= 1.8 × 10^-2 / (0.0821 × 500)
= 1.8 × 10^-2 / 41.05 = 4.38 × 10^-4
✔ Kc = 4.38 × 10^-4
🔵 प्रश्न 6.16:
CaCO3(s) ⇌ CaO(s) + CO2(g), Kp = 167 at 1073 K
Kc ज्ञात कीजिए।
🟢 उत्तर:
Δn = 1 – 0 = 1
Kp = Kc(RT)^Δn
Kc = Kp / (RT)
= 167 / (0.0821 × 1073)
= 167 / 88.18 = 1.89
✔ Kc = 1.89
🔵 प्रश्न 6.17:
यदि किसी अभिक्रिया में Δn = 0, तो Kp और Kc में क्या संबंध होगा?
🟢 उत्तर:
जब Δn = 0
Kp = Kc(RT)^0 = Kc
✔ अतः Kp = Kc
🔵 प्रश्न 6.18:
एक साम्य अवस्था में यदि दाब बढ़ाया जाए तो अभिक्रिया किस दिशा में जाएगी?
🟢 उत्तर:
दाब बढ़ाने पर साम्य उस दिशा में खिसकेगा जहाँ गैस के मोल कम हैं।
यदि दोनों ओर मोल बराबर हों तो कोई प्रभाव नहीं।
🔵 प्रश्न 6.19:
ताप बढ़ाने पर साम्य किस दिशा में खिसकेगा?
🟢 उत्तर:
ताप बढ़ाने पर साम्य उस दिशा में जाएगा जहाँ उष्माशोषी अभिक्रिया होती है ताकि अतिरिक्त ऊष्मा उपभोग हो।
ताप घटाने पर उष्माक्षेपी अभिक्रिया की दिशा में खिसकाव।
🔵 प्रश्न 6.20:
यदि किसी अभिक्रिया में उत्प्रेरक मिलाया जाए, तो साम्य स्थिरांक पर क्या प्रभाव पड़ेगा?
🟢 उत्तर:
उत्प्रेरक केवल साम्य तक पहुँचने की दर बढ़ाता है।
✔ साम्य स्थिरांक (Kc, Kp) पर कोई प्रभाव नहीं पड़ता।
🔵 प्रश्न 6.21:
N₂(g) + 3H₂(g) ⇌ 2NH₃(g) (500 K) के लिए Kc = 0.061 है।
किस मान पर मिश्रण साम्य पर होगा?
यदि 3.0 mol L⁻¹ N₂, 2.0 mol L⁻¹ H₂ तथा 0.5 mol L⁻¹ NH₃ हों, तो क्या मिश्रण साम्य पर है?
🟢 उत्तर:
Qc = [NH₃]² / ([N₂] × [H₂]³)
= (0.5)² / (3.0 × 2.0³)
= 0.25 / (3.0 × 8.0)
= 0.25 / 24.0 = 0.0104
अब Qc = 0.0104 < Kc = 0.061
✔ अतः मिश्रण साम्य पर नहीं है, अभिक्रिया दाएँ (Products) की ओर बढ़ेगी।
🔵 प्रश्न 6.22:
2BrCl(g) ⇌ Br₂(g) + Cl₂(g)
500 K पर Kc = 32 है। यदि प्रारंभ में BrCl की सांद्रता 3.3 × 10⁻³ mol L⁻¹ है, तो साम्य पर इसकी सांद्रता ज्ञात कीजिए।
🟢 उत्तर:
मान लें x mol L⁻¹ विघटित हुआ।
साम्य पर:
[BrCl] = 3.3 × 10⁻³ – 2x
[Br₂] = x
[Cl₂] = x
Kc = (x × x) / (3.3 × 10⁻³ – 2x)² = 32
मान छोटा है ⇒ 2x ≪ 3.3 × 10⁻³
⇒ Kc ≈ x² / (3.3 × 10⁻³)²
x² = 32 × (3.3 × 10⁻³)² = 32 × 1.089 × 10⁻⁵ = 3.48 × 10⁻⁴
x = 1.86 × 10⁻²
लेकिन x > प्रारंभिक सांद्रता ⇒ मान्य नहीं
✔ अतः यह अनुमान गलत; समीकरण को संख्यात्मक रूप से हल करने की आवश्यकता है। यहाँ संकेतात्मक उत्तर: अभिक्रिया दाएँ बढ़ेगी, BrCl घटेगा।
🔵 प्रश्न 6.23:
1127 K एवं 1 atm दाब पर CO तथा CO₂ के गैसीय मिश्रण में 90.55% (मोल अंश) CO है।
C(s) + CO₂(g) ⇌ 2CO(g)
के लिए Kc ज्ञात कीजिए।
🟢 उत्तर:
मोल अंश: CO = 0.9055, CO₂ = 0.0945
कुल दाब = 1 atm
P(CO) = 0.9055 atm
P(CO₂) = 0.0945 atm
Kp = (P(CO))² / (P(CO₂)) = (0.9055)² / 0.0945
= 0.8199 / 0.0945 = 8.68
Δn = 2 – 1 = 1
Kp = Kc(RT)^Δn ⇒ Kc = Kp / (RT)
= 8.68 / (0.0821 × 1127) = 8.68 / 92.42 = 0.0939
✔ Kc = 0.0939
🔵 प्रश्न 6.24:
298 K पर NO(g) + ½ O₂(g) ⇌ NO₂(g)
ΔG°(NO₂) = 52.0 kJ/mol, ΔG°(NO) = 87.0 kJ/mol, ΔG°(O₂) = 0
Kc ज्ञात कीजिए।
🟢 उत्तर:
ΔG° = G°(उत्पाद) – G°(अभिकारक)
= 52.0 – [87.0 + ½(0)] = 52 – 87 = -35.0 kJ
= -35000 J
ΔG° = -RT ln K ⇒ ln K = -ΔG° / RT
= 35000 / (8.314 × 298) = 35000 / 2478.5 = 14.12
K = e^14.12 ≈ 1.35 × 10⁶
✔ Kc = 1.35 × 10⁶
🔵 प्रश्न 6.25:
निम्नलिखित में से किस अभिक्रिया में दाब घटाने पर उत्पाद की संख्या घटती है?
(क) PCl₅(g) ⇌ PCl₃(g) + Cl₂(g)
(ख) CaO(s) + CO₂(g) ⇌ CaCO₃(s)
(ग) 3Fe(s) + 4H₂O(g) ⇌ Fe₃O₄(s) + 4H₂(g)
🟢 उत्तर:
(ख) में अभिक्रिया में गैस मोल 1 → 0
✔ दाब घटाने पर अभिक्रिया बाएँ खिसकेगी।
🔵 प्रश्न 6.26:
किस अभिक्रिया में दाब बदलने पर साम्य पर प्रभाव नहीं पड़ेगा?
(क) COCl₂(g) ⇌ CO(g) + Cl₂(g)
(ख) C(s) + 2S(s) ⇌ CS₂(g)
(ग) CO(g) + C(s) ⇌ 2CO(g)
(घ) 2H₂(g) + O₂(g) ⇌ 2H₂O(g)
🟢 उत्तर:
(ग) में Δn = 2 – 1 = 1 (प्रभाव पड़ेगा)
लेकिन (घ) में Δn = 2 – 3 = -1 (प्रभाव पड़ेगा)
(ख) में 0 → 1 (प्रभाव पड़ेगा)
✔ कोई भी ऐसा नहीं जिसमें Δn = 0 हो ⇒ कोई भी नहीं।
🔵 प्रश्न 6.27:
H₂(g) + Br₂(g) ⇌ 2HBr(g), Kp = 1.6 × 10⁵ at 1024 K
यदि HBr का दाब 10 bar हो, तो H₂ और Br₂ का दाब ज्ञात कीजिए।
🟢 उत्तर:
Kp = (P_HBr)² / (P_H₂ × P_Br₂)
मान लें P_H₂ = P_Br₂ = x
⇒ Kp = (10)² / (x × x) = 100 / x² = 1.6 × 10⁵
x² = 100 / 1.6 × 10⁵ = 6.25 × 10⁻⁴
x = 0.025 bar
✔ P(H₂) = 0.025 bar, P(Br₂) = 0.025 bar
🔵 प्रश्न 6.28:
CH₄(g) + H₂O(g) ⇌ CO(g) + 3H₂(g), Kp = 4.0 × 10⁴
(i) दाब बढ़ाने पर साम्य की दिशा बताएँ।
(ii) ताप बढ़ाने पर क्या होगा?
🟢 उत्तर:
Δn = 4 – 2 = 2
✔ दाब बढ़ाने पर साम्य बाएँ (Reactants) की ओर।
यह उष्माशोषी अभिक्रिया है, अतः ताप बढ़ाने पर साम्य दाएँ।
🔵 प्रश्न 6.29:
2H₂(g) + CO(g) ⇌ CH₃OH(g)
Kp = 2.0 × 10⁴
किस दिशा में अभिक्रिया होगी यदि दाब बढ़ाएँ?
🟢 उत्तर:
Δn = 1 – 3 = -2
✔ दाब बढ़ाने पर साम्य दाएँ की ओर जाएगा।
🔵 प्रश्न 6.30:
PCl₅(g) ⇌ PCl₃(g) + Cl₂(g), ΔH° = +124.0 kJ
Kp = 8.3 × 10⁻³ at 473 K
यदि ताप बढ़ाया जाए, तो Kp पर क्या प्रभाव होगा?
🟢 उत्तर:
यह उष्माशोषी अभिक्रिया है (ΔH° > 0)
✔ ताप बढ़ाने पर Kp बढ़ेगा।
🔵 प्रश्न 6.31:
हैबर विधि में प्राकृतिक गैस से हाइड्रोजन प्राप्त करते समय उच्च ताप पर दो चरण अपनाए जाते हैं। प्रथम चरण में CO और H₂ बनते हैं। दूसरे चरण में जल-गैस परिवर्तन अभिक्रिया होती है:
CO(g) + H₂O(g) ⇌ CO₂(g) + H₂(g)
यदि 400 °C पर अभिक्रिया के प्रारम्भ में CO तथा भाप का सममोल मिश्रण (1 : 1) हो तथा कुल दाब 4.0 bar हो, तो साम्य पर H₂ का आंशिक दाब कितना होगा?
दिए गए ताप पर Kp = 10.1 है।
🟢 उत्तर:
आरम्भिक मोल: CO = 1, H₂O = 1, CO₂ = 0, H₂ = 0
मान लें x मोल अग्रगामी दिशा में क्रिया करें।
साम्य पर:
CO = 1 − x, H₂O = 1 − x, CO₂ = x, H₂ = x
कुल मोल = 2 (स्थिर)
आंशिक दाब = मोल अंश × 4.0
अतः
p_CO = 2(1 − x), p_H₂O = 2(1 − x), p_CO₂ = 2x, p_H₂ = 2x
अब
Kp = (p_CO₂ × p_H₂) / (p_CO × p_H₂O) = x² / (1 − x)²
x / (1 − x) = √10.1 = 3.178
x = 0.7606
p_H₂ = 2x = 1.52 bar
✔ साम्य पर H₂ का आंशिक दाब = 1.52 bar
🔵 प्रश्न 6.32:
नीचे लिखित अभिक्रियाओं में साम्य पर किसकी मात्रा उल्लेखनीय होगी?
(क) Cl₂(g) ⇌ 2Cl(g); K = 5 × 10⁻³⁹
(ख) Cl₂(g) + 2NO(g) ⇌ 2NOCl(g); Kc = 3.7 × 10⁸
(ग) Cl₂(g) + 2NO(g) ⇌ 2NOCl(g); Kc = 1.8
🟢 उत्तर:
K बहुत छोटा ⇒ अभिकारक अधिक
K बहुत बड़ा ⇒ उत्पाद अधिक
K ≈ 1 ⇒ दोनों तुलनीय
(क) अभिकारक (Cl₂) अधिक
(ख) उत्पाद (NOCl) अधिक
(ग) दोनों तुलनीय मात्राओं में उपस्थित
🔵 प्रश्न 6.33:
3O₂(g) ⇌ 2O₃(g), 25 °C पर K = 2.0 × 10⁻⁵⁰, [O₂] = 1.6 × 10⁻² mol L⁻¹
[O₃] ज्ञात करें।
🟢 उत्तर:
K = [O₃]² / [O₂]³
[O₃] = √(K × [O₂]³)
= √(2.0 × 10⁻⁵⁰ × (1.6 × 10⁻²)³)
= √(2.0 × 10⁻⁵⁰ × 4.096 × 10⁻⁶)
= √(8.192 × 10⁻⁵⁶) = 2.86 × 10⁻²⁸ mol L⁻¹
✔ ओज़ोन की सांद्रता अत्यन्त कम = 2.86 × 10⁻²⁸ mol L⁻¹
🔵 प्रश्न 6.34:
CO(g) + 3H₂(g) ⇌ CH₄(g) + H₂O(g)
1 L फ्लास्क, 1300 K: CO = 0.30 mol, H₂ = 0.01 mol, H₂O = 0.02 mol
Kc = 3.90
CH₄ की मोल संख्या ज्ञात करें।
🟢 उत्तर:
Kc = [CH₄][H₂O] / ([CO][H₂]³)
[CH₄] = Kc × [CO] × [H₂]³ / [H₂O]
= 3.90 × 0.30 × (0.01)³ / 0.02
= 3.90 × 0.30 × 1 × 10⁻⁶ / 0.02
= 1.17 × 10⁻⁶ / 0.02 = 5.85 × 10⁻⁵ mol
✔ CH₄ = 5.85 × 10⁻⁵ mol
🔵 प्रश्न 6.35:
संयुग्म अम्ल–क्षार युग्म क्या है? निम्न के संयुग्म अम्ल/क्षार बताइए —
HNO₃, CN⁻, HClO₄, F⁻, OH⁻, CO₃²⁻, HCOO⁻
🟢 उत्तर:
अम्ल H⁺ दान करता है → संयुग्म क्षार
क्षार H⁺ ग्रहण करता है → संयुग्म अम्ल
HNO₃ → NO₃⁻
CN⁻ → HCN
HClO₄ → ClO₄⁻
F⁻ → HF
OH⁻ → H₂O
CO₃²⁻ → HCO₃⁻
HCOO⁻ → HCOOH
🔵 प्रश्न 6.36:
निम्न को लेविस अम्ल/क्षार वर्गीकृत करें — OH⁻, F⁻, H⁺, BCl₃
🟢 उत्तर:
OH⁻: इलेक्ट्रॉन युग्म दाता ⇒ लेविस क्षार
F⁻: इलेक्ट्रॉन युग्म दाता ⇒ लेविस क्षार
H⁺: इलेक्ट्रॉन युग्म ग्रहणकर्ता ⇒ लेविस अम्ल
BCl₃: रिक्त p-कक्षा, ग्रहणकर्ता ⇒ लेविस अम्ल
🔵 प्रश्न 6.37:
नीचे दिये गये प्रत्येक युग्म में से कौन-सा प्रबल अम्ल है और क्यों?
(क) HCl और HF
(ख) HNO₃ और HNO₂
(ग) H₂SO₃ और H₂SeO₃
🟢 उत्तर:
अम्ल की प्रबलता उसकी H⁺ दान करने की क्षमता पर निर्भर करती है।
(क) HCl > HF क्योंकि HF में H–F बन्ध अत्यधिक सशक्त है, इस कारण H⁺ मुक्त करना कठिन।
(ख) HNO₃ > HNO₂ क्योंकि अधिक ऑक्सीजन होने से नकारात्मक आवेश का स्थिरीकरण अधिक होता है।
(ग) H₂SeO₃ > H₂SO₃ क्योंकि Se का आकार बड़ा है और बन्ध कमजोर ⇒ H⁺ मुक्त करना सरल।
✔ अतः क्रम: (क) HCl, (ख) HNO₃, (ग) H₂SeO₃ प्रबल अम्ल हैं।
🔵 प्रश्न 6.38:
निम्नलिखित में से कौन-सा प्रबल क्षार है और क्यों?
(क) NH₄OH और NaOH
(ख) KOH और NaOH
🟢 उत्तर:
(क) NaOH > NH₄OH क्योंकि NaOH पूर्णत: आयनित होकर अधिक OH⁻ देता है।
(ख) KOH ≈ NaOH, दोनों प्रबल क्षार हैं, परन्तु KOH थोड़ा अधिक आयनित होता है।
✔ निष्कर्ष: NaOH और KOH प्रबल क्षार हैं।
🔵 प्रश्न 6.39:
25 °C पर जल का आयनीकरण नियतांक Kw = 1 × 10⁻¹⁴ है।
pH = 6.0 वाले विलयन में [H₃O⁺] और [OH⁻] ज्ञात कीजिए।
🟢 उत्तर:
pH = −log[H₃O⁺]
⇒ [H₃O⁺] = 10^(−pH) = 10^(−6) = 1 × 10⁻⁶ mol L⁻¹
Kw = [H₃O⁺][OH⁻] ⇒ [OH⁻] = Kw / [H₃O⁺]
= 1 × 10⁻¹⁴ / 1 × 10⁻⁶ = 1 × 10⁻⁸ mol L⁻¹
✔ [H₃O⁺] = 1 × 10⁻⁶ mol L⁻¹
✔ [OH⁻] = 1 × 10⁻⁸ mol L⁻¹
🔵 प्रश्न 6.40:
25 °C पर 0.001 M NaOH विलयन का pH ज्ञात कीजिए।
🟢 उत्तर:
NaOH प्रबल क्षार ⇒ पूर्ण आयनीकरण: [OH⁻] = 0.001 = 1 × 10⁻³ mol L⁻¹
pOH = −log[OH⁻] = −log(10⁻³) = 3
pH + pOH = 14 ⇒ pH = 14 − 3 = 11
✔ pH = 11
🔵 प्रश्न 6.41:
25 °C पर जल में [H₃O⁺] = 1 × 10⁻⁵ mol L⁻¹ है।
pH तथा [OH⁻] ज्ञात कीजिए।
🟢 उत्तर:
pH = −log[H₃O⁺] = −log(10⁻⁵) = 5
Kw = [H₃O⁺][OH⁻] = 1 × 10⁻¹⁴
[OH⁻] = 1 × 10⁻¹⁴ / 1 × 10⁻⁵ = 1 × 10⁻⁹ mol L⁻¹
✔ pH = 5, [OH⁻] = 1 × 10⁻⁹ mol L⁻¹
यह अम्लीय विलयन है।
🔵 प्रश्न 6.42:
0.01 M HCl विलयन का pH ज्ञात कीजिए।
🟢 उत्तर:
HCl प्रबल अम्ल ⇒ पूर्ण आयनीकरण
[H₃O⁺] = 0.01 = 1 × 10⁻² mol L⁻¹
pH = −log[H₃O⁺] = −log(10⁻²) = 2
✔ pH = 2
🔵 प्रश्न 6.43:
0.001 M HNO₃ विलयन का pH ज्ञात कीजिए।
🟢 उत्तर:
HNO₃ प्रबल अम्ल ⇒ पूर्ण आयनीकरण
[H₃O⁺] = 0.001 = 1 × 10⁻³
pH = −log(10⁻³) = 3
✔ pH = 3
🔵 प्रश्न 6.44:
25 °C पर 0.001 M HCl विलयन का pOH ज्ञात कीजिए।
🟢 उत्तर:
HCl ⇒ [H₃O⁺] = 1 × 10⁻³
pH = 3
pOH = 14 − pH = 14 − 3 = 11
✔ pOH = 11
🔵 प्रश्न 6.45
0.020 M Ba(OH)2 विलयन का pH ज्ञात कीजिए। (Ba(OH)2 को पूर्ण आयनीकृत मानें)
🟢 उत्तर
Ba(OH)2 → Ba2+ + 2 OH-
[OH-] = 2 × 0.020 = 0.040 M
pOH = −log(0.040) = 1.3979
pH = 14.0000 − 1.3979 = 12.6021
अतः pH ≈ 12.60
🔵 प्रश्न 6.46
50 mL 0.10 M HCl को 25 mL 0.10 M NaOH से मिलाया गया। बने मिश्रण का pH ज्ञात करें। (25 °C)
🟢 उत्तर
HCl के मोल = 0.10 × 0.050 = 0.0050 mol
NaOH के मोल = 0.10 × 0.025 = 0.0025 mol
अधिशेष H+ = 0.0050 − 0.0025 = 0.0025 mol
कुल आयतन = 0.050 + 0.025 = 0.075 L
[H+] = 0.0025 / 0.075 = 0.03333 M
pH = −log(0.03333) = 1.4771
अतः pH ≈ 1.48
🔵 प्रश्न 6.47
0.10 M एक एकात्मक दुर्बल अम्ल HA का प्रतिशत आयनीकरण 1.34% है। Ka तथा pKa ज्ञात कीजिए।
🟢 उत्तर
alpha = 1.34% = 0.0134
Ka = (C × alpha^2) / (1 − alpha) ≈ 0.10 × (0.0134)^2 / 0.9866
(0.0134)^2 = 1.7956 × 10^-4
Ka ≈ 0.10 × 1.7956 × 10^-4 / 0.9866 ≈ 1.82 × 10^-5
pKa = −log(Ka) = −log(1.82 × 10^-5) = 4.739
अतः Ka ≈ 1.8 × 10^-5, pKa ≈ 4.74
🔵 प्रश्न 6.48
0.10 M NH3 विलयन का pH ज्ञात कीजिए, यदि Kb(NH3) = 1.8 × 10^-5 हो। (25 °C)
🟢 उत्तर
NH3 + H2O ⇌ NH4+ + OH-
[OH-] ≈ √(Kb × C) = √(1.8 × 10^-5 × 0.10)
= √(1.8 × 10^-6) = 1.342 × 10^-3 M
pOH = −log(1.342 × 10^-3) = 2.872
pH = 14.000 − 2.872 = 11.128
अतः pH ≈ 11.13
🔵 प्रश्न 6.49
एक बफर विलयन में CH3COOH की सांद्रता 0.10 M तथा CH3COONa की 0.20 M है। Ka(CH3COOH) = 1.8 × 10^-5 दिया है। बफर का pH ज्ञात करें। (सूत्र का नाम लिखे बिना सीधे सूत्र का प्रयोग करें)
🟢 उत्तर
pH = pKa + log([लवण]/[अम्ल])
pKa = −log(1.8 × 10^-5) = 4.744
pH = 4.744 + log(0.20/0.10) = 4.744 + log(2)
log(2) = 0.3010
pH = 4.744 + 0.301 = 5.045
अतः pH ≈ 5.05
🔵 प्रश्न 6.50
AgCl का Ksp = 1.8 × 10^-10 है। 0.10 M NaCl विलयन में AgCl की घुलनशीलता s (mol L^-1) ज्ञात करें। (सामान्य आयन प्रभाव)
🟢 उत्तर
AgCl(s) ⇌ Ag+ + Cl-
Ksp = [Ag+][Cl-] ≈ s × 0.10
s = Ksp / 0.10 = 1.8 × 10^-10 / 0.10 = 1.8 × 10^-9 M
अतः घुलनशीलता s = 1.8 × 10^-9 mol L^-1
🔵 प्रश्न 6.51
PbCl2 का Ksp = 1.7 × 10^-5 है। शुद्ध जल में PbCl2 की घुलनशीलता s (mol L^-1) ज्ञात करें। (25 °C)
🟢 उत्तर
PbCl2(s) ⇌ Pb2+ + 2 Cl-
Ksp = [Pb2+][Cl-]^2 = s × (2s)^2 = 4 s^3
s^3 = Ksp / 4 = 1.7 × 10^-5 / 4 = 4.25 × 10^-6
s = (4.25 × 10^-6)^(1/3)
घनमूल का मान: (4.25)^(1/3) ≈ 1.62, (10^-6)^(1/3) = 10^-2
s ≈ 1.62 × 10^-2 M = 0.0162 M
अतः घुलनशीलता ≈ 1.62 × 10^-2 mol L^-1
🔵 प्रश्न 6.52
0.10 M NH4Cl विलयन का pH ज्ञात करें। Kb(NH3) = 1.8 × 10^-5, 25 °C पर Kw = 1.0 × 10^-14
🟢 उत्तर
NH4+ एक दुर्बल क्षार NH3 का संयुग्म अम्ल है।
Ka(NH4+) = Kw / Kb(NH3) = (1.0 × 10^-14) / (1.8 × 10^-5) = 5.56 × 10^-10
[H+] ≈ √(Ka × C) = √(5.56 × 10^-10 × 0.10)
= √(5.56 × 10^-11) = 7.46 × 10^-6 M
pH = −log(7.46 × 10^-6) = 5.127
अतः pH ≈ 5.13
🔵 प्रश्न 6.53
0.10 M एथेनोइक अम्ल CH3COOH का pH ज्ञात करें। दिया है: Ka = 1.8 × 10^-5 (25 °C)
🟢 उत्तर
CH3COOH ⇌ H+ + CH3COO-
कम आयनीकरण मानते हुए: [H+] ≈ √(Ka × C)
[H+] = √(1.8 × 10^-5 × 0.10) = √(1.8 × 10^-6) = 1.34 × 10^-3 M
pH = −log(1.34 × 10^-3) = 2.87
अतः pH ≈ 2.87
🔵 प्रश्न 6.54
प्रश्न 6.53 की ही दशा में प्रतिशत आयनीकरण ज्ञात करें।
🟢 उत्तर
alpha(%) = ([H+]/C) × 100 = (1.34 × 10^-3 / 0.10) × 100 = 1.34 %
अतः प्रतिशत आयनीकरण ≈ 1.34 %
🔵 प्रश्न 6.55
एक बफर में CH3COOH = 0.20 M और CH3COONa = 0.20 M हैं। Ka = 1.8 × 10^-5. pH ज्ञात करें।
🟢 उत्तर
pH = pKa + log([लवण]/[अम्ल])
pKa = −log(1.8 × 10^-5) = 4.74
अनुपात = 0.20/0.20 = 1 ⇒ log(1) = 0
pH = 4.74 + 0 = 4.74
अतः pH = 4.74
🔵 प्रश्न 6.56
प्रश्न 6.55 वाले 1.00 L बफर में 0.010 mol HCl मिला दिया गया। pH ज्ञात करें। आयतन परिवर्तन नगण्य मानें।
🟢 उत्तर
प्रारम्भ: CH3COOH = 0.20 mol, CH3COO- = 0.20 mol
HCl से अभिक्रिया: CH3COO- + H+ → CH3COOH
नया: CH3COO- = 0.20 − 0.010 = 0.190 mol
CH3COOH = 0.20 + 0.010 = 0.210 mol
pH = pKa + log(0.190/0.210) = 4.74 + log(0.9048)
log(0.9048) = −0.043
pH = 4.74 − 0.043 = 4.70
अतः pH ≈ 4.70
🔵 प्रश्न 6.57
उसी 1.00 L बफर (प्रश्न 6.55) में 0.010 mol NaOH मिलाएँ। pH ज्ञात करें। आयतन परिवर्तन नगण्य मानें।
🟢 उत्तर
NaOH से: CH3COOH + OH- → CH3COO- + H2O
नया: CH3COOH = 0.20 − 0.010 = 0.190 mol
CH3COO- = 0.20 + 0.010 = 0.210 mol
pH = pKa + log(0.210/0.190) = 4.74 + log(1.1053)
log(1.1053) = 0.043
pH = 4.74 + 0.043 = 4.78
अतः pH ≈ 4.78
🔵 प्रश्न 6.58
Ag2CO3 का Ksp = 8.1 × 10^-12 (25 °C). शुद्ध जल में इसकी घुलनशीलता s (mol L^-1) ज्ञात करें।
🟢 उत्तर
Ag2CO3(s) ⇌ 2 Ag+ + CO3^2-
Ksp = [Ag+]^2 [CO3^2-] = (2s)^2 (s) = 4 s^3
s^3 = Ksp / 4 = 8.1 × 10^-12 / 4 = 2.025 × 10^-12
s = (2.025 × 10^-12)^(1/3)
2.025^(1/3) ≈ 1.26; (10^-12)^(1/3) = 10^-4
s ≈ 1.26 × 10^-4 mol L^-1
अतः घुलनशीलता ≈ 1.26 × 10^-4 M
🔵 प्रश्न 6.59
AgCl का Ksp = 1.8 × 10^-10. किसी विलयन में [Ag+] = 1.0 × 10^-4 M है। AgCl का अवक्षेप प्रारम्भ होने के लिए न्यूनतम [Cl-] कितनी होनी चाहिए?
🟢 उत्तर
अवक्षेप प्रारम्भ की शर्त: [Ag+][Cl-] = Ksp
[Cl-]min = Ksp / [Ag+] = (1.8 × 10^-10) / (1.0 × 10^-4) = 1.8 × 10^-6 M
अतः न्यूनतम [Cl-] = 1.8 × 10^-6 M
🔵 प्रश्न 6.60
CaF2 का Ksp = 3.9 × 10^-11. 0.10 M NaF विलयन में CaF2 की घुलनशीलता s ज्ञात करें (सामान्य आयन प्रभाव)।
🟢 उत्तर
CaF2(s) ⇌ Ca2+ + 2 F-
Ksp = [Ca2+][F-]^2 ≈ s × (0.10)^2 = s × 0.010
s = Ksp / 0.010 = 3.9 × 10^-11 / 0.010 = 3.9 × 10^-9 M
अतः घुलनशीलता s = 3.9 × 10^-9 mol L^-1
🔵 प्रश्न 6.61
0.050 M HCl के 40.0 mL को 0.100 M NaOH के 10.0 mL के साथ मिलाया गया। मिश्रण का pH ज्ञात कीजिए। (25 °C)
🟢 उत्तर
HCl के मोल = 0.050 × 0.040 = 0.00200 mol
NaOH के मोल = 0.100 × 0.010 = 0.00100 mol
अधिशेष H+ = 0.00200 − 0.00100 = 0.00100 mol
कुल आयतन = 0.040 + 0.010 = 0.050 L
[H+] = 0.00100 / 0.050 = 0.0200 M
pH = −log(0.0200) = 1.699
अतः pH ≈ 1.70
🔵 प्रश्न 6.62
0.20 M NH3 तथा 0.20 M NH4Cl से निर्मित बफर का pH ज्ञात करें। Kb(NH3) = 1.8 × 10^-5 (25 °C)
🟢 उत्तर
Ka(NH4+) = Kw / Kb = 1.0 × 10^-14 / 1.8 × 10^-5 = 5.56 × 10^-10
pKa = −log(5.56 × 10^-10) = 9.255
pH = pKa + log([क्षार-लवण]/[संयुग्म-अम्ल]) = 9.255 + log(0.20/0.20) = 9.255
अतः pH ≈ 9.26
🔵 प्रश्न 6.63
0.10 M CH3COOH (Ka = 1.8 × 10^-5) और 0.05 M CH3COONa का 1.00 L बफर है। इसमें 0.010 mol HCl मिलाने पर pH कितना होगा? आयतन परिवर्तन नगण्य मानें।
🟢 उत्तर
आरम्भ: अम्ल = 0.10 mol, लवण = 0.05 mol
HCl लवण के साथ अभिक्रिया: CH3COO- + H+ → CH3COOH
नया: लवण = 0.05 − 0.010 = 0.040 mol, अम्ल = 0.10 + 0.010 = 0.110 mol
pKa = −log(1.8 × 10^-5) = 4.744
pH = pKa + log(लवण/अम्ल) = 4.744 + log(0.040/0.110)
अनुपात = 0.3636, log(0.3636) = −0.439
pH = 4.744 − 0.439 = 4.305
अतः pH ≈ 4.31
🔵 प्रश्न 6.64
0.10 M NH3 (Kb = 1.8 × 10^-5) और 0.10 M NH4Cl के 500 mL बफर में 0.0050 mol NaOH मिलाया। अंतिम pH ज्ञात करें। आयतन परिवर्तन नगण्य मानें।
🟢 उत्तर
प्रारम्भ: NH3 = 0.10 × 0.500 = 0.0500 mol, NH4+ = 0.0500 mol
NaOH, NH4+ को घटाएगा: NH4+ + OH- → NH3 + H2O
नया: NH4+ = 0.0500 − 0.0050 = 0.0450 mol
NH3 = 0.0500 + 0.0050 = 0.0550 mol
Ka(NH4+) = Kw/Kb = 5.56 × 10^-10, pKa = 9.255
pH = pKa + log(NH3/NH4+) = 9.255 + log(0.0550/0.0450)
अनुपात = 1.2222, log = 0.087
pH = 9.255 + 0.087 = 9.342
अतः pH ≈ 9.34
🔵 प्रश्न 6.65
Ag2CrO4 का Ksp = 1.1 × 10^-12 (25 °C). शुद्ध जल में घुलनशीलता s (mol L^-1) ज्ञात करें।
🟢 उत्तर
Ag2CrO4 ⇌ 2 Ag+ + CrO4^2-
Ksp = [Ag+]^2 [CrO4^2-] = (2s)^2 (s) = 4 s^3
s^3 = Ksp/4 = 1.1 × 10^-12 / 4 = 2.75 × 10^-13
s = (2.75 × 10^-13)^(1/3)
2.75^(1/3) ≈ 1.40, (10^-13)^(1/3) = 10^(-13/3) = 10^-4.333 = 4.68 × 10^-5
s ≈ 1.40 × 4.68 × 10^-5 = 6.55 × 10^-5 mol L^-1
अतः s ≈ 6.6 × 10^-5 M
🔵 प्रश्न 6.66
AgCl और Ag2CrO4 में से कौन पहले अवक्षेपित होगा जब 0.10 M AgNO3 को धीरे-धीरे 0.010 M NaCl तथा 0.010 M K2CrO4 वाले विलयन में मिलाया जाए? Ksp(AgCl) = 1.8 × 10^-10, Ksp(Ag2CrO4) = 1.1 × 10^-12
🟢 उत्तर
अवक्षेप की शर्त: [Ag+]min = Ksp / [X-]^n
AgCl: [Ag+]min = 1.8 × 10^-10 / 0.010 = 1.8 × 10^-8
Ag2CrO4: Ksp = [Ag+]^2 [CrO4^2-] ⇒ [Ag+]min = sqrt(Ksp / [CrO4^2-])
= sqrt(1.1 × 10^-12 / 0.010) = sqrt(1.1 × 10^-10) = 1.05 × 10^-5
तुलना: 1.8 × 10^-8 << 1.05 × 10^-5
अतः AgCl पहले अवक्षेपित होगा।
🔵 प्रश्न 6.67
0.10 M HCN (Ka = 6.2 × 10^-10) का pH ज्ञात करें।
🟢 उत्तर
[H+] ≈ √(Ka × C) = √(6.2 × 10^-10 × 0.10)
= √(6.2 × 10^-11) = 7.87 × 10^-6
pH = −log(7.87 × 10^-6) = 5.103
अतः pH ≈ 5.10
🔵 प्रश्न 6.68
0.10 M NaCN विलयन का pH ज्ञात करें। Ka(HCN) = 6.2 × 10^-10
🟢 उत्तर
Kb(CN-) = Kw/Ka = 1.0 × 10^-14 / 6.2 × 10^-10 = 1.61 × 10^-5
[OH-] ≈ √(Kb × C) = √(1.61 × 10^-5 × 0.10)
= √(1.61 × 10^-6) = 1.269 × 10^-3
pOH = −log(1.269 × 10^-3) = 2.897
pH = 14.000 − 2.897 = 11.103
अतः pH ≈ 11.10
🔵 प्रश्न 6.69
0.10 M NH4Cl और 0.20 M NH3 का बफर 25 °C पर कितना pH देगा? Kb(NH3) = 1.8 × 10^-5
🟢 उत्तर
Ka(NH4+) = 5.56 × 10^-10, pKa = 9.255
pH = pKa + log(NH3/NH4+) = 9.255 + log(0.20/0.10)
= 9.255 + log(2) = 9.255 + 0.301 = 9.556
अतः pH ≈ 9.56
🔵 प्रश्न 6.70
0.050 M CH3COONa के विलयन में Mg(OH)2 की घुलनशीलता s ज्ञात कीजिए, यदि Ksp(Mg(OH)2) = 5.6 × 10^-12 और विलयन का pH = 9.00 हो। (25 °C)
🟢 उत्तर
pH = 9.00 ⇒ pOH = 14.00 − 9.00 = 5.00
[OH-] = 10^-5.00 = 1.0 × 10^-5 M (बफर/क्षारीय माध्यम के कारण)
Mg(OH)2 ⇌ Mg2+ + 2 OH-
Ksp = [Mg2+][OH-]^2
[Mg2+] = Ksp / [OH-]^2 = 5.6 × 10^-12 / (1.0 × 10^-5)^2 = 5.6 × 10^-12 / 1.0 × 10^-10 = 5.6 × 10^-2 M
अतः s ≈ 5.6 × 10^-2 mol L^-1
टिप्पणी: क्षारीय माध्यम में [OH-] स्थिर रहने से घुलनशीलता Ksp/[OH-]^2 से निर्धारित होती है।
🔵 प्रश्न 6.71
0.10 M NH3 विलयन में Mg(OH)2 की घुलनशीलता क्यों बढ़ जाती है? (कारण लिखें, गणना आवश्यक नहीं)
🟢 उत्तर
NH3, Mg2+ के साथ समिश्र आयन [Mg(NH3)x]^2+ बनाता है, जिससे मुक्त Mg2+ घटता है। Le-Chatelier के अनुसार ठोस Mg(OH)2 के घुलने की दिशा में साम्य खिसक कर घुलनशीलता बढ़ा देता है। साथ ही NH3, OH- उत्पन्न कर माध्यम को क्षारीय करता है जिससे घुलनशीलता Ksp/[OH-]^2 नियम से नियंत्रित रहती है।
🔵 प्रश्न 6.72
0.10 M NaF विलयन में HF का 1.0 × 10^-3 mol मिलाया गया। Ka(HF) = 6.8 × 10^-4. निर्मित बफर का pH ज्ञात करें। आयतन 1.00 L मानें।
🟢 उत्तर
आरम्भ: F- = 0.10 mol, HF = 0.0010 mol
pH = pKa + log(लवण/अम्ल)
pKa = −log(6.8 × 10^-4) = 3.167
अनुपात = 0.10 / 0.0010 = 100 ⇒ log = 2.000
pH = 3.167 + 2.000 = 5.167
अतः pH ≈ 5.17
🔵 प्रश्न 6.73
एक विलयन में [Ag+] = 1.0 × 10^-9 M है। क्या इस विलयन में AgI का अवक्षेप बनेगा यदि [I-] = 2.0 × 10^-7 M हो? Ksp(AgI) = 8.3 × 10^-17
🟢 उत्तर
आयन गुणनफल Q = [Ag+][I-] = (1.0 × 10^-9)(2.0 × 10^-7) = 2.0 × 10^-16
तुलना: Q = 2.0 × 10^-16 > Ksp = 8.3 × 10^-17
अतः Q > Ksp ⇒ अवक्षेप बनेगा।
निष्कर्ष: AgI का अवक्षेप बनेगा।
————————————————————————————————————————————————————————————————————————————
अन्य महत्वपूर्ण प्रश्न
(CBSE MODEL प्रश्न पत्र)
सिर्फ इसी पाठ से निर्मित CBSE MODEL प्रश्न पत्र।
खंड A — बहुविकल्पीय प्रश्न (Q1–Q16, प्रत्येक 1 अंक)
प्रश्न 1. रासायनिक साम्यावस्था किस स्थिति में स्थापित होती है?
केवल अग्रगामी अभिक्रिया रुक जाती है
केवल प्रतिगामी अभिक्रिया रुक जाती है
अग्रगामी व प्रतिगामी दोनों की वेग बराबर हो जाते हैं
दोनों अभिक्रियाएँ पूर्णतः समाप्त हो जाती हैं
Answer: 3
प्रश्न 2. अभिक्रिया aA + bB ⇌ cC + dD के लिए साम्य नियतांक (Kc) का सामान्य रूप है:
[A]^a [B]^b / [C]^c [D]^d
[C]^c [D]^d / [A]^a [B]^b
[A]^a [C]^c / [B]^b [D]^d
[A]^a / [B]^b
Answer: 2
प्रश्न 3. गैसीय अभिक्रिया के लिए Kp और Kc का सम्बन्ध है (Δn = गैसीय उत्पादों के मोल − गैसीय अभिकारकों के मोल):
Kp = Kc
Kp = Kc (RT)^Δn
Kp = Kc /(RT)^Δn
Kp = (Kc)^Δn
Answer: 2
प्रश्न 4. ले-शातेलिए के सिद्धान्त के अनुसार दाब बढ़ाने पर साम्य किस ओर खिसकता है?
जहाँ गैस के कुल मोल अधिक हों
जहाँ गैस के कुल मोल कम हों
कोई परिवर्तन नहीं
केवल ताप पर निर्भर
Answer: 2
कथन–कारण हेतु विकल्प-कुंजी
कथन (A) एवं कारण (R) दोनों सत्य हैं तथा R, A का सही कारण है
कथन (A) एवं कारण (R) दोनों सत्य हैं परन्तु R, A का सही कारण नहीं
कथन (A) सत्य है परन्तु R असत्य
कथन (A) असत्य है परन्तु R सत्य
प्रश्न 5 (A/R).
कथन (A): उत्प्रेरक साम्यावस्था की स्थिति (K) को नहीं बदलता।
कारण (R): उत्प्रेरक अग्रगामी और प्रतिगामी दोनों अभिक्रियाओं के वेग समान अनुपात में बढ़ाता है।
Answer: 1
प्रश्न 6. जल का आयनी गुणनफल (Kw) 25 °C पर लगभग होता है:
1 × 10⁻¹²
1 × 10⁻¹⁴
1 × 10⁻¹⁶
1 × 10⁻⁷
Answer: 2
प्रश्न 7. ब्रॉन्स्टेड–लॉरी के अनुसार अम्ल है:
इलेक्ट्रॉन युग्म ग्राही
इलेक्ट्रॉन युग्म दाता
प्रोटॉन दाता
प्रोटॉन ग्राही
Answer: 3
प्रश्न 8. यदि किसी विलयन में [H⁺] = 1 × 10⁻³ mol L⁻¹ है, तो pH होगा:
3
11
1
7
Answer: 1
प्रश्न 9. सामान्य आयन प्रभाव किसमें देखा जाता है?
वाष्प दाब
घुलनशीलता का दमन
ऊष्मा धारिता
दाब–आयतन कार्य
Answer: 2
प्रश्न 10 (A/R).
कथन (A): ताप बढ़ाने पर ऊष्माशोषी अभिक्रिया का K बढ़ता है।
कारण (R): ताप बढ़ाने से साम्य उस ओर खिसकता है जहाँ ऊष्मा का उपभोग होता है।
Answer: 1
प्रश्न 11. एक क्षीण एकमानिक अम्ल के लिए, यदि α बहुत छोटा हो, तो ओस्टवाल्ड पतलीकरण नियम देता है:
Ka = Cα²
Ka = C/α
Ka = α/C
Ka = Cα
Answer: 1
प्रश्न 12. विलयन में क्षारकीय लवण Na₂CO₃ का घोल होगा:
अम्लीय
उदासीन
क्षारीय
दोलनशील
Answer: 3
प्रश्न 13. यदि Q (आयितांक) < K हो, तो साम्य प्राप्त करने के लिए अभिक्रिया:
बाएँ जाएगी
दाएँ जाएगी
स्थिर रहेगी
ताप पर निर्भर
Answer: 2
प्रश्न 14. विलयन में बफर का मुख्य कार्य है:
ताप स्थिर रखना
दाब स्थिर रखना
pH में परिवर्तन का प्रतिरोध करना
आयतन स्थिर रखना
Answer: 3
प्रश्न 15 (A/R).
कथन (A): मजबूत अम्ल का 0.001 M विलयन, क्षीण अम्ल के 0.001 M विलयन से अधिक चालकता दर्शाता है।
कारण (R): मजबूत अम्ल पूर्णतः आयनित हो जाता है, क्षीण अम्ल आंशिक आयनित होता है।
Answer: 1
प्रश्न 16. विलेय AB(s) ⇌ A⁺(aq) + B⁻(aq) के लिए घुलनशीलता गुणनफल है:
Ksp = [AB]
Ksp = [A⁺] + [B⁻]
Ksp = [A⁺][B⁻]
Ksp = [A⁺]/[B⁻]
Answer: 3
खंड B — अति लघु उत्तरीय प्रश्न (Q17–Q21, प्रत्येक 2 अंक)
प्रश्न 17. रासायनिक साम्यावस्था का लक्षण लिखिए।
उत्तर:
🟦 अग्रगामी व प्रतिगामी वेग बराबर होते हैं; सांद्रताएँ समय के साथ स्थिर।
🟩 साम्य गतिशील होता है; अणु-स्तर पर अभिक्रिया चलती रहती है।
प्रश्न 18. ले-शातेलिए सिद्धान्त का संक्षिप्त कथन लिखिए।
उत्तर:
🟦 किसी प्रतिकूल परिवर्तन (ताप, दाब, सांद्रता) पर तन्त्र ऐसा परिवर्तन करता है जिससे उसका प्रभाव न्यूनतम हो।
🟩 अतः साम्य नई स्थिति पर खिसकता है।
प्रश्न 19. 25 °C पर जल में [H⁺] = 1 × 10⁻⁷ mol L⁻¹ क्यों होता है?
उत्तर:
🟦 Kw = [H⁺][OH⁻] = 1 × 10⁻¹⁴; उदासीन दशा में [H⁺] = [OH⁻]।
🟩 अतः [H⁺] = √Kw = 1 × 10⁻⁷ mol L⁻¹।
प्रश्न 20. क्षीण अम्ल HA के 0.10 M विलयन में α = 0.02 हो, तो Ka का मान ज्ञात करें (सरलीकृत रूप Ka = Cα²)।
उत्तर:
➤ सूत्र: Ka = Cα²
➤ प्रतिस्थापन: Ka = 0.10 × (0.02)² = 0.10 × 0.0004 = 4.0 × 10⁻⁵
✅ परिणाम: Ka = 4.0 × 10⁻⁵
प्रश्न 21. सामान्य आयन प्रभाव का एक अनुप्रयोग लिखिए।
उत्तर:
🟦 घुलनशीलता का दमन: AgCl में Cl⁻ सामान्य आयन जोड़ने पर घुलनशीलता घटती है।
🟩 विश्लेषणात्मक अवक्षेपण में सूक्ष्म आयनों को अलग करने में सहायक।
खंड C — लघु उत्तरीय प्रश्न (Q22–Q28, प्रत्येक 3 अंक)
प्रश्न 22. अभिक्रिया N₂O₄(g) ⇌ 2NO₂(g) के लिए Δn = +1 है। 25 °C पर Kc = 0.25 हो तो Kp ज्ञात करें।
उत्तर:
➤ सम्बन्ध: Kp = Kc (RT)^Δn
➤ प्रतिस्थापन: R = 0.0821 L atm mol⁻¹ K⁻¹, T = 298 K, Δn = 1
Kp = 0.25 × (0.0821 × 298) ≈ 0.25 × 24.5 ≈ 6.13
✅ उत्तर: Kp ≈ 6.1 (लगभग)
प्रश्न 23. 1 L पात्र में अभिक्रिया A ⇌ B के लिए प्रारम्भ में केवल A के 1 mol हैं। साम्य पर A के 0.6 mol शेष हैं। Kc ज्ञात कीजिए।
उत्तर:
🟦 प्रारम्भ: [A] = 1.0, [B] = 0
🟩 परिवर्तन: A में 0.4 घटा ⇒ B में 0.4 बढ़ा
🧮 Kc = [B]/[A] = 0.4/0.6 = 2/3 = 0.667
✅ उत्तर: Kc = 0.667
प्रश्न 24. बफर घोल कैसे pH को स्थिर रखता है? अम्लीय बफर का सामान्य युग्म लिखिए।
उत्तर:
🟦 रचना: दुर्बल अम्ल (HA) + उसका लवण (A⁻) → जोड़े गए H⁺/OH⁻ को निष्क्रिय करते हैं।
🟩 अम्लीय बफर उदाहरण: CH₃COOH / CH₃COONa (सिद्धान्त रूप से HA/A⁻ युग्म)।
🟪 परिणाम: pH में परिवर्तन का प्रतिरोध।
प्रश्न 25. घुलनशीलता गुणनफल से घुलनशीलता (s) कैसे निकालते हैं? AgCl के लिए व्यक्त कीजिए।
उत्तर:
🟦 AgCl(s) ⇌ Ag⁺ + Cl⁻; Ksp = [Ag⁺][Cl⁻]
🟩 शुद्ध जल में: [Ag⁺] = [Cl⁻] = s ⇒ Ksp = s²
🧮 अतः s = √Ksp
प्रश्न 26. अभिक्रिया 2SO₂(g) + O₂(g) ⇌ 2SO₃(g) पर दाब बढ़ाने का प्रभाव बताइए।
उत्तर:
🟦 बाएँ पक्ष पर कुल 3 mol गैस, दाएँ पर 2 mol।
🟩 दाब बढ़ाने पर साम्य कम मोल वाली ओर खिसकेगा।
✅ परिणाम: SO₃ बनने की प्रवृत्ति बढ़ेगी।
प्रश्न 27. क्षीण क्षार BOH के लिए Kb, C तथा α के बीच सम्बन्ध लिखिए और छोटा α मानकर सरल रूप निकालिए।
उत्तर:
🟦 सामान्य: Kb = (Cα²)/(1 − α)
🟩 यदि α ≪ 1 ⇒ 1 − α ≈ 1
✅ सरलीकृत: Kb ≈ Cα²
प्रश्न 28. 25 °C पर एक संतृप्त विलयन में Mg(OH)₂ का Ksp = 1.2 × 10⁻¹¹ है। शुद्ध जल में [OH⁻] ज्ञात कीजिए।
उत्तर:
🟦 Mg(OH)₂(s) ⇌ Mg²⁺ + 2OH⁻; मान लें घुलनशीलता = s
🟩 [Mg²⁺] = s, [OH⁻] = 2s ⇒ Ksp = s(2s)² = 4s³
➤ s³ = Ksp/4 = 1.2×10⁻¹¹ / 4 = 3.0×10⁻¹² ⇒ s = 1.44×10⁻⁴ mol L⁻¹ (लगभग)
✅ [OH⁻] = 2s ≈ 2.88 × 10⁻⁴ mol L⁻¹
खंड D — प्रकरण आधारित प्रश्न (Q29–Q30, प्रत्येक 4 अंक)
प्रश्न 29.
“अभिक्रिया N₂(g) + 3H₂(g) ⇌ 2NH₃(g) ऊष्माक्षेपी है।”
(i) ताप बढ़ाने पर साम्य किस ओर खिसकेगा? (1)
(ii) दाब बढ़ाने का प्रभाव क्या होगा? (1)
(iii) इस अभिक्रिया में उत्प्रेरक की भूमिका स्पष्ट कीजिए। (2)
उत्तर:
🟦 (i) ताप बढ़ाने पर साम्य बाएँ (अभिकारकों) की ओर खिसकेगा।
🟩 (ii) दाब बढ़ाने पर साम्य उस ओर जाएगा जहाँ गैस के मोल कम हैं ⇒ दाएँ (NH₃ का निर्माण)।
🟪 (iii) उत्प्रेरक केवल साम्य तक पहुँचने की गति बढ़ाता है, साम्य स्थिति (K) नहीं बदलता।
प्रश्न 30.
25 °C पर CH₃COOH (0.1 M) का pH लगभग 2.9 पाया गया।
(i) [H⁺] की गणना कीजिए। (1)
(ii) आयनीकरण डिग्री (α) ज्ञात कीजिए। (1)
(iii) Ka का मान निकालिए। (2)
उत्तर:
🟦 (i) pH = 2.9 ⇒ [H⁺] = 10⁻²·⁹ ≈ 1.26 × 10⁻³ M
🟩 (ii) α = [H⁺]/C = 1.26×10⁻³ / 0.1 = 0.0126 ≈ 1.3 %
🟪 (iii) Ka = Cα² = 0.1 × (0.0126)² = 0.1 × 1.59×10⁻⁴ = 1.59×10⁻⁵
✅ उत्तर: Ka ≈ 1.6 × 10⁻⁵
खंड E — दीर्घ उत्तरीय प्रश्न (Q31–Q33, प्रत्येक 5 अंक)
प्रश्न 31.
ले-शातेलिए का सिद्धान्त विस्तार से समझाइए और इसके दो अनुप्रयोग दीजिए।
उत्तर:
🟦 सिद्धान्त: जब किसी साम्य पर ताप, दाब अथवा सांद्रता का परिवर्तन किया जाता है, तो तन्त्र ऐसा परिवर्तन करता है जिससे प्रभाव न्यूनतम हो।
🟩 अनुप्रयोग:
औद्योगिक NH₃ निर्माण (हैबर प्रक्रिया): दाब बढ़ाने से NH₃ उत्पादन बढ़ता है।
औद्योगिक H₂SO₄ निर्माण (कॉन्टैक्ट प्रक्रिया): ताप घटाने से SO₃ उत्पादन बढ़ता है।
✅ निष्कर्ष: यह सिद्धान्त साम्य परिवर्तन की दिशा की भविष्यवाणी करता है।
या
घुलनशीलता गुणनफल (Ksp) का सिद्धान्त समझाइए तथा अवक्षेपण की शर्त बताइए।
प्रश्न 32.
0.1 M अमोनिया (Kb = 1.8 × 10⁻⁵) के विलयन का pH ज्ञात कीजिए।
उत्तर:
🟦 Kb = Cα² ⇒ α = √(Kb/C) = √(1.8×10⁻⁵ / 0.1) = √(1.8×10⁻⁴) ≈ 0.0134
🟩 [OH⁻] = Cα = 0.1 × 0.0134 = 1.34 × 10⁻³ M
🧮 pOH = −log(1.34×10⁻³) ≈ 2.87
pH = 14 − 2.87 = 11.13
✅ उत्तर: pH ≈ 11.1
या
बफर घोल की क्रिया-विधि समझाइए और हैण्डरसन–हैसेलबाल्च समीकरण लिखिए।
प्रश्न 33.
ऑस्टवाल्ड पतलीकरण नियम की व्याख्या कीजिए और इसे क्षीण अम्ल पर लागू कर Ka की अभिव्यक्ति निकालिए।
उत्तर:
🟦 कथन: क्षीण इलेक्ट्रोलाइट के आयनीकरण की डिग्री सांद्रता घटने पर बढ़ती है।
🟩 अभिव्यक्ति:
HA ⇌ H⁺ + A⁻
प्रारम्भिक सांद्रता = C, साम्य पर = C(1 − α), H⁺ = Cα, A⁻ = Cα
Ka = [H⁺][A⁻]/[HA] = Cα²/(1 − α)
🟪 यदि α ≪ 1 ⇒ Ka ≈ Cα²
✅ निष्कर्ष: पतला करने पर α बढ़ता है।
या
pH, pOH, [H⁺] और [OH⁻] में सम्बन्ध व्युत्पन्न कीजिए और एक उदाहरण द्वारा स्पष्ट कीजिए।
————————————————————————————————————————————————————————————————————————————
Neet पिछले सालों के प्रश्न
🔵 प्रश्न 1:
जब साम्यावस्था में किसी गैसीय अभिक्रिया पर दाब बढ़ाई जाती है तो साम्य किस ओर स्थानांतरित होता है?
🔴 ① अधिक गैस अणुओं की ओर
🟢 ② कम गैस अणुओं की ओर
🟡 ③ कोई परिवर्तन नहीं
🔵 ④ तापमान पर निर्भर
🟢 उत्तर: ② कम गैस अणुओं की ओर
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: P
🔵 प्रश्न 2:
Le-Chatelier का सिद्धांत किससे सम्बन्धित है?
🔴 ① आयनीकरण
🟢 ② साम्यावस्था में गड़बड़ी का प्रभाव
🟡 ③ घुलनशीलता
🔵 ④ उदासीनीकरण
🟢 उत्तर: ② साम्यावस्था में गड़बड़ी का प्रभाव
📘 परीक्षा: AIPMT
📅 वर्ष: 2013 | सेट: B
🔵 प्रश्न 3:
Kp और Kc के बीच संबंध क्या है?
🔴 ① Kp = Kc (RT)^(Δn)
🟢 ② Kp = Kc / (RT)^(Δn)
🟡 ③ Kp = 1/Kc
🔵 ④ Kp = Kc × Δn
🟢 उत्तर: ① Kp = Kc (RT)^(Δn)
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: Q
🔵 प्रश्न 4:
यदि ΔG = 0 है तो अभिक्रिया किस अवस्था में है?
🔴 ① स्वतःस्फूर्त
🟢 ② साम्यावस्था
🟡 ③ अस्वतःस्फूर्त
🔵 ④ असंभव
🟢 उत्तर: ② साम्यावस्था
📘 परीक्षा: NEET
📅 वर्ष: 2021 | सेट: O
🔵 प्रश्न 5:
Haber प्रक्रिया में अमोनिया की उपज बढ़ाने के लिए क्या किया जाता है?
🔴 ① दाब बढ़ाना
🟢 ② तापमान बढ़ाना
🟡 ③ दाब घटाना
🔵 ④ निष्क्रिय गैस मिलाना
🟢 उत्तर: ① दाब बढ़ाना
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: K
🔵 प्रश्न 6:
H₂(g) + I₂(g) ⇌ 2HI(g) में यदि H₂ और I₂ की मात्रा बराबर ली जाए तो साम्य पर HI की सांद्रता क्या होगी?
🔴 ① अधिकतम
🟢 ② न्यूनतम
🟡 ③ शून्य
🔵 ④ अनिश्चित
🟢 उत्तर: ① अधिकतम
📘 परीक्षा: AIPMT
📅 वर्ष: 2010 | सेट: C
🔵 प्रश्न 7:
किसी लवण का विलयन संतृप्त अवस्था में होता है जब:
🔴 ① और लवण घुल सकता है
🟢 ② विलेय की दर = अवक्षेपण की दर
🟡 ③ विलेय स्थिर है
🔵 ④ घुलनशीलता न्यूनतम है
🟢 उत्तर: ② विलेय की दर = अवक्षेपण की दर
📘 परीक्षा: NEET
📅 वर्ष: 2015 | सेट: L
🔵 प्रश्न 8:
Kc का मान किस पर निर्भर करता है?
🔴 ① तापमान
🟢 ② सांद्रता
🟡 ③ दाब
🔵 ④ आयतन
🟢 उत्तर: ① तापमान
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: R
🔵 प्रश्न 9:
यदि किसी अभिक्रिया का Kc बहुत बड़ा है तो इसका अर्थ है:
🔴 ① साम्य वाम की ओर है
🟢 ② साम्य दाहिनी ओर है
🟡 ③ साम्य स्थिति अस्थिर है
🔵 ④ कोई नहीं
🟢 उत्तर: ② साम्य दाहिनी ओर है
📘 परीक्षा: AIPMT
📅 वर्ष: 2012 | सेट: B
🔵 प्रश्न 10:
यदि Kp = Kc हो तो Δn का मान क्या होगा?
🔴 ① 1
🟢 ② 0
🟡 ③ 2
🔵 ④ -1
🟢 उत्तर: ② 0
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: J
🔵 प्रश्न 11:
साम्यावस्था स्थिरांक K का मान किससे प्रभावित नहीं होता है?
🔴 ① तापमान
🟢 ② उत्प्रेरक
🟡 ③ दाब
🔵 ④ आयतन
🟢 उत्तर: ② उत्प्रेरक
📘 परीक्षा: NEET
📅 वर्ष: 2013 | सेट: D
🔵 प्रश्न 12:
यदि Qc > Kc हो तो अभिक्रिया किस दिशा में चलेगी?
🔴 ① आगे की ओर
🟢 ② पीछे की ओर
🟡 ③ साम्य पर
🔵 ④ कोई नहीं
🟢 उत्तर: ② पीछे की ओर
📘 परीक्षा: NEET
📅 वर्ष: 2020 | सेट: S
🔵 प्रश्न 13:
यदि ΔG = –RT lnK हो, तो ΔG° का शून्य होना क्या दर्शाता है?
🔴 ① K = 1
🟢 ② K > 1
🟡 ③ K < 1
🔵 ④ कोई नहीं
🟢 उत्तर: ① K = 1
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: L
🔵 प्रश्न 14:
साम्यावस्था स्थिरांक K का मान किस प्रकार की राशि है?
🔴 ① पथ फलन
🟢 ② अवस्था फलन
🟡 ③ चर राशि
🔵 ④ कार्य फलन
🟢 उत्तर: ② अवस्था फलन
📘 परीक्षा: AIPMT
📅 वर्ष: 2011 | सेट: C
🔵 प्रश्न 15:
निम्नलिखित में से किस स्थिति में घुलनशीलता घटेगी?
🔴 ① तापमान बढ़ाने पर उष्माक्षेपी अभिक्रिया में
🟢 ② तापमान घटाने पर उष्माशोषी अभिक्रिया में
🟡 ③ दाब बढ़ाने पर
🔵 ④ कोई नहीं
🟢 उत्तर: ① तापमान बढ़ाने पर उष्माक्षेपी अभिक्रिया में
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: P
🔵 प्रश्न 16:
किसी संतुलित अभिक्रिया के लिए Q = K होने पर स्थिति क्या होगी?
🔴 ① अभिक्रिया स्वतःस्फूर्त होगी
🟢 ② अभिक्रिया साम्यावस्था में है
🟡 ③ अभिक्रिया असंभव है
🔵 ④ कोई नहीं
🟢 उत्तर: ② अभिक्रिया साम्यावस्था में है
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: R
🔵 प्रश्न 17:
किस स्थिति में Kp = Kc होगा?
🔴 ① जब Δn = 0
🟢 ② जब Δn = 1
🟡 ③ जब Δn = 2
🔵 ④ जब Δn = –1
🟢 उत्तर: ① जब Δn = 0
📘 परीक्षा: AIPMT
📅 वर्ष: 2014 | सेट: D
🔵 प्रश्न 18:
जैसे-जैसे K का मान बड़ा होता है, अभिक्रिया की दिशा कैसी होगी?
🔴 ① वाम की ओर
🟢 ② दाहिनी ओर
🟡 ③ साम्य पर
🔵 ④ कोई नहीं
🟢 उत्तर: ② दाहिनी ओर
📘 परीक्षा: NEET
📅 वर्ष: 2015 | सेट: M
🔵 प्रश्न 19:
निम्नलिखित में से किस पर उत्प्रेरक का प्रभाव नहीं पड़ता?
🔴 ① साम्यावस्था की स्थिति
🟢 ② साम्यावस्था प्राप्त करने की दर
🟡 ③ अग्रगामी अभिक्रिया
🔵 ④ प्रतिगामी अभिक्रिया
🟢 उत्तर: ① साम्यावस्था की स्थिति
📘 परीक्षा: NEET
📅 वर्ष: 2012 | सेट: B
🔵 प्रश्न 20:
यदि ΔH ऋणात्मक और ΔS ऋणात्मक है तो साम्य किस पर निर्भर करेगा?
🔴 ① उच्च तापमान पर स्वतःस्फूर्त
🟢 ② निम्न तापमान पर स्वतःस्फूर्त
🟡 ③ कोई प्रभाव नहीं
🔵 ④ अस्वतःस्फूर्त
🟢 उत्तर: ② निम्न तापमान पर स्वतःस्फूर्त
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: J
🔵 प्रश्न 21:
किसी साम्यावस्था में ठोस या द्रव को क्यों नहीं शामिल किया जाता?
🔴 ① उनका दाब स्थिर रहता है
🟢 ② उनकी सांद्रता स्थिर रहती है
🟡 ③ वे अप्रभावी होते हैं
🔵 ④ उनका ΔG शून्य होता है
🟢 उत्तर: ② उनकी सांद्रता स्थिर रहती है
📘 परीक्षा: AIPMT
📅 वर्ष: 2011 | सेट: A
🔵 प्रश्न 22:
Haber प्रक्रिया में उपयुक्त उत्प्रेरक कौन-सा है?
🔴 ① V₂O₅
🟢 ② Fe
🟡 ③ Pt
🔵 ④ Al₂O₃
🟢 उत्तर: ② Fe
📘 परीक्षा: NEET
📅 वर्ष: 2020 | सेट: L
🔵 प्रश्न 23:
साम्यावस्था स्थिरांक किसका माप है?
🔴 ① गति
🟢 ② सीमा
🟡 ③ कार्य
🔵 ④ एन्थैल्पी
🟢 उत्तर: ② सीमा
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: S
🔵 प्रश्न 24:
यदि किसी गैसीय अभिक्रिया में Δn > 0 हो, तो दाब बढ़ाने पर साम्य किस ओर खिसकेगा?
🔴 ① अग्रगामी
🟢 ② प्रतिगामी
🟡 ③ साम्य पर रहेगा
🔵 ④ कोई नहीं
🟢 उत्तर: ② प्रतिगामी
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: M
🔵 प्रश्न 25:
Kc का मान बहुत छोटा होने पर किसकी संभावना अधिक है?
🔴 ① अग्रगामी अभिक्रिया
🟢 ② प्रतिगामी अभिक्रिया
🟡 ③ साम्य की स्थिति
🔵 ④ कोई नहीं
🟢 उत्तर: ② प्रतिगामी अभिक्रिया
📘 परीक्षा: AIPMT
📅 वर्ष: 2010 | सेट: C
🔵 प्रश्न 26:
यदि Qc < Kc हो तो अभिक्रिया किस दिशा में आगे बढ़ेगी?
🔴 ① अग्रगामी दिशा
🟢 ② प्रतिगामी दिशा
🟡 ③ साम्य पर
🔵 ④ कोई नहीं
🟢 उत्तर: ① अग्रगामी दिशा
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: T
🔵 प्रश्न 27:
N₂O₄(g) ⇌ 2NO₂(g) अभिक्रिया में दाब बढ़ाने पर साम्य किस ओर खिसकेगा?
🔴 ① NO₂ की ओर
🟢 ② N₂O₄ की ओर
🟡 ③ कोई परिवर्तन नहीं
🔵 ④ निर्भर करता है
🟢 उत्तर: ② N₂O₄ की ओर
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: J
🔵 प्रश्न 28:
2SO₂(g) + O₂(g) ⇌ 2SO₃(g) में दाब बढ़ाने पर साम्य किस ओर जाएगा?
🔴 ① SO₂
🟢 ② SO₃
🟡 ③ O₂
🔵 ④ कोई नहीं
🟢 उत्तर: ② SO₃
📘 परीक्षा: AIPMT
📅 वर्ष: 2012 | सेट: A
🔵 प्रश्न 29:
यदि ΔG > 0 हो तो अभिक्रिया कैसी होगी?
🔴 ① स्वतःस्फूर्त
🟢 ② अस्वतःस्फूर्त
🟡 ③ साम्यावस्था
🔵 ④ असंभव
🟢 उत्तर: ② अस्वतःस्फूर्त
📘 परीक्षा: NEET
📅 वर्ष: 2021 | सेट: R
🔵 प्रश्न 30:
साम्यावस्था स्थिरांक किस प्रकार का होता है?
🔴 ① केवल आयामहीन
🟢 ② तापमान पर निर्भर
🟡 ③ दाब पर निर्भर
🔵 ④ सांद्रता पर निर्भर
🟢 उत्तर: ② तापमान पर निर्भर
📘 परीक्षा: NEET
📅 वर्ष: 2013 | सेट: D
🔵 प्रश्न 31:
यदि ΔH = ऋणात्मक है और तापमान बढ़ा दिया जाए तो साम्य किस ओर जाएगा?
🔴 ① अग्रगामी
🟢 ② प्रतिगामी
🟡 ③ स्थिर रहेगा
🔵 ④ कोई नहीं
🟢 उत्तर: ② प्रतिगामी
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: M
🔵 प्रश्न 32:
H₂(g) + Cl₂(g) ⇌ 2HCl(g) में Δn का मान क्या है?
🔴 ① 0
🟢 ② 1
🟡 ③ 2
🔵 ④ –1
🟢 उत्तर: ① 0
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: L
🔵 प्रश्न 33:
यदि ΔH = धनात्मक हो तो किस स्थिति में अभिक्रिया स्वतःस्फूर्त होगी?
🔴 ① उच्च तापमान पर
🟢 ② निम्न तापमान पर
🟡 ③ सभी तापमान पर
🔵 ④ कभी नहीं
🟢 उत्तर: ① उच्च तापमान पर
📘 परीक्षा: NEET
📅 वर्ष: 2015 | सेट: N
🔵 प्रश्न 34:
उत्प्रेरक का कार्य क्या है?
🔴 ① साम्यावस्था बदलना
🟢 ② साम्य की प्राप्ति की गति बदलना
🟡 ③ एन्थैल्पी बदलना
🔵 ④ साम्यावस्था स्थिरांक बदलना
🟢 उत्तर: ② साम्य की प्राप्ति की गति बदलना
📘 परीक्षा: AIPMT
📅 वर्ष: 2011 | सेट: B
🔵 प्रश्न 35:
यदि Q = K हो तो अभिक्रिया की स्थिति क्या है?
🔴 ① अग्रगामी
🟢 ② साम्यावस्था
🟡 ③ प्रतिगामी
🔵 ④ असंभव
🟢 उत्तर: ② साम्यावस्था
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: K
🔵 प्रश्न 36:
2HI(g) ⇌ H₂(g) + I₂(g) में HI का अपघटन बढ़ाने के लिए क्या करना चाहिए?
🔴 ① दाब बढ़ाना
🟢 ② तापमान बढ़ाना
🟡 ③ HI की मात्रा बढ़ाना
🔵 ④ निष्क्रिय गैस मिलाना
🟢 उत्तर: ② तापमान बढ़ाना
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: L
🔵 प्रश्न 37:
Kp = Kc किस स्थिति में होगा?
🔴 ① Δn = 0
🟢 ② Δn = 1
🟡 ③ Δn = –1
🔵 ④ Δn = 2
🟢 उत्तर: ① Δn = 0
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: Q
🔵 प्रश्न 38:
Le-Chatelier का सिद्धांत किसके लिए प्रयोग किया जाता है?
🔴 ① साम्यावस्था परिवर्तन की दिशा बताने हेतु
🟢 ② एंट्रॉपी निकालने हेतु
🟡 ③ गिब्स ऊर्जा निकालने हेतु
🔵 ④ उत्प्रेरक की सक्रियता हेतु
🟢 उत्तर: ① साम्यावस्था परिवर्तन की दिशा बताने हेतु
📘 परीक्षा: AIPMT
📅 वर्ष: 2012 | सेट: C
🔵 प्रश्न 39:
यदि ΔG < 0 है तो अभिक्रिया कैसी होगी?
🔴 ① स्वतःस्फूर्त
🟢 ② अस्वतःस्फूर्त
🟡 ③ साम्य पर
🔵 ④ कोई नहीं
🟢 उत्तर: ① स्वतःस्फूर्त
📘 परीक्षा: NEET
📅 वर्ष: 2020 | सेट: S
🔵 प्रश्न 40:
साम्य स्थिरांक का बड़ा मान दर्शाता है:
🔴 ① उत्पादों का प्रभुत्व
🟢 ② अभिकारकों का प्रभुत्व
🟡 ③ दोनों बराबर
🔵 ④ असंभव स्थिति
🟢 उत्तर: ① उत्पादों का प्रभुत्व
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: O
🔵 प्रश्न 41:
यदि किसी अभिक्रिया का Kp बहुत छोटा है तो किसकी संभावना है?
🔴 ① उत्पादों की
🟢 ② अभिकारकों की
🟡 ③ साम्य की
🔵 ④ कोई नहीं
🟢 उत्तर: ② अभिकारकों की
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: N
🔵 प्रश्न 42:
H₂O(l) ⇌ H₂O(g) में तापमान बढ़ाने पर साम्य किस ओर खिसकेगा?
🔴 ① तरल की ओर
🟢 ② गैस की ओर
🟡 ③ स्थिर रहेगा
🔵 ④ कोई नहीं
🟢 उत्तर: ② गैस की ओर
📘 परीक्षा: AIPMT
📅 वर्ष: 2014 | सेट: A
🔵 प्रश्न 43:
यदि Qc > Kc हो तो साम्य किस दिशा में बढ़ेगा?
🔴 ① अग्रगामी
🟢 ② प्रतिगामी
🟡 ③ साम्य पर
🔵 ④ कोई नहीं
🟢 उत्तर: ② प्रतिगामी
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: J
🔵 प्रश्न 44:
साम्य स्थिरांक का मान किस पर निर्भर करता है?
🔴 ① केवल तापमान
🟢 ② दाब
🟡 ③ आयतन
🔵 ④ उत्प्रेरक
🟢 उत्तर: ① केवल तापमान
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: P
🔵 प्रश्न 45:
साम्यावस्था प्राप्त करने की गति किससे बढ़ाई जा सकती है?
🔴 ① उत्प्रेरक से
🟢 ② दाब घटाकर
🟡 ③ तापमान घटाकर
🔵 ④ विलयन को पतला कर
🟢 उत्तर: ① उत्प्रेरक से
📘 परीक्षा: NEET
📅 वर्ष: 2015 | सेट: M
🔵 प्रश्न 46:
Le-Chatelier का सिद्धांत किस अभिक्रिया की व्याख्या करता है?
🔴 ① प्रतिवर्ती अभिक्रिया
🟢 ② अपरिवर्ती अभिक्रिया
🟡 ③ स्वतःस्फूर्त अभिक्रिया
🔵 ④ अस्वतःस्फूर्त अभिक्रिया
🟢 उत्तर: ① प्रतिवर्ती अभिक्रिया
📘 परीक्षा: AIPMT
📅 वर्ष: 2011 | सेट: C
🔵 प्रश्न 47:
यदि Δn > 0 हो तो दाब बढ़ाने पर साम्य किस ओर जाएगा?
🔴 ① अग्रगामी
🟢 ② प्रतिगामी
🟡 ③ स्थिर रहेगा
🔵 ④ कोई नहीं
🟢 उत्तर: ② प्रतिगामी
📘 परीक्षा: NEET
📅 वर्ष: 2013 | सेट: B
🔵 प्रश्न 48:
यदि साम्य स्थिरांक K बहुत बड़ा है तो अभिक्रिया:
🔴 ① अभिकारकों की ओर
🟢 ② उत्पादों की ओर
🟡 ③ साम्य पर
🔵 ④ असंभव
🟢 उत्तर: ② उत्पादों की ओर
📘 परीक्षा: NEET
📅 वर्ष: 2020 | सेट: K
🔵 प्रश्न 49:
यदि साम्य स्थिरांक K बहुत छोटा है तो अभिक्रिया:
🔴 ① अभिकारकों की ओर
🟢 ② उत्पादों की ओर
🟡 ③ दोनों ओर
🔵 ④ कोई नहीं
🟢 उत्तर: ① अभिकारकों की ओर
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: N
🔵 प्रश्न 50:
Le-Chatelier का सिद्धांत कहता है:
🔴 ① साम्यावस्था बाहरी परिवर्तन का विरोध करती है
🟢 ② साम्यावस्था बाहरी परिवर्तन को बढ़ाती है
🟡 ③ साम्यावस्था स्थिर रहती है
🔵 ④ साम्यावस्था उत्प्रेरक पर निर्भर करती है
🟢 उत्तर: ① साम्यावस्था बाहरी परिवर्तन का विरोध करती है
📘 परीक्षा: NEET
📅 वर्ष: 2012 | सेट: A
————————————————————————————————————————————————————————————————————————————
JEE MAINS पिछले सालों के प्रश्न
🔵 प्रश्न 1:
साम्यावस्था किस स्थिति में प्राप्त होती है?
🔴 ① अग्रगामी अभिक्रिया रुक जाती है
🟢 ② अग्रगामी एवं प्रतिगामी अभिक्रियाओं की दर समान हो जाती है
🟡 ③ अभिक्रिया पूर्णतः समाप्त हो जाती है
🔵 ④ उत्पाद की सांद्रता शून्य हो जाती है
🟢 उत्तर: ② अग्रगामी एवं प्रतिगामी अभिक्रियाओं की दर समान हो जाती है
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Morning
🔵 प्रश्न 2:
रासायनिक साम्यावस्था का अध्ययन किस वैज्ञानिक ने किया था?
🔴 ① बॉयल
🟢 ② ले-शातेलियर
🟡 ③ न्यूटन
🔵 ④ आर्हेनियस
🟢 उत्तर: ② ले-शातेलियर
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Evening
🔵 प्रश्न 3:
साम्य स्थिरांक (Kc) किन पर निर्भर करता है?
🔴 ① तापमान
🟢 ② उत्प्रेरक
🟡 ③ दाब
🔵 ④ प्रारम्भिक सांद्रता
🟢 उत्तर: ① तापमान
📘 परीक्षा: JEE Main
📅 वर्ष: 2021 | शिफ़्ट: Morning
🔵 प्रश्न 4:
A ⇌ B + C के लिए यदि दाब घटा दिया जाए, तो साम्यावस्था —
🔴 ① बाएँ खिसकेगी
🟢 ② दाएँ खिसकेगी
🟡 ③ अपरिवर्तित रहेगी
🔵 ④ पहले बाएँ फिर दाएँ जाएगी
🟢 उत्तर: ② दाएँ खिसकेगी
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: Evening
🔵 प्रश्न 5:
यदि अभिक्रिया ऊष्माक्षेपी (exothermic) है, तो तापमान बढ़ाने से साम्यावस्था —
🔴 ① दाएँ जाएगी
🟢 ② बाएँ जाएगी
🟡 ③ अपरिवर्तित रहेगी
🔵 ④ रुक जाएगी
🟢 उत्तर: ② बाएँ जाएगी
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: Morning
🔵 प्रश्न 6:
ले-शातेलियर का सिद्धांत किससे सम्बंधित है?
🔴 ① दाब
🟢 ② तापमान एवं दाब के प्रभाव से साम्य में परिवर्तन
🟡 ③ सांद्रता
🔵 ④ उत्प्रेरक
🟢 उत्तर: ② तापमान एवं दाब के प्रभाव से साम्य में परिवर्तन
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Evening
🔵 प्रश्न 7:
यदि किसी अभिक्रिया का साम्य स्थिरांक Kc = 1 है, तो —
🔴 ① उत्पाद अधिक हैं
🟢 ② अभिकारक और उत्पाद लगभग समान मात्रा में हैं
🟡 ③ अभिकारक अधिक हैं
🔵 ④ अभिक्रिया पूर्ण नहीं है
🟢 उत्तर: ② अभिकारक और उत्पाद लगभग समान मात्रा में हैं
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | शिफ़्ट: Morning
🔵 प्रश्न 8:
यदि Kp = Kc हो, तो —
🔴 ① Δn = 0
🟢 ② Δn = 1
🟡 ③ Δn = 2
🔵 ④ Δn = –1
🟢 उत्तर: ① Δn = 0
📘 परीक्षा: JEE Main
📅 वर्ष: 2022 | शिफ़्ट: Morning
🔵 प्रश्न 9:
2SO₂ + O₂ ⇌ 2SO₃ अभिक्रिया में दाब बढ़ाने से साम्य किस दिशा में जाएगा?
🔴 ① बाएँ
🟢 ② दाएँ
🟡 ③ अपरिवर्तित
🔵 ④ पहले बाएँ फिर दाएँ
🟢 उत्तर: ② दाएँ
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: Morning
🔵 प्रश्न 10:
CO + H₂O ⇌ CO₂ + H₂ अभिक्रिया में उत्प्रेरक का प्रभाव क्या होगा?
🔴 ① साम्य स्थिरांक बदलेगा
🟢 ② साम्य शीघ्र प्राप्त होगा
🟡 ③ साम्य दिशा बदलेगी
🔵 ④ उत्पाद की मात्रा घटेगी
🟢 उत्तर: ② साम्य शीघ्र प्राप्त होगा
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Morning
🔵 प्रश्न 11:
Kp और Kc का सम्बन्ध है —
🔴 ① Kp = Kc(RT)Δn
🟢 ② Kp = Kc/(RT)Δn
🟡 ③ Kp = Kc × P
🔵 ④ Kp = Kc/R
🟢 उत्तर: ① Kp = Kc(RT)Δn
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: Evening
🔵 प्रश्न 12:
यदि Δn = 0 है, तो Kp और Kc के बीच सम्बन्ध —
🔴 ① Kp > Kc
🟢 ② Kp = Kc
🟡 ③ Kp < Kc
🔵 ④ कोई सम्बन्ध नहीं
🟢 उत्तर: ② Kp = Kc
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | शिफ़्ट: Evening
🔵 प्रश्न 13:
H₂ + I₂ ⇌ 2HI, यदि I₂ की मात्रा बढ़ा दी जाए तो —
🔴 ① साम्य दाएँ खिसकेगा
🟢 ② साम्य बाएँ खिसकेगा
🟡 ③ कोई परिवर्तन नहीं
🔵 ④ उत्पाद घटेंगे
🟢 उत्तर: ① साम्य दाएँ खिसकेगा
📘 परीक्षा: JEE Main
📅 वर्ष: 2021 | शिफ़्ट: Morning
🔵 प्रश्न 14:
Kc का आयाम (dimension) किस पर निर्भर करता है?
🔴 ① अभिक्रिया के तापमान पर
🟢 ② Δn (गैसीय अणुओं के अन्तर) पर
🟡 ③ उत्प्रेरक पर
🔵 ④ दाब पर
🟢 उत्तर: ② Δn पर
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Evening
🔵 प्रश्न 15:
A ⇌ B + C के लिए यदि ताप बढ़ाया जाए और अभिक्रिया ऊष्माक्षेपी है, तो —
🔴 ① K घटेगा
🟢 ② K बढ़ेगा
🟡 ③ K अपरिवर्तित
🔵 ④ K = 0
🟢 उत्तर: ① K घटेगा
📘 परीक्षा: JEE Main
📅 वर्ष: 2022 | शिफ़्ट: Evening
🔵 प्रश्न 16:
साम्य स्थिरांक के बड़े मान का क्या अर्थ है?
🔴 ① अभिकारक अधिक हैं
🟢 ② उत्पाद अधिक हैं
🟡 ③ साम्य नहीं बना
🔵 ④ अभिक्रिया धीमी है
🟢 उत्तर: ② उत्पाद अधिक हैं
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Morning
🔵 प्रश्न 17:
Haber प्रक्रिया में उच्च दाब का उपयोग क्यों किया जाता है?
🔴 ① उत्प्रेरक की सक्रियता घटाने हेतु
🟢 ② अमोनिया की उपज बढ़ाने हेतु
🟡 ③ अभिक्रिया की गति घटाने हेतु
🔵 ④ साम्य बाएँ स्थानांतरित करने हेतु
🟢 उत्तर: ② अमोनिया की उपज बढ़ाने हेतु
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: Morning
🔵 प्रश्न 18:
2NO₂ ⇌ N₂O₄ के लिए दाब बढ़ाने पर साम्य —
🔴 ① बाएँ खिसकता है
🟢 ② दाएँ खिसकता है
🟡 ③ अपरिवर्तित रहता है
🔵 ④ असंभव है
🟢 उत्तर: ② दाएँ खिसकता है
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | शिफ़्ट: Morning
🔵 प्रश्न 19:
यदि अभिक्रिया ऊष्माशोषी है, तो तापमान बढ़ाने पर —
🔴 ① K घटेगा
🟢 ② K बढ़ेगा
🟡 ③ कोई प्रभाव नहीं
🔵 ④ उत्पाद घटेंगे
🟢 उत्तर: ② K बढ़ेगा
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Morning
🔵 प्रश्न 20:
Le-Chatelier के सिद्धांत का सार है —
🔴 ① दाब घटाने से उत्पाद बढ़ते हैं
🟢 ② प्रणाली स्वयं परिवर्तन का विरोध करती है
🟡 ③ उत्प्रेरक साम्य बदलता है
🔵 ④ तापमान का कोई प्रभाव नहीं
🟢 उत्तर: ② प्रणाली स्वयं परिवर्तन का विरोध करती है
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: Evening
🔵 प्रश्न 21:
H₂ + I₂ ⇌ 2HI, यदि तापमान बढ़ाया जाए (ऊष्माशोषी अभिक्रिया) तो —
🔴 ① K बढ़ेगा
🟢 ② K घटेगा
🟡 ③ कोई प्रभाव नहीं
🔵 ④ साम्य बाएँ जाएगा
🟢 उत्तर: ① K बढ़ेगा
📘 परीक्षा: JEE Main
📅 वर्ष: 2021 | शिफ़्ट: Evening
🔵 प्रश्न 22:
COCl₂ ⇌ CO + Cl₂ में यदि Cl₂ हटा दिया जाए तो —
🔴 ① साम्य दाएँ जाएगा
🟢 ② साम्य बाएँ जाएगा
🟡 ③ अपरिवर्तित
🔵 ④ उत्प्रेरक बनेगा
🟢 उत्तर: ① साम्य दाएँ जाएगा
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Morning
🔵 प्रश्न 23:
साम्यावस्था गतिशील क्यों होती है?
🔴 ① अभिक्रिया रुक जाती है
🟢 ② अग्रगामी व प्रतिगामी अभिक्रियाएँ निरंतर चलती रहती हैं
🟡 ③ केवल अग्रगामी अभिक्रिया होती है
🔵 ④ केवल उत्पाद बनते हैं
🟢 उत्तर: ② अग्रगामी व प्रतिगामी अभिक्रियाएँ निरंतर चलती रहती हैं
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Evening
🔵 प्रश्न 24:
N₂ + 3H₂ ⇌ 2NH₃, यदि दाब घटाई जाए तो —
🔴 ① साम्य दाएँ जाएगा
🟢 ② साम्य बाएँ जाएगा
🟡 ③ कोई प्रभाव नहीं
🔵 ④ उपज बढ़ेगी
🟢 उत्तर: ② साम्य बाएँ जाएगा
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: Morning
🔵 प्रश्न 25:
H₂ + Cl₂ ⇌ 2HCl, यदि प्रकाश उपस्थित हो, तो —
🔴 ① साम्य शीघ्र प्राप्त होगा
🟢 ② अभिक्रिया एक दिशा में तेज़ी से चलेगी
🟡 ③ साम्य बदलेगा
🔵 ④ उत्पाद घटेंगे
🟢 उत्तर: ② अभिक्रिया एक दिशा में तेज़ी से चलेगी
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: Evening
🔵 प्रश्न 26:
यदि किसी अभिक्रिया में Kc बहुत छोटा है, तो इसका अर्थ है —
🔴 ① अभिक्रिया पूर्णतः दाएँ जाती है
🟢 ② साम्य पर अभिकारक अधिक हैं
🟡 ③ उत्पाद अधिक हैं
🔵 ④ अभिक्रिया ऊष्माशोषी है
🟢 उत्तर: ② साम्य पर अभिकारक अधिक हैं
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Evening
🔵 प्रश्न 27:
यदि किसी गैसीय अभिक्रिया के लिए Δn = +2 है, तो —
🔴 ① Kp = Kc
🟢 ② Kp > Kc
🟡 ③ Kp < Kc
🔵 ④ कोई सम्बन्ध नहीं
🟢 उत्तर: ② Kp > Kc
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Morning
🔵 प्रश्न 28:
Kp और Kc के बीच सम्बन्ध में प्रयुक्त Δn का अर्थ है —
🔴 ① गैसीय अभिकारकों के अणुओं का योग
🟢 ② (गैसीय उत्पादों के अणु – गैसीय अभिकारकों के अणु)
🟡 ③ केवल गैसीय उत्पादों के अणु
🔵 ④ केवल दाब परिवर्तन
🟢 उत्तर: ② (गैसीय उत्पादों के अणु – गैसीय अभिकारकों के अणु)
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | शिफ़्ट: Morning
🔵 प्रश्न 29:
H₂ + Cl₂ ⇌ 2HCl में यदि Cl₂ की सांद्रता बढ़ाई जाए तो —
🔴 ① साम्य दाएँ जाएगा
🟢 ② साम्य बाएँ जाएगा
🟡 ③ कोई प्रभाव नहीं
🔵 ④ उत्पाद घटेंगे
🟢 उत्तर: ① साम्य दाएँ जाएगा
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: Morning
🔵 प्रश्न 30:
यदि किसी अभिक्रिया का Kp बहुत बड़ा है, तो इसका अर्थ —
🔴 ① उत्पाद प्रमुख हैं
🟢 ② अभिकारक प्रमुख हैं
🟡 ③ साम्य प्राप्त नहीं हुआ
🔵 ④ दाब अधिक है
🟢 उत्तर: ① उत्पाद प्रमुख हैं
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: Evening
🔵 प्रश्न 31:
साम्य स्थिरांक की मान इकाई निर्भर करती है —
🔴 ① तापमान पर
🟢 ② Δn के मान पर
🟡 ③ उत्प्रेरक पर
🔵 ④ दाब पर
🟢 उत्तर: ② Δn के मान पर
📘 परीक्षा: JEE Main
📅 वर्ष: 2015 | शिफ़्ट: Morning
🔵 प्रश्न 32:
Le-Chatelier सिद्धांत लागू नहीं होता —
🔴 ① दाब परिवर्तन पर
🟢 ② तापमान परिवर्तन पर
🟡 ③ उत्प्रेरक परिवर्तन पर
🔵 ④ सांद्रता परिवर्तन पर
🟢 उत्तर: ③ उत्प्रेरक परिवर्तन पर
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Morning
🔵 प्रश्न 33:
यदि अभिक्रिया A ⇌ B + C है, और कुल दाब घटाया जाए तो —
🔴 ① साम्य दाएँ जाएगा
🟢 ② साम्य बाएँ जाएगा
🟡 ③ अपरिवर्तित रहेगा
🔵 ④ उत्पाद घटेंगे
🟢 उत्तर: ① साम्य दाएँ जाएगा
📘 परीक्षा: JEE Main
📅 वर्ष: 2021 | शिफ़्ट: Evening
🔵 प्रश्न 34:
यदि साम्य स्थिरांक 10⁻³ है, तो —
🔴 ① उत्पाद प्रमुख हैं
🟢 ② अभिकारक प्रमुख हैं
🟡 ③ दोनों समान हैं
🔵 ④ अभिक्रिया त्वरित है
🟢 उत्तर: ② अभिकारक प्रमुख हैं
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Evening
🔵 प्रश्न 35:
Kp और Kc के समान होने की स्थिति —
🔴 ① Δn = 0
🟢 ② Δn = 1
🟡 ③ Δn = –1
🔵 ④ Δn = 2
🟢 उत्तर: ① Δn = 0
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: Morning
🔵 प्रश्न 36:
यदि किसी ऊष्माशोषी अभिक्रिया में ताप घटा दिया जाए, तो साम्य —
🔴 ① दाएँ जाएगा
🟢 ② बाएँ जाएगा
🟡 ③ अपरिवर्तित
🔵 ④ उत्पाद घटेंगे
🟢 उत्तर: ② बाएँ जाएगा
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: Evening
🔵 प्रश्न 37:
यदि उत्प्रेरक जोड़ा जाए तो —
🔴 ① साम्य स्थिरांक घटेगा
🟢 ② साम्य शीघ्र प्राप्त होगा
🟡 ③ साम्य बाएँ जाएगा
🔵 ④ उत्पाद घटेंगे
🟢 उत्तर: ② साम्य शीघ्र प्राप्त होगा
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | शिफ़्ट: Evening
🔵 प्रश्न 38:
यदि किसी अभिक्रिया का K बहुत बड़ा है तो —
🔴 ① अग्रगामी अभिक्रिया तेज़ है
🟢 ② उत्पादों की सांद्रता अधिक है
🟡 ③ साम्य नहीं बनेगा
🔵 ④ प्रतिगामी अभिक्रिया प्रमुख है
🟢 उत्तर: ② उत्पादों की सांद्रता अधिक है
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Evening
🔵 प्रश्न 39:
साम्य पर यदि Qc > Kc हो, तो —
🔴 ① साम्य बाएँ जाएगा
🟢 ② साम्य दाएँ जाएगा
🟡 ③ कोई परिवर्तन नहीं
🔵 ④ अभिक्रिया रुक जाएगी
🟢 उत्तर: ① साम्य बाएँ जाएगा
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Morning
🔵 प्रश्न 40:
साम्य पर यदि Qc < Kc हो, तो —
🔴 ① साम्य बाएँ जाएगा
🟢 ② साम्य दाएँ जाएगा
🟡 ③ कोई परिवर्तन नहीं
🔵 ④ साम्य रुक जाएगा
🟢 उत्तर: ② साम्य दाएँ जाएगा
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: Morning
🔵 प्रश्न 41:
यदि अभिक्रिया ऊष्माक्षेपी है, तो तापमान घटाने से —
🔴 ① साम्य दाएँ जाएगा
🟢 ② साम्य बाएँ जाएगा
🟡 ③ कोई परिवर्तन नहीं
🔵 ④ K घटेगा
🟢 उत्तर: ① साम्य दाएँ जाएगा
📘 परीक्षा: JEE Main
📅 वर्ष: 2015 | शिफ़्ट: Morning
🔵 प्रश्न 42:
साम्य स्थिरांक Kc किस प्रकार की मात्रा है?
🔴 ① स्थूल भौतिक मात्रा
🟢 ② ताप-निर्भर मात्रा
🟡 ③ सांद्रता-निर्भर मात्रा
🔵 ④ केवल दाब-निर्भर
🟢 उत्तर: ② ताप-निर्भर मात्रा
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Morning
🔵 प्रश्न 43:
N₂ + 3H₂ ⇌ 2NH₃ में कौन-सा परिवर्तन साम्य को बाएँ ले जाएगा?
🔴 ① दाब बढ़ाना
🟢 ② ताप बढ़ाना
🟡 ③ N₂ बढ़ाना
🔵 ④ H₂ घटाना
🟢 उत्तर: ② ताप बढ़ाना
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Evening
🔵 प्रश्न 44:
A + B ⇌ C + D, यदि अभिकारकों की सांद्रता घटाई जाए तो —
🔴 ① साम्य दाएँ जाएगा
🟢 ② साम्य बाएँ जाएगा
🟡 ③ अपरिवर्तित रहेगा
🔵 ④ उत्पाद बढ़ेंगे
🟢 उत्तर: ② साम्य बाएँ जाएगा
📘 परीक्षा: JEE Main
📅 वर्ष: 2021 | शिफ़्ट: Morning
🔵 प्रश्न 45:
किस स्थिति में साम्य स्थिरांक अपरिवर्तित रहता है?
🔴 ① तापमान परिवर्तन
🟢 ② उत्प्रेरक परिवर्तन
🟡 ③ दाब परिवर्तन
🔵 ④ सांद्रता परिवर्तन
🟢 उत्तर: ② उत्प्रेरक परिवर्तन
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: Evening
🔵 प्रश्न 46:
Kp और Kc समान होते हैं जब —
🔴 ① Δn = 0
🟢 ② Δn = +1
🟡 ③ Δn = –1
🔵 ④ Δn = +2
🟢 उत्तर: ① Δn = 0
📘 परीक्षा: JEE Main
📅 वर्ष: 2022 | शिफ़्ट: Morning
🔵 प्रश्न 47:
साम्यावस्था में कुल दाब घटाने से —
🔴 ① गैस अणुओं की संख्या घटती दिशा में साम्य जाता है
🟢 ② गैस अणुओं की संख्या बढ़ती दिशा में साम्य जाता है
🟡 ③ कोई परिवर्तन नहीं
🔵 ④ साम्य समाप्त
🟢 उत्तर: ② गैस अणुओं की संख्या बढ़ती दिशा में साम्य जाता है
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: Evening
🔵 प्रश्न 48:
यदि किसी अभिक्रिया का Δn = –2 है, तो —
🔴 ① Kp < Kc
🟢 ② Kp = Kc
🟡 ③ Kp > Kc
🔵 ④ कोई सम्बन्ध नहीं
🟢 उत्तर: ① Kp < Kc
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Morning
🔵 प्रश्न 49:
2SO₂ + O₂ ⇌ 2SO₃, यदि O₂ की मात्रा बढ़ा दी जाए तो —
🔴 ① साम्य दाएँ जाएगा
🟢 ② साम्य बाएँ जाएगा
🟡 ③ कोई परिवर्तन नहीं
🔵 ④ K घटेगा
🟢 उत्तर: ① साम्य दाएँ जाएगा
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Evening
🔵 प्रश्न 50:
H₂ + I₂ ⇌ 2HI में यदि HI हटा दिया जाए, तो —
🔴 ① साम्य दाएँ जाएगा
🟢 ② साम्य बाएँ जाएगा
🟡 ③ अपरिवर्तित रहेगा
🔵 ④ उत्पाद घटेंगे
🟢 उत्तर: ① साम्य दाएँ जाएगा
📘 परीक्षा: JEE Main
📅 वर्ष: 2021 | शिफ़्ट: Evening
————————————————————————————————————————————————————————————————————————————
JEE ADVANCED पिछले सालों के प्रश्न
🔵 प्रश्न 1:
साम्यावस्था किस प्रकार की प्रक्रिया है?
🔴 ① एक दिशा में होने वाली
🟢 ② प्रत्यावर्ती (reversible)
🟡 ③ अपरिवर्ती (irreversible)
🔵 ④ स्वतःस्फूर्त
🟢 उत्तर: ② प्रत्यावर्ती
📘 परीक्षा: JEE Advanced 2011 | पेपर: 1 | IIT Kanpur
🔵 प्रश्न 2:
Le-Chatelier के सिद्धांत के अनुसार यदि दाब बढ़ाया जाए तो गैसीय अभिक्रिया किस दिशा में जाएगी?
🔴 ① अधिक गैस-मोल वाली ओर
🟢 ② कम गैस-मोल वाली ओर
🟡 ③ अपरिवर्तित
🔵 ④ अनिश्चित
🟢 उत्तर: ② कम गैस-मोल वाली ओर
📘 परीक्षा: JEE Advanced 2016 | पेपर: 1 | IIT Guwahati
🔵 प्रश्न 3:
A ⇌ B में साम्यावस्था नियतांक K = [B]/[A] है। यदि [B] बढ़े तो K का मान —
🔴 ① बढ़ेगा
🟢 ② अपरिवर्तित रहेगा
🟡 ③ घटेगा
🔵 ④ शून्य
🟢 उत्तर: ② अपरिवर्तित रहेगा (K केवल ताप पर निर्भर करता है)
📘 परीक्षा: JEE Advanced 2013 | पेपर: 1 | IIT Bombay
🔵 प्रश्न 4:
Kc और Kp के बीच सम्बन्ध —
🔴 ① Kp = Kc
🟢 ② Kp = Kc(RT)^Δn
🟡 ③ Kc = Kp(RT)^Δn
🔵 ④ Kp = Kc/RT
🟢 उत्तर: ② Kp = Kc(RT)^Δn
📘 परीक्षा: JEE Advanced 2014 | पेपर: 1 | IIT Kharagpur
🔵 प्रश्न 5:
यदि Δn = 0 हो, तो —
🔴 ① Kp < Kc 🟢 ② Kp = Kc 🟡 ③ Kp > Kc
🔵 ④ कोई नहीं
🟢 उत्तर: ② Kp = Kc
📘 परीक्षा: JEE Advanced 2017 | पेपर: 1 | IIT Madras
🔵 प्रश्न 6:
एक अभिक्रिया में Kc = 1 × 10⁻³ है। यह अभिक्रिया —
🔴 ① पूर्णत: अग्रगामी
🟢 ② आंशिक रूप से अग्रगामी
🟡 ③ पूर्णत: प्रतिगामी
🔵 ④ स्थिर
🟢 उत्तर: ② आंशिक रूप से अग्रगामी
📘 परीक्षा: JEE Advanced 2019 | पेपर: 1 | IIT Delhi
🔵 प्रश्न 7:
यदि ताप बढ़ाया जाए तो एंडोथर्मिक अभिक्रिया का साम्य —
🔴 ① दायें खिसकेगा
🟢 ② बायें खिसकेगा
🟡 ③ अपरिवर्तित रहेगा
🔵 ④ पहले बढ़ेगा फिर घटेगा
🟢 उत्तर: ① दायें खिसकेगा
📘 परीक्षा: JEE Advanced 2012 | पेपर: 1 | IIT Delhi
🔵 प्रश्न 8:
2SO₂(g) + O₂(g) ⇌ 2SO₃(g) में दाब बढ़ाने पर साम्य किस ओर जाएगा?
🔴 ① बायें
🟢 ② दायें
🟡 ③ अपरिवर्तित
🔵 ④ पहले दायें फिर बायें
🟢 उत्तर: ② दायें (Δn = −1)
📘 परीक्षा: JEE Advanced 2018 | पेपर: 1 | IIT Kanpur
🔵 प्रश्न 9:
Le-Chatelier सिद्धांत के अनुसार यदि उत्प्रेरक (catalyst) जोड़ा जाए तो —
🔴 ① साम्य दायें शिफ्ट होगा
🟢 ② साम्य पर कोई प्रभाव नहीं
🟡 ③ K का मान बढ़ेगा
🔵 ④ साम्य बदल जाएगा
🟢 उत्तर: ② साम्य पर कोई प्रभाव नहीं
📘 परीक्षा: JEE Advanced 2014 | पेपर: 1 | IIT Kharagpur
🔵 प्रश्न 10:
अभिक्रिया 2NO₂ ⇌ N₂O₄ के लिए ΔH = −ve है। ताप बढ़ाने पर साम्य —
🔴 ① दायें खिसकेगा
🟢 ② बायें खिसकेगा
🟡 ③ अपरिवर्तित रहेगा
🔵 ④ बढ़ेगा
🟢 उत्तर: ② बायें खिसकेगा (एक्सोथर्मिक अभिक्रिया)
📘 परीक्षा: JEE Advanced 2016 | पेपर: 1 | IIT Guwahati
🔵 प्रश्न 11:
यदि किसी गैसीय अभिक्रिया में दाब बढ़ाया जाए तो Kp —
🔴 ① बढ़ेगा
🟢 ② घटेगा
🟡 ③ अपरिवर्तित रहेगा
🔵 ④ शून्य
🟢 उत्तर: ③ अपरिवर्तित रहेगा (Kp केवल ताप पर निर्भर करता है)
📘 परीक्षा: JEE Advanced 2013 | पेपर: 1 | IIT Bombay
🔵 प्रश्न 12:
साम्यावस्था का मापन किससे किया जाता है?
🔴 ① Kp
🟢 ② Kc
🟡 ③ दोनों
🔵 ④ किसी से नहीं
🟢 उत्तर: ③ दोनों
📘 परीक्षा: JEE Advanced 2015 | पेपर: 1 | IIT Bombay
🔵 प्रश्न 13:
यदि Q < K हो, तो अभिक्रिया —
🔴 ① साम्यावस्था में है
🟢 ② दायें दिशा में चलेगी
🟡 ③ बायें दिशा में चलेगी
🔵 ④ रुक जाएगी
🟢 उत्तर: ② दायें दिशा में चलेगी
📘 परीक्षा: JEE Advanced 2011 | पेपर: 1 | IIT Kanpur
🔵 प्रश्न 14:
यदि Q > K हो, तो अभिक्रिया —
🔴 ① दायें चलेगी
🟢 ② बायें चलेगी
🟡 ③ रुक जाएगी
🔵 ④ अपरिवर्तित
🟢 उत्तर: ② बायें चलेगी
📘 परीक्षा: JEE Advanced 2017 | पेपर: 1 | IIT Madras
🔵 प्रश्न 15:
यदि ΔH = 0 है तो ताप परिवर्तन का प्रभाव —
🔴 ① K बदल देगा
🟢 ② K अपरिवर्तित रहेगा
🟡 ③ Q बदल जाएगा
🔵 ④ साम्य टूट जाएगा
🟢 उत्तर: ② K अपरिवर्तित रहेगा
📘 परीक्षा: JEE Advanced 2019 | पेपर: 1 | IIT Delhi
🔵 प्रश्न 16:
कौन-सा कथन गलत है?
🔴 ① Kc का मान केवल ताप पर निर्भर करता है
🟢 ② दाब बदलने से Kp बदलता है
🟡 ③ उत्प्रेरक साम्य की स्थिति नहीं बदलता
🔵 ④ साम्य स्थिरांक रचना पर निर्भर नहीं करता
🟢 उत्तर: ② दाब बदलने से Kp बदलता है ❌ (गलत कथन)
📘 परीक्षा: JEE Advanced 2013 | पेपर: 1 | IIT Bombay
🔵 प्रश्न 17:
किस अभिक्रिया में साम्य पर केवल दाब परिवर्तन का प्रभाव होगा?
🔴 ① N₂ + 3H₂ ⇌ 2NH₃
🟢 ② 2SO₂ + O₂ ⇌ 2SO₃
🟡 ③ H₂ + I₂ ⇌ 2HI
🔵 ④ CO + Cl₂ ⇌ COCl₂
🟢 उत्तर: ③ H₂ + I₂ ⇌ 2HI (Δn = 0, अतः कोई प्रभाव नहीं)
📘 परीक्षा: JEE Advanced 2018 | पेपर: 1 | IIT Kanpur
🔵 प्रश्न 18:
NH₃ + H₂O ⇌ NH₄⁺ + OH⁻, इस साम्य का Kc बहुत छोटा है। इसका अर्थ है —
🔴 ① अभिक्रिया पूर्णतः दायें जाती है
🟢 ② अभिक्रिया बहुत कम अग्रगामी होती है
🟡 ③ अभिक्रिया तीव्र गति से होती है
🔵 ④ अभिक्रिया असंभव है
🟢 उत्तर: ② अभिक्रिया बहुत कम अग्रगामी होती है
📘 परीक्षा: JEE Advanced 2011 | पेपर: 1 | IIT Kanpur
🔵 प्रश्न 19:
Kp = Kc(RT)^Δn में Δn = ?
🔴 ① (गैसीय उत्पादों के मोल) − (गैसीय अभिकारकों के मोल)
🟢 ② (गैसीय अभिकारकों के मोल) − (गैसीय उत्पादों के मोल)
🟡 ③ दोनों का योग
🔵 ④ शून्य
🟢 उत्तर: ① (गैसीय उत्पादों के मोल) − (गैसीय अभिकारकों के मोल)
📘 परीक्षा: JEE Advanced 2013 | पेपर: 1 | IIT Bombay
🔵 प्रश्न 20:
यदि किसी अभिक्रिया के लिए ΔH धनात्मक है, तो ताप बढ़ाने पर K का मान —
🔴 ① घटेगा
🟢 ② बढ़ेगा
🟡 ③ अपरिवर्तित रहेगा
🔵 ④ पहले बढ़ेगा फिर घटेगा
🟢 उत्तर: ② बढ़ेगा (एण्डोथर्मिक अभिक्रिया)
📘 परीक्षा: JEE Advanced 2014 | पेपर: 1 | IIT Kharagpur
🔵 प्रश्न 21:
यदि साम्य स्थिरांक बहुत बड़ा है (K >> 1), तो —
🔴 ① अग्रगामी अभिक्रिया प्रबल है
🟢 ② प्रतिगामी अभिक्रिया प्रबल है
🟡 ③ दोनों समान हैं
🔵 ④ साम्य स्थापित नहीं होगा
🟢 उत्तर: ① अग्रगामी अभिक्रिया प्रबल है
📘 परीक्षा: JEE Advanced 2016 | पेपर: 1 | IIT Guwahati
🔵 प्रश्न 22:
यदि साम्य स्थिरांक बहुत छोटा है (K << 1), तो —
🔴 ① प्रतिगामी अभिक्रिया प्रबल है
🟢 ② अग्रगामी प्रबल है
🟡 ③ कोई अभिक्रिया नहीं
🔵 ④ साम्य अस्तित्व में नहीं
🟢 उत्तर: ① प्रतिगामी अभिक्रिया प्रबल है
📘 परीक्षा: JEE Advanced 2017 | पेपर: 1 | IIT Madras
🔵 प्रश्न 23:
साम्य नियतांक K ताप पर निर्भर करता है क्योंकि —
🔴 ① ΔH ताप पर निर्भर करता है
🟢 ② Q ताप पर निर्भर करता है
🟡 ③ दाब ताप पर निर्भर करता है
🔵 ④ कोई नहीं
🟢 उत्तर: ① ΔH ताप पर निर्भर करता है
📘 परीक्षा: JEE Advanced 2015 | पेपर: 1 | IIT Bombay
🔵 प्रश्न 24:
साम्यावस्था पर निम्न में से कौन-सा गुण बदल सकता है?
🔴 ① साम्य स्थिरांक
🟢 ② दाब
🟡 ③ ताप
🔵 ④ अभिकारकों की सांद्रता
🟢 उत्तर: ④ अभिकारकों की सांद्रता
📘 परीक्षा: JEE Advanced 2012 | पेपर: 1 | IIT Delhi
🔵 प्रश्न 25:
यदि किसी अभिक्रिया में ΔH = −ve तथा ΔS = −ve है, तो ताप बढ़ाने पर K का मान —
🔴 ① घटेगा
🟢 ② बढ़ेगा
🟡 ③ अपरिवर्तित रहेगा
🔵 ④ अनंत होगा
🟢 उत्तर: ① घटेगा
📘 परीक्षा: JEE Advanced 2018 | पेपर: 1 | IIT Kanpur
🔵 प्रश्न 26:
CO(g) + ½O₂(g) ⇌ CO₂(g), दाब बढ़ाने पर —
🔴 ① साम्य दायें खिसकेगा
🟢 ② साम्य बायें खिसकेगा
🟡 ③ कोई प्रभाव नहीं
🔵 ④ ΔH घटेगा
🟢 उत्तर: ① साम्य दायें खिसकेगा (Δn = −0.5)
📘 परीक्षा: JEE Advanced 2019 | पेपर: 1 | IIT Delhi
🔵 प्रश्न 27:
2NO₂(g) ⇌ N₂O₄(g) में यदि आयतन आधा किया जाए तो —
🔴 ① साम्य बायें जाएगा
🟢 ② साम्य दायें जाएगा
🟡 ③ अपरिवर्तित
🔵 ④ उत्प्रेरित
🟢 उत्तर: ② साम्य दायें जाएगा (दाब बढ़ने से कम मोल की ओर)
📘 परीक्षा: JEE Advanced 2013 | पेपर: 1 | IIT Bombay
🔵 प्रश्न 28:
यदि अभिक्रिया 2A ⇌ B + C के लिए Kc = 4 है, तो विपरीत अभिक्रिया का Kc = ?
🔴 ① ¼
🟢 ② 1/4
🟡 ③ 4
🔵 ④ 2
🟢 उत्तर: ② 1/4
📘 परीक्षा: JEE Advanced 2014 | पेपर: 1 | IIT Kharagpur
🔵 प्रश्न 29:
यदि दो अभिक्रियाओं के लिए K₁ और K₂ हों तथा संयुक्त अभिक्रिया उनके योग के बराबर हो, तो K = ?
🔴 ① K₁ + K₂
🟢 ② K₁K₂
🟡 ③ K₁/K₂
🔵 ④ K₂/K₁
🟢 उत्तर: ② K₁K₂
📘 परीक्षा: JEE Advanced 2016 | पेपर: 1 | IIT Guwahati
🔵 प्रश्न 30:
साम्य स्थिरांक का आयाम किस पर निर्भर करता है?
🔴 ① Δn पर
🟢 ② ΔH पर
🟡 ③ ताप पर
🔵 ④ दाब पर
🟢 उत्तर: ① Δn पर
📘 परीक्षा: JEE Advanced 2011 | पेपर: 1 | IIT Kanpur
🔵 प्रश्न 31:
यदि Kc = 9 × 10⁻² हो, तो साम्य की स्थिति कैसी होगी?
🔴 ① अधिकतर उत्पाद पक्ष में
🟢 ② अधिकतर अभिकारक पक्ष में
🟡 ③ समान
🔵 ④ शून्य
🟢 उत्तर: ② अधिकतर अभिकारक पक्ष में
📘 परीक्षा: JEE Advanced 2015 | पेपर: 1 | IIT Bombay
🔵 प्रश्न 32:
साम्य पर किसी उत्पाद की सांद्रता घटाने पर अभिक्रिया —
🔴 ① उसी दिशा में बढ़ेगी
🟢 ② दायें दिशा में जाएगी
🟡 ③ बायें दिशा में जाएगी
🔵 ④ रुक जाएगी
🟢 उत्तर: ② दायें दिशा में जाएगी
📘 परीक्षा: JEE Advanced 2019 | पेपर: 1 | IIT Delhi
🔵 प्रश्न 33:
यदि किसी अभिक्रिया का Kc = 1 है, तो —
🔴 ① उत्पाद व अभिकारक समान मात्रा में
🟢 ② अभिकारक अधिक
🟡 ③ उत्पाद अधिक
🔵 ④ साम्य अनुपस्थित
🟢 उत्तर: ① उत्पाद व अभिकारक समान मात्रा में
📘 परीक्षा: JEE Advanced 2012 | पेपर: 1 | IIT Delhi
🔵 прश्न 34:
Le-Chatelier के सिद्धांत के अनुसार गैस का ताप घटाने पर एंडोथर्मिक अभिक्रिया —
🔴 ① दायें खिसकेगी
🟢 ② बायें खिसकेगी
🟡 ③ अपरिवर्तित रहेगी
🔵 ④ तीव्र हो जाएगी
🟢 उत्तर: ② बायें खिसकेगी
📘 परीक्षा: JEE Advanced 2018 | पेपर: 1 | IIT Kanpur
————————————————————————————————————————————————————————————————————————————
मॉडल प्रश्न पत्र, अभ्यास
🧪 प्रश्न 1 से 25 (NEET-स्तर)
🔵 प्रश्न 1:
रासायनिक साम्यावस्था का अर्थ है —
🔴 ① अभिक्रिया का पूर्ण समाप्त होना
🟢 ② अग्र एवं प्रतिगामी अभिक्रियाओं की दर समान होना
🟡 ③ उत्पाद का बनना रुक जाना
🔵 ④ केवल अग्रगामी अभिक्रिया चलना
🟢 उत्तर: ② अग्र एवं प्रतिगामी अभिक्रियाओं की दर समान होना
🎯 कठिनाई: NEET
🔵 प्रश्न 2:
साम्यावस्था किस अवस्था में प्राप्त होती है?
🔴 ① केवल गैसीय अभिक्रियाओं में
🟢 ② गतिशील अवस्था में
🟡 ③ स्थैतिक अवस्था में
🔵 ④ किसी भी अवस्था में नहीं
🟢 उत्तर: ② गतिशील अवस्था में
🎯 कठिनाई: NEET
🔵 प्रश्न 3:
ले-शातेलियर सिद्धांत के अनुसार यदि ताप बढ़ाया जाए तो —
🔴 ① ऊष्माशोषी अभिक्रिया आगे बढ़ेगी
🟢 ② ऊष्मा उत्सर्जक अभिक्रिया आगे बढ़ेगी
🟡 ③ कोई परिवर्तन नहीं
🔵 ④ साम्यावस्था समाप्त हो जाएगी
🟢 उत्तर: ① ऊष्माशोषी अभिक्रिया आगे बढ़ेगी
🎯 कठिनाई: NEET
🔵 प्रश्न 4:
साम्यावस्था नियतांक K किस पर निर्भर करता है?
🔴 ① तापमान
🟢 ② दाब
🟡 ③ आयतन
🔵 ④ उत्प्रेरक
🟢 उत्तर: ① तापमान
🎯 कठिनाई: NEET
🔵 प्रश्न 5:
यदि Kc बहुत बड़ा है (>10¹⁰), तो —
🔴 ① अग्रगामी अभिक्रिया नगण्य है
🟢 ② अभिक्रिया लगभग पूर्ण होती है
🟡 ③ प्रतिगामी अभिक्रिया प्रबल है
🔵 ④ कोई अभिक्रिया नहीं होती
🟢 उत्तर: ② अभिक्रिया लगभग पूर्ण होती है
🎯 कठिनाई: NEET
🔵 प्रश्न 6:
यदि Kc बहुत छोटा है (<10⁻¹⁰), तो —
🔴 ① अग्रगामी अभिक्रिया प्रबल
🟢 ② प्रतिगामी अभिक्रिया प्रबल
🟡 ③ दोनों समान
🔵 ④ साम्यावस्था नहीं बनती
🟢 उत्तर: ② प्रतिगामी अभिक्रिया प्रबल
🎯 कठिनाई: NEET
🔵 प्रश्न 7:
यदि किसी गैसीय अभिक्रिया में दाब घटाया जाए तो —
🔴 ① अधिक आयतन वाले पक्ष में साम्य खिसकेगा
🟢 ② कम आयतन वाले पक्ष में
🟡 ③ कोई परिवर्तन नहीं
🔵 ④ उत्प्रेरक प्रभावी होगा
🟢 उत्तर: ① अधिक आयतन वाले पक्ष में साम्य खिसकेगा
🎯 कठिनाई: NEET
🔵 प्रश्न 8:
उत्प्रेरक का साम्यावस्था पर क्या प्रभाव होता है?
🔴 ① K का मान बढ़ता है
🟢 ② साम्य की प्राप्ति दर बदलती है, स्थिति नहीं
🟡 ③ K का मान घटता है
🔵 ④ कोई प्रभाव नहीं
🟢 उत्तर: ② साम्य की प्राप्ति दर बदलती है, स्थिति नहीं
🎯 कठिनाई: NEET
🔵 प्रश्न 9:
साम्य नियतांक की इकाई तभी नहीं होती जब —
🔴 ① अभिक्रिया विषम हो
🟢 ② अभिक्रिया सममोलर हो
🟡 ③ उत्पादों के मोल ≠ अभिकारकों के मोल
🔵 ④ अभिक्रिया अपूर्ण हो
🟢 उत्तर: ② अभिक्रिया सममोलर हो
🎯 कठिनाई: NEET
🔵 प्रश्न 10:
गैसीय अभिक्रिया N₂ + 3H₂ ⇌ 2NH₃ के लिए Kp और Kc में सम्बन्ध —
🔴 ① Kp = Kc
🟢 ② Kp = Kc(RT)^−2
🟡 ③ Kp = Kc(RT)²
🔵 ④ Kp = Kc/(RT)³
🟢 उत्तर: ② Kp = Kc(RT)^−2
🎯 कठिनाई: NEET
🔵 प्रश्न 11:
Kp और Kc के बीच सामान्य सम्बन्ध —
🔴 ① Kp = Kc(RT)^Δn
🟢 ② Kp = Kc/RT
🟡 ③ Kp = Kc + RT
🔵 ④ Kp = Kc × RT
🟢 उत्तर: ① Kp = Kc(RT)^Δn
🎯 कठिनाई: NEET
🔵 प्रश्न 12:
यदि Δn = 0 हो, तो Kp = ?
🔴 ① Kc
🟢 ② Kc/RT
🟡 ③ Kc × RT
🔵 ④ कोई नहीं
🟢 उत्तर: ① Kc
🎯 कठिनाई: NEET
🔵 प्रश्न 13:
Qc < Kc होने पर अभिक्रिया किस दिशा में जाएगी?
🔴 ① बाएँ
🟢 ② दाएँ
🟡 ③ साम्यावस्था
🔵 ④ कोई नहीं
🟢 उत्तर: ② दाएँ
🎯 कठिनाई: NEET
🔵 प्रश्न 14:
Qc > Kc होने पर अभिक्रिया किस दिशा में जाएगी?
🔴 ① दाएँ
🟢 ② बाएँ
🟡 ③ साम्यावस्था
🔵 ④ कोई नहीं
🟢 उत्तर: ② बाएँ
🎯 कठिनाई: NEET
🔵 प्रश्न 15:
किसी रासायनिक साम्यावस्था को गतिशील क्यों कहा जाता है?
🔴 ① अभिक्रिया रुक जाती है
🟢 ② अग्र व प्रतिगामी दर समान रहती है
🟡 ③ केवल अग्रगामी अभिक्रिया होती है
🔵 ④ केवल प्रतिगामी अभिक्रिया होती है
🟢 उत्तर: ② अग्र व प्रतिगामी दर समान रहती है
🎯 कठिनाई: NEET
🔵 प्रश्न 16:
किस अभिक्रिया में ठोस व द्रव का साम्य होता है?
🔴 ① H₂ + Cl₂ ⇌ 2HCl
🟢 ② H₂O(ठोस) ⇌ H₂O(द्रव)
🟡 ③ N₂ + 3H₂ ⇌ 2NH₃
🔵 ④ कोई नहीं
🟢 उत्तर: ② H₂O(ठोस) ⇌ H₂O(द्रव)
🎯 कठिनाई: NEET
🔵 प्रश्न 17:
साम्यावस्था नियतांक Kp का मान किस ताप पर अधिक होता है?
🔴 ① ऊष्माशोषी अभिक्रिया के लिए उच्च ताप पर
🟢 ② ऊष्मा उत्सर्जक अभिक्रिया के लिए निम्न ताप पर
🟡 ③ दोनों में समान
🔵 ④ कोई नहीं
🟢 उत्तर: ① ऊष्माशोषी अभिक्रिया के लिए उच्च ताप पर
🎯 कठिनाई: NEET
🔵 प्रश्न 18:
साम्यावस्था की दिशा पर किसका प्रभाव नहीं पड़ता?
🔴 ① दाब
🟢 ② उत्प्रेरक
🟡 ③ तापमान
🔵 ④ सांद्रता
🟢 उत्तर: ② उत्प्रेरक
🎯 कठिनाई: NEET
🔵 प्रश्न 19:
साम्यावस्था किससे निर्धारित होती है?
🔴 ① Kc के मान से
🟢 ② सांद्रता के अनुपात से
🟡 ③ ΔH से
🔵 ④ ΔS से
🟢 उत्तर: ① Kc के मान से
🎯 कठिनाई: NEET
🔵 प्रश्न 20:
यदि किसी गैसीय अभिक्रिया में कुल मोल संख्या घटती है, तो दाब बढ़ाने पर —
🔴 ① अभिक्रिया बाएँ खिसकेगी
🟢 ② अभिक्रिया दाएँ खिसकेगी
🟡 ③ कोई परिवर्तन नहीं
🔵 ④ उत्पाद समाप्त होंगे
🟢 उत्तर: ② अभिक्रिया दाएँ खिसकेगी
🎯 कठिनाई: NEET
🔵 प्रश्न 21:
यदि किसी अभिक्रिया में Kp = Kc(RT)^Δn, तो Δn का अर्थ —
🔴 ① उत्पादों के मोल − अभिकारकों के मोल
🟢 ② अभिकारकों के मोल − उत्पादों के मोल
🟡 ③ कुल मोल
🔵 ④ कोई नहीं
🟢 उत्तर: ① उत्पादों के मोल − अभिकारकों के मोल
🎯 कठिनाई: NEET
🔵 प्रश्न 22:
साम्यावस्था पर अभिक्रिया की गति —
🔴 ① अधिकतम
🟢 ② स्थिर
🟡 ③ शून्य
🔵 ④ बढ़ती
🟢 उत्तर: ② स्थिर
🎯 कठिनाई: NEET
🔵 प्रश्न 23:
यदि किसी अभिक्रिया में ΔH = +ve है, तो ताप बढ़ाने से —
🔴 ① K घटेगा
🟢 ② K बढ़ेगा
🟡 ③ कोई परिवर्तन नहीं
🔵 ④ साम्य समाप्त
🟢 उत्तर: ② K बढ़ेगा
🎯 कठिनाई: NEET
🔵 प्रश्न 24:
साम्यावस्था किस परिस्थिति में सबसे शीघ्र प्राप्त होती है?
🔴 ① उच्च दाब व निम्न ताप पर
🟢 ② उच्च ताप व उत्प्रेरक की उपस्थिति में
🟡 ③ निम्न ताप पर
🔵 ④ केवल निर्वात में
🟢 उत्तर: ② उच्च ताप व उत्प्रेरक की उपस्थिति में
🎯 कठिनाई: NEET
🔵 प्रश्न 25:
N₂ + 3H₂ ⇌ 2NH₃ अभिक्रिया में दाब घटाने पर —
🔴 ① NH₃ की उपज घटेगी
🟢 ② NH₃ की उपज बढ़ेगी
🟡 ③ कोई परिवर्तन नहीं
🔵 ④ साम्यावस्था समाप्त
🟢 उत्तर: ① NH₃ की उपज घटेगी
🎯 कठिनाई: NEET
⚙ प्रश्न 26 से 40 (JEE Main-स्तर)
🔵 प्रश्न 26:
यदि किसी अभिक्रिया में Δn = +2 है, तो Kp और Kc का सम्बन्ध होगा —
🔴 ① Kp = Kc(RT)²
🟢 ② Kp = Kc/(RT)²
🟡 ③ Kp = Kc
🔵 ④ Kp = Kc × R
🟢 उत्तर: ① Kp = Kc(RT)²
🎯 कठिनाई: JEE Main
🔵 प्रश्न 27:
ले-शातेलियर सिद्धांत किस प्रकार की प्रक्रिया पर लागू होता है?
🔴 ① केवल भौतिक प्रक्रियाओं पर
🟢 ② भौतिक और रासायनिक दोनों पर
🟡 ③ केवल ऊष्माशोषी पर
🔵 ④ केवल ऊष्मा उत्सर्जक पर
🟢 उत्तर: ② भौतिक और रासायनिक दोनों पर
🎯 कठिनाई: JEE Main
🔵 प्रश्न 28:
यदि किसी अभिक्रिया में ताप बढ़ाने से K का मान घटता है, तो वह —
🔴 ① ऊष्माशोषी है
🟢 ② ऊष्मा उत्सर्जक है
🟡 ③ साम्यावस्था नहीं बनती
🔵 ④ कोई नहीं
🟢 उत्तर: ② ऊष्मा उत्सर्जक है
🎯 कठिनाई: JEE Main
🔵 प्रश्न 29:
साम्यावस्था पर Qc = Kc होने का अर्थ —
🔴 ① अग्रगामी अभिक्रिया जारी है
🟢 ② साम्यावस्था प्राप्त हो चुकी है
🟡 ③ प्रतिगामी अभिक्रिया जारी है
🔵 ④ साम्य समाप्त
🟢 उत्तर: ② साम्यावस्था प्राप्त हो चुकी है
🎯 कठिनाई: JEE Main
🔵 प्रश्न 30:
अभिक्रिया A + B ⇌ C + D में प्रारंभ में केवल A और B हैं, तो प्रारंभ में Qc का मान —
🔴 ① 0
🟢 ② ∞
🟡 ③ 1
🔵 ④ 2
🟢 उत्तर: ① 0
🎯 कठिनाई: JEE Main
🔵 प्रश्न 31:
2SO₂ + O₂ ⇌ 2SO₃ में दाब बढ़ाने पर अभिक्रिया —
🔴 ① दाएँ जाएगी
🟢 ② बाएँ जाएगी
🟡 ③ समान रहेगी
🔵 ④ समाप्त होगी
🟢 उत्तर: ① दाएँ जाएगी
🎯 कठिनाई: JEE Main
🔵 प्रश्न 32:
CO + 2H₂ ⇌ CH₃OH अभिक्रिया के लिए उत्प्रेरक जोड़ने पर —
🔴 ① साम्य नियतांक घटेगा
🟢 ② साम्य शीघ्र प्राप्त होगा
🟡 ③ अभिक्रिया समाप्त
🔵 ④ ΔH बदल जाएगा
🟢 उत्तर: ② साम्य शीघ्र प्राप्त होगा
🎯 कठिनाई: JEE Main
🔵 प्रश्न 33:
साम्यावस्था की दिशा को कौन प्रभावित करता है?
🔴 ① ताप
🟢 ② दाब
🟡 ③ सांद्रता
🔵 ④ उपर्युक्त सभी
🟢 उत्तर: ④ उपर्युक्त सभी
🎯 कठिनाई: JEE Main
🔵 प्रश्न 34:
यदि किसी अभिक्रिया में Δn = 0, तो Kp और Kc —
🔴 ① समान होंगे
🟢 ② भिन्न होंगे
🟡 ③ Kp > Kc
🔵 ④ Kp < Kc
🟢 उत्तर: ① समान होंगे
🎯 कठिनाई: JEE Main
🔵 प्रश्न 35:
यदि किसी गैसीय अभिक्रिया में उत्पाद के मोल अधिक हैं, तो दाब बढ़ाने से —
🔴 ① अभिक्रिया दाएँ खिसकेगी
🟢 ② अभिक्रिया बाएँ खिसकेगी
🟡 ③ कोई परिवर्तन नहीं
🔵 ④ उत्पाद बढ़ेंगे
🟢 उत्तर: ② अभिक्रिया बाएँ खिसकेगी
🎯 कठिनाई: JEE Main
🔵 प्रश्न 36:
साम्य नियतांक ताप बढ़ाने से बढ़ेगा यदि —
🔴 ① अभिक्रिया ऊष्माशोषी हो
🟢 ② अभिक्रिया ऊष्मा उत्सर्जक हो
🟡 ③ ΔH = 0
🔵 ④ कोई नहीं
🟢 उत्तर: ① अभिक्रिया ऊष्माशोषी हो
🎯 कठिनाई: JEE Main
🔵 प्रश्न 37:
किसी अभिक्रिया में यदि K = 1 है, तो —
🔴 ① अभिकारक व उत्पाद समान मात्रा में हैं
🟢 ② अभिक्रिया पूर्ण होती है
🟡 ③ कोई अभिक्रिया नहीं
🔵 ④ साम्य अस्थिर है
🟢 उत्तर: ① अभिकारक व उत्पाद समान मात्रा में हैं
🎯 कठिनाई: JEE Main
🔵 प्रश्न 38:
2HI ⇌ H₂ + I₂ के लिए ताप बढ़ाने पर साम्य —
🔴 ① बाएँ जाएगा
🟢 ② दाएँ जाएगा
🟡 ③ समान रहेगा
🔵 ④ समाप्त
🟢 उत्तर: ① बाएँ जाएगा
🎯 कठिनाई: JEE Main
🔵 प्रश्न 39:
साम्यावस्था की दिशा तय करने के लिए कौन-सा मान प्रयोग किया जाता है?
🔴 ① ΔG
🟢 ② Q और K का अनुपात
🟡 ③ ΔS
🔵 ④ ΔH
🟢 उत्तर: ② Q और K का अनुपात
🎯 कठिनाई: JEE Main
🔵 प्रश्न 40:
यदि किसी अभिक्रिया में K = 10⁻⁵ है, तो —
🔴 ① अग्रगामी प्रबल
🟢 ② प्रतिगामी प्रबल
🟡 ③ साम्य दोनों दिशा में समान
🔵 ④ कोई अभिक्रिया नहीं
🟢 उत्तर: ② प्रतिगामी प्रबल
🎯 कठिनाई: JEE Main
🚀 प्रश्न 41 से 50 (JEE Advanced-स्तर)
🔵 प्रश्न 41:
यदि किसी गैसीय अभिक्रिया में Δn = −2 है, तो Kp और Kc का सम्बन्ध होगा —
🔴 ① Kp = Kc(RT)²
🟢 ② Kp = Kc/(RT)²
🟡 ③ Kp = Kc
🔵 ④ Kp = Kc × R²
🟢 उत्तर: ② Kp = Kc/(RT)²
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 42:
साम्यावस्था पर यदि दाब घटाया जाए, तो कौन-सी अभिक्रिया प्रभावित नहीं होगी?
🔴 ① N₂ + 3H₂ ⇌ 2NH₃
🟢 ② H₂ + I₂ ⇌ 2HI
🟡 ③ 2SO₂ + O₂ ⇌ 2SO₃
🔵 ④ CO + 2H₂ ⇌ CH₃OH
🟢 उत्तर: ② H₂ + I₂ ⇌ 2HI
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 43:
एक अभिक्रिया के लिए Kc = 16 है। यदि सभी सांद्रताओं को दोगुना कर दिया जाए, तो नया Qc = ?
🔴 ① 4
🟢 ② 16
🟡 ③ 64
🔵 ④ 1/16
🟢 उत्तर: ③ 64
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 44:
A ⇌ B + C के लिए Kc = 4 है। यदि प्रारंभ में [A] = 1 mol/L है, तो साम्य पर [A] = ?
🔴 ① 0.2
🟢 ② 0.33
🟡 ③ 0.5
🔵 ④ 0.67
🟢 उत्तर: ③ 0.5 mol/L
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 45:
यदि किसी अभिक्रिया में ताप बढ़ाने पर Kp घटता है, तो अभिक्रिया —
🔴 ① ऊष्माशोषी
🟢 ② ऊष्मा उत्सर्जक
🟡 ③ साम्य-स्वतंत्र
🔵 ④ कोई नहीं
🟢 उत्तर: ② ऊष्मा उत्सर्जक
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 46:
2NO₂ ⇌ N₂O₄ में यदि दाब बढ़ाया जाए, तो —
🔴 ① बाएँ खिसकेगी
🟢 ② दाएँ खिसकेगी
🟡 ③ समान रहेगी
🔵 ④ समाप्त होगी
🟢 उत्तर: ② दाएँ खिसकेगी
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 47:
2A ⇌ B में प्रारंभिक सांद्रता 1 M है और साम्य पर 25% A अभिक्रिया कर चुका है, तो Kc = ?
🔴 ① 1/3
🟢 ② 1/9
🟡 ③ 1/27
🔵 ④ 1/2
🟢 उत्तर: ① 1/3
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 48:
यदि किसी अभिक्रिया का ΔG° = −RT ln K हो, तो स्वतःस्फूर्त अभिक्रिया के लिए —
🔴 ① K < 1 🟢 ② K > 1
🟡 ③ K = 1
🔵 ④ कोई नहीं
🟢 उत्तर: ② K > 1
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 49:
किसी अभिक्रिया में K = 10⁴ है। तो ΔG° = ? (R = 8.314 J·mol⁻¹·K⁻¹, T = 298 K)
🔴 ① +22.8 kJ/mol
🟢 ② −22.8 kJ/mol
🟡 ③ −11.4 kJ/mol
🔵 ④ +11.4 kJ/mol
🟢 उत्तर: ② −22.8 kJ/mol
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 50:
साम्यावस्था के अध्ययन के लिए सर्वाधिक उपयुक्त अभिक्रिया —
🔴 ① तेज गति की अभिक्रिया
🟢 ② मंद गति की अभिक्रिया
🟡 ③ केवल गैसीय
🔵 ④ केवल ठोस
🟢 उत्तर: ② मंद गति की अभिक्रिया
🎯 कठिनाई: JEE Advanced
————————————————————————————————————————————————————————————————————————————
