Class 11 : Chemistry (In Hindi) – Lesson 5. उष्मागतिकी
पाठ का विश्लेषण एवं विवेचन
🔵 भूमिका ✨
ऊष्मागतिकी (Thermodynamics) रसायन विज्ञान की वह शाखा है जो ऊर्जा के विभिन्न रूपों, विशेषकर ऊष्मा (heat) और कार्य (work), तथा उनके आपसी परिवर्तन और संरक्षण के नियमों का अध्ययन करती है। यह अध्याय भौतिक और रासायनिक प्रक्रियाओं में ऊर्जा के प्रवाह और संतुलन को समझने के लिए मूलभूत है।
🟢 मूल अवधारणाएँ 📌
तंत्र और परिवेश:
➤ तंत्र वह अंश है जिस पर हम अध्ययन कर रहे हैं।
➤ परिवेश वह सबकुछ है जो तंत्र के बाहर है।
➤ प्रकार:
– उष्मारुद्ध (Isolated): ऊर्जा व पदार्थ का आदान-प्रदान नहीं।
– संपूर्ण (Closed): केवल ऊर्जा का आदान-प्रदान।
– मुक्त (Open): ऊर्जा व पदार्थ दोनों का आदान-प्रदान।
अवस्था और अवस्था-फलन:
➤ अवस्था: तंत्र को परिभाषित करने वाले गुण जैसे दाब (P), आयतन (V), तापमान (T)।
➤ अवस्था-फलन: केवल आरम्भिक और अंतिम अवस्था पर निर्भर (जैसे U, H, G, S)।
➤ पथ-फलन: मार्ग पर निर्भर (जैसे कार्य W और ऊष्मा Q)।
आन्तरिक ऊर्जा (U): तंत्र में सभी कणों की गतिज और स्थितिज ऊर्जा का योग।
🟡 ऊष्मागतिकी का प्रथम नियम (Energy Conservation Law) 🌟
सिद्धान्त: ऊर्जा न उत्पन्न होती है, न नष्ट होती है, केवल एक रूप से दूसरे रूप में परिवर्तित होती है।
गणितीय रूप: ΔU = q + w
जहाँ q = ऊष्मा, w = कार्य।
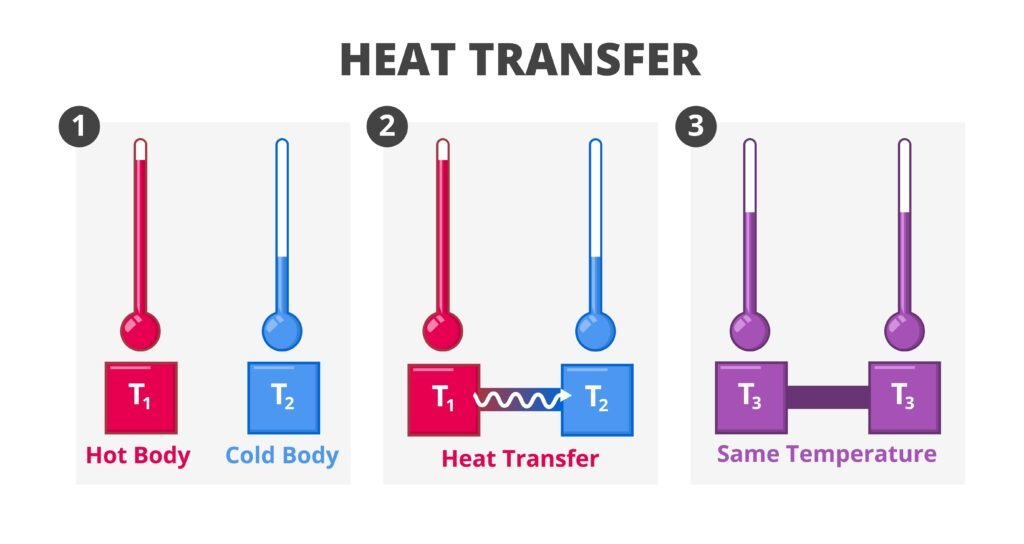
✔ उदाहरण:
यदि किसी तंत्र को स्थिर आयतन पर गरम किया जाए तो w = 0, अतः ΔU = qv।
यदि स्थिर दाब पर गरम किया जाए तो q = ΔH (एन्थैल्पी परिवर्तन)।
🟢 कार्य (Work) और ऊष्मा (Heat) ✏
विस्तार कार्य: w = −PΔV
यदि तंत्र फैलता है तो कार्य ऋणात्मक (तंत्र द्वारा परिवेश पर किया गया)।
यदि तंत्र सिकुड़ता है तो कार्य धनात्मक (परिवेश द्वारा तंत्र पर)।
ऊष्मा: ऊर्जा का प्रवाह तापमान के अन्तर के कारण।
🟡 एन्थैल्पी (H) 📍
H = U + PV
परिवर्तन: ΔH = ΔU + PΔV
स्थिर दाब पर q = ΔH।
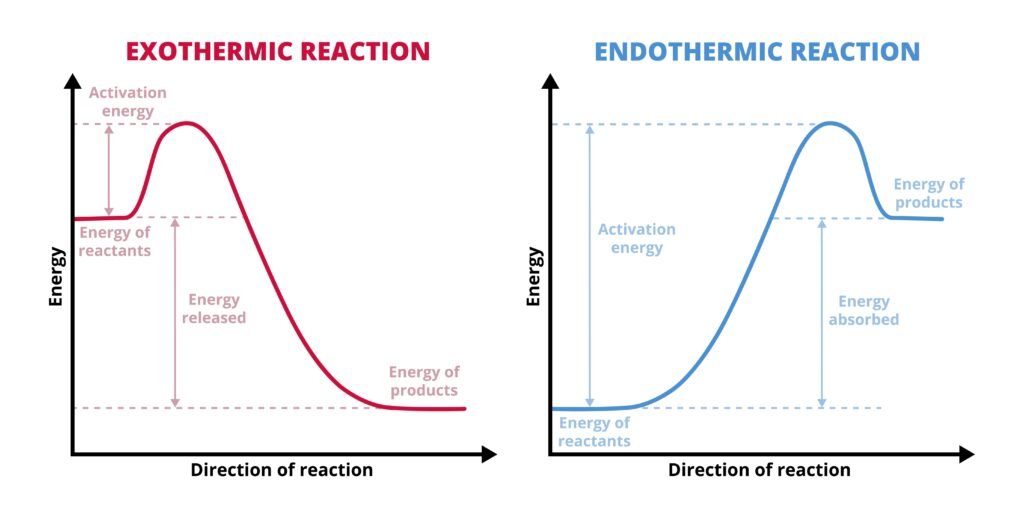
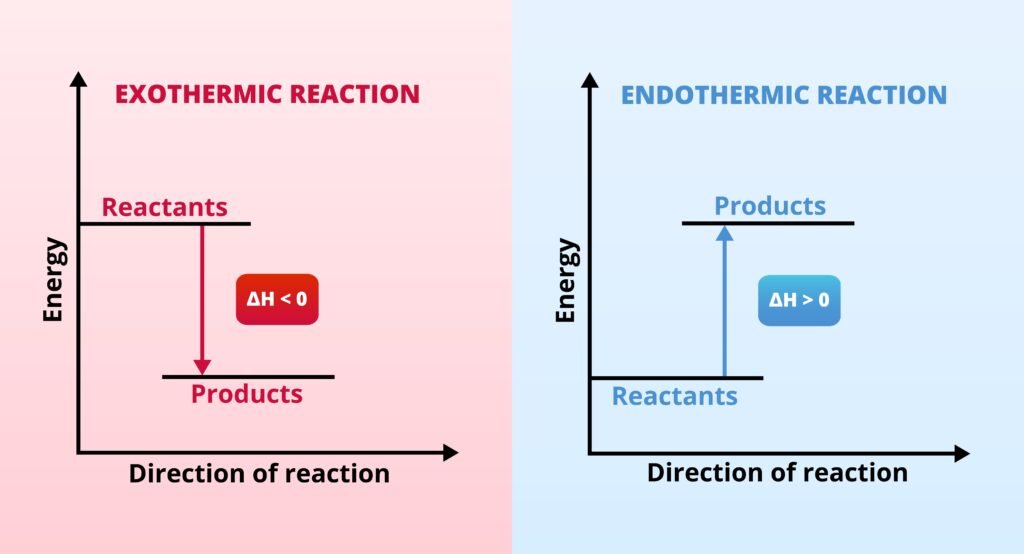
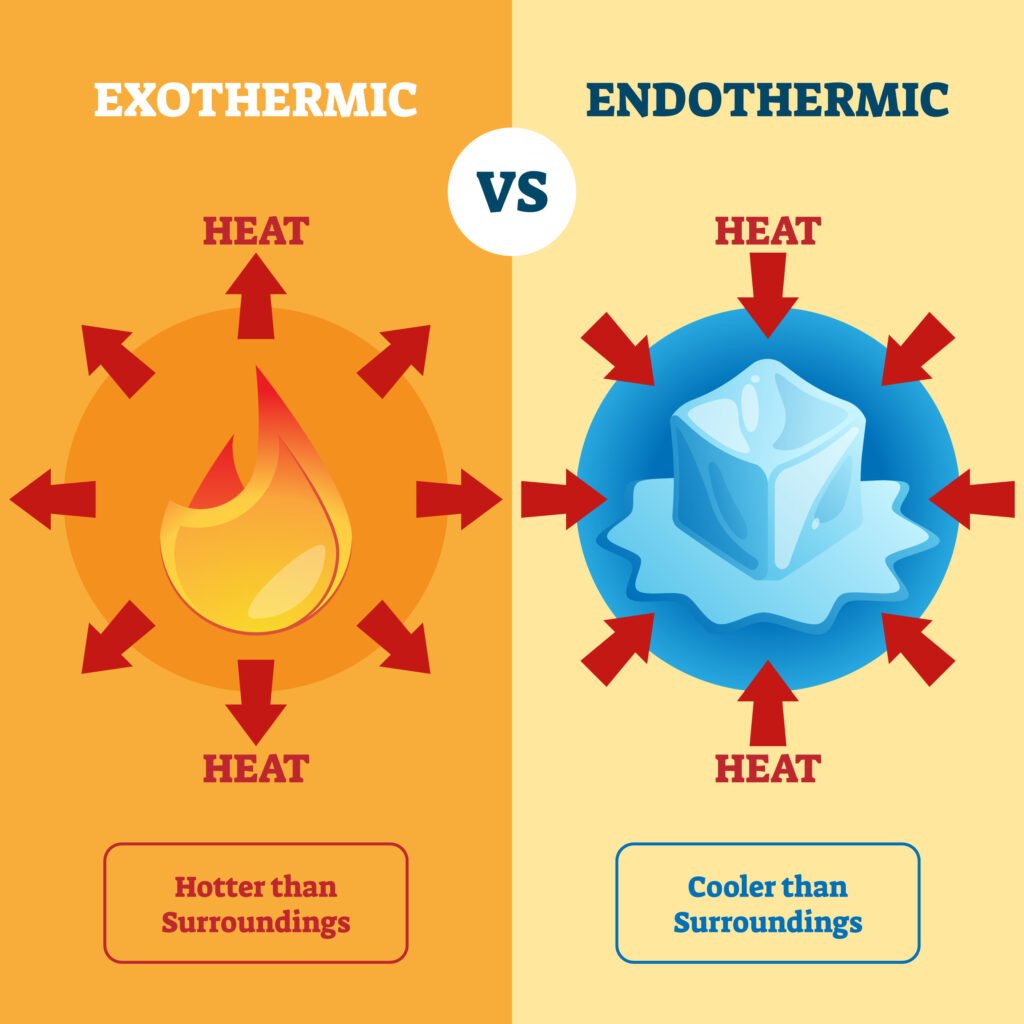
उष्माक्षेपी अभिक्रिया: ΔH < 0
उष्माशोषी अभिक्रिया: ΔH > 0
🟢 ऊष्मागतिकी का द्वितीय नियम 💡
सिद्धान्त: कोई भी स्वस्फूर्त (spontaneous) प्रक्रिया तभी घटित होगी जब तंत्र + परिवेश की एंट्रॉपी बढ़ेगी।
एंट्रॉपी (S): अव्यवस्था या यादृच्छिकता का माप।
➤ ΔS > 0 → स्वस्फूर्त प्रवृत्ति।
क्लॉज़ियस कथन: ऊष्मा स्वतः शीतल पिण्ड से उष्ण पिण्ड की ओर नहीं जा सकती।
केल्विन-प्लांक कथन: ऊष्मा को पूर्णतः कार्य में रूपान्तरित करना असम्भव है।
🟡 ऊष्मागतिकी का तृतीय नियम 📘
परिभाषा: शून्य केल्विन तापमान पर एक शुद्ध सुसंगठित क्रिस्टल की एंट्रॉपी शून्य होती है।
महत्व: यह हमें एंट्रॉपी के पूर्ण मान ज्ञात करने की अनुमति देता है।
🔴 गिब्स मुक्त ऊर्जा (G) 🌟
G = H − TS
परिवर्तन: ΔG = ΔH − TΔS
निष्कर्ष:
ΔG < 0 → अभिक्रिया स्वस्फूर्त।
ΔG = 0 → संतुलन।
ΔG > 0 → अभिक्रिया अस्वस्फूर्त।
🟢 अनुप्रयोग ✔
अभिक्रियाओं की दिशा व स्वस्फूर्तता का पूर्वानुमान।
एन्थैल्पी परिवर्तन से उष्माक्षेपी व उष्माशोषी अभिक्रियाओं का विभाजन।
गिब्स ऊर्जा का प्रयोग उद्योगों में, जैसे विद्युत-अपघटन की सम्भावना का निर्धारण।
एंट्रॉपी से मिश्रण, विलयन व चरण-परिवर्तन को समझना।
🔹 II. पाठ सार
🔵 सार-तत्त्व ✨
ऊष्मागतिकी ऊर्जा और उसके रूपान्तरण का अध्ययन है।
तंत्र तीन प्रकार के होते हैं: उष्मारुद्ध, संपूर्ण और मुक्त।
अवस्था-फलन जैसे U, H, G, S केवल प्रारम्भिक व अंतिम अवस्था पर निर्भर; जबकि Q और W पथ-फलन हैं।
प्रथम नियम: ΔU = q + w (ऊर्जा संरक्षण सिद्धान्त)।
एन्थैल्पी H = U + PV; स्थिर दाब पर q = ΔH।
द्वितीय नियम: स्वस्फूर्त प्रक्रिया में कुल एंट्रॉपी (ΔStotal) बढ़ती है।
एंट्रॉपी (S): अव्यवस्था का माप; ΔS > 0 → स्वस्फूर्त प्रवृत्ति।
तृतीय नियम: शुद्ध क्रिस्टल की एंट्रॉपी 0 K पर शून्य।
गिब्स ऊर्जा: ΔG = ΔH − TΔS;
➤ ΔG < 0 → स्वस्फूर्त, ➤ ΔG = 0 → संतुलन, ➤ ΔG > 0 → अस्वस्फूर्त।
व्यावहारिक उपयोग: अभिक्रियाओं की दिशा, उद्योगों में प्रक्रिया-निर्धारण, रासायनिक संतुलन, चरण-परिवर्तन, उष्मा और कार्य का आकलन।
🟢 निष्कर्ष 📌
ऊष्मागतिकी हमें रासायनिक प्रक्रियाओं के ऊर्जा संतुलन, स्वस्फूर्तता, संतुलन तथा व्यावहारिक उपयोग समझने का वैज्ञानिक आधार प्रदान करती है।
🔹 III. त्वरित पुनरावृत्ति
🔵 मुख्य बिन्दु 🌟
ऊष्मागतिकी ऊर्जा व उसके रूपान्तरण का विज्ञान है।
ΔU = q + w (प्रथम नियम)।
एन्थैल्पी (ΔH): स्थिर दाब पर ऊष्मा परिवर्तन।
एंट्रॉपी (ΔS): अव्यवस्था का माप; ΔS > 0 → स्वस्फूर्त।
गिब्स ऊर्जा: ΔG = ΔH − TΔS → स्वस्फूर्तता का निर्धारण।
तृतीय नियम: शून्य K पर शुद्ध क्रिस्टल की एंट्रॉपी शून्य।
————————————————————————————————————————————————————————————————————————————
पाठ्यपुस्त के प्रश्न
🔵 प्रश्न 5.1:
ऊष्मागतिकी अवस्था फलन एक राशि है —
(i) जो सभी परिस्थितियों के लिए स्थिर होती है।
(ii) जिसका मान पथ पर निर्भर नहीं करता है।
(iii) जो दाब-आयतन कार्य की गणना करने में सहायक होती है।
(iv) जिसका मान समय के साथ बदलता है।
🟢 उत्तर: (ii) जिसका मान पथ पर निर्भर नहीं करता है।
✏ व्याख्या:
ऊष्मागतिक राशियाँ जैसे आंतरिक ऊर्जा (U), एन्थैल्पी (H), एंट्रॉपी (S) आदि स्थिति फलन होती हैं।
इनका मान केवल प्रारंभिक और अंतिम अवस्थाओं पर निर्भर करता है।
✔ अतः यह पथ-निर्भर नहीं है।
🔵 प्रश्न 5.2:
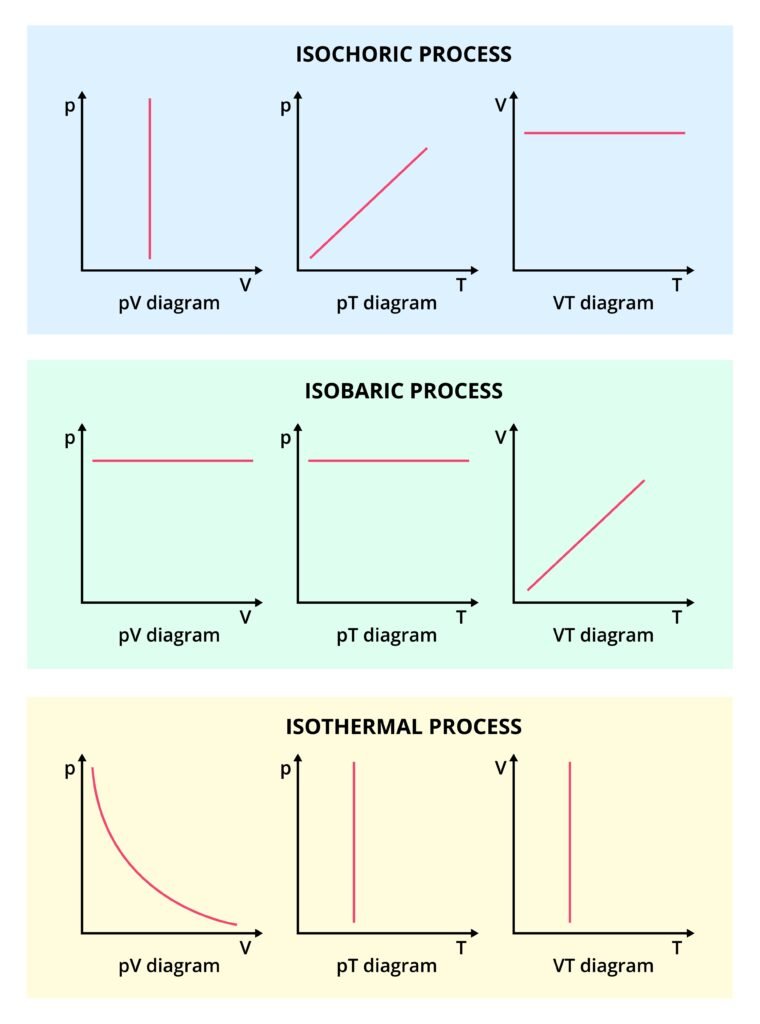
एक समतापीय प्रक्रिया (Isothermal process) के लिए —
(i) ΔT = 0
(ii) Δp = 0
(iii) q = 0
(iv) w = 0
🟢 उत्तर: (i) ΔT = 0
✏ व्याख्या:
समतापीय प्रक्रिया में तापमान स्थिर रहता है।
अतः ताप परिवर्तन (ΔT) = 0 होता है।
✔ दाब और कार्य बदल सकते हैं, लेकिन ताप स्थिर होता है।
🔵 प्रश्न 5.3:
सभी तत्वों की एन्थैल्पी उनकी संदर्भ अवस्था में होती है —
(i) शून्य
(ii) सत्य
(iii) ऋणात्मक
(iv) सभी तत्वों के लिए भिन्न
🟢 उत्तर: (i) शून्य
✏ व्याख्या:
किसी भी तत्व की मानक एन्थैल्पी (ΔH°) उसकी संदर्भ अवस्था (298 K, 1 atm) पर शून्य मानी जाती है।
✔ यह ऊष्मागतिक परिभाषा गणनाओं को सरल बनाती है।
🔵 प्रश्न 5.4:
मीथेन के दहन के लिए ΔU° = –X kJ mol⁻¹ है।
इस स्थिति में ΔH° होगा —
(i) = ΔU°
(ii) > ΔU°
(iii) < ΔU°
(iv) = 0
🟢 उत्तर: (ii) > ΔU°
✏ व्याख्या:
ऊष्मागतिक संबंध:
➡ ΔH = ΔU + Δn₍g₎RT
यदि उत्पादों के गैस मोल बढ़ते हैं, तो ΔH > ΔU।
✔ इसलिए यहाँ ΔH° > ΔU° होगा।
🔵 प्रश्न 5.5:
मीथेन के दहन की अभिक्रिया —
CH₄(g) + 2O₂(g) → CO₂(g) + 2H₂O(l)
दिए गए एन्थैल्पी मान:
CH₄(g): –74.8 kJ mol⁻¹
O₂(g): 0 kJ mol⁻¹
CO₂(g): –393.5 kJ mol⁻¹
H₂O(l): –285.8 kJ mol⁻¹
ऊष्मा परिवर्तन (ΔH°) ज्ञात कीजिए।
🟢 उत्तर:
✏ चरण 1:
उत्पादों की एन्थैल्पी = (–393.5) + 2(–285.8) = –393.5 – 571.6 = –965.1
✏ चरण 2:
अभिकारकों की एन्थैल्पी = (–74.8) + 2(0) = –74.8
✏ चरण 3:
ΔH° = उत्पाद – अभिकारक
= (–965.1) – (–74.8) = –890.3 kJ mol⁻¹
✔ अंतिम उत्तर: ΔH° = –890.3 kJ mol⁻¹ (ऊष्माक्षेपी प्रक्रिया)
🔵 प्रश्न 5.6:
एक अभिक्रिया A + B → C + D + q में q ऊष्मा निकलती है।
ऊष्मा परिवर्तन निर्भर करेगा —
(i) उच्च ताप पर
(ii) निम्न ताप पर
(iii) किसी भी ताप पर नहीं
(iv) केवल प्रारंभिक और अंतिम अवस्था पर
🟢 उत्तर: (iv) केवल प्रारंभिक और अंतिम अवस्था पर
✏ व्याख्या:
ऊष्मा परिवर्तन (ΔH) एक स्थिति फलन है।
इसका मान केवल अवस्था पर निर्भर करता है, पथ पर नहीं।
🔵 प्रश्न 5.7:
एक प्रक्रिया में 70 J ऊष्मा प्रणाली को दी गई तथा 394 J कार्य किया गया।
आंतरिक ऊर्जा का परिवर्तन ज्ञात कीजिए।
🟢 उत्तर:
✏ सूत्र: ΔU = q + w
q = +70 J (ऊष्मा प्राप्त)
w = –394 J (प्रणाली द्वारा कार्य)
ΔU = 70 – 394 = –324 J
✔ अंतिम उत्तर: ΔU = –324 J
(ऊर्जा घट रही है, इसलिए ऋणात्मक)
🔵 प्रश्न 5.8:
अभिक्रिया:
NH₄CN(s) → N₂(g) + CO(g) + 2H₂(g)
ΔH = –742.7 kJ mol⁻¹
ΔU = ? (298 K पर)
🟢 उत्तर:
✏ चरण 1:
Δn₍g₎ = (1 + 1 + 2) – 0 = 4
✏ चरण 2:
ΔH = ΔU + ΔnRT
ΔU = ΔH – ΔnRT
= –742.7 – (4 × 8.314 × 298 / 1000)
= –742.7 – 9.91 = –752.61 kJ mol⁻¹
✔ अंतिम उत्तर: ΔU = –752.61 kJ mol⁻¹
🔵 प्रश्न 5.9:
60 g एथेनॉल का ताप 35°C से 55°C तक बढ़ाने के लिए कितनी ऊष्मा चाहिए?
Cₚ(एथेनॉल) = 2.4 J g⁻¹ K⁻¹
🟢 उत्तर:
✏ सूत्र: q = m × Cₚ × ΔT
= 60 × 2.4 × (55 – 35)
= 60 × 2.4 × 20 = 2880 J
✔ अंतिम उत्तर: q = 2880 J = 2.88 kJ
🔵 प्रश्न 5.10:
10 g बर्फ को 0°C से –10°C पर ले जाने में एन्थैल्पी परिवर्तन ज्ञात कीजिए।
ΔₘH = 6.03 kJ mol⁻¹,
Cₚ(बर्फ) = 2.1 J g⁻¹ K⁻¹
🟢 उत्तर:
✏ चरण 1: बर्फ जमना (0°C पर) → ΔH₁ = –6.03 × 10/18 = –3.35 kJ
✏ चरण 2: ताप परिवर्तन → ΔH₂ = m × Cₚ × ΔT
= 10 × 2.1 × (–10) = –210 J = –0.21 kJ
✏ कुल ΔH = –3.35 – 0.21 = –3.56 kJ
✔ अंतिम उत्तर: ΔH = –3.56 kJ
🔵 प्रश्न 5.11:
CO₂(g) का मानक एन्थैल्पी निर्माण = –393.5 kJ mol⁻¹ है।
35.2 g CO₂ बनने पर ऊष्मा ज्ञात करें।
🟢 उत्तर:
✏ 1 mol CO₂ = 44 g → ऊष्मा = –393.5 kJ
✏ 35.2 g → ऊष्मा = –393.5 × 35.2 / 44 = –314.8 kJ
✔ अंतिम उत्तर: –314.8 kJ (ऊष्माक्षेपी)
🔵 प्रश्न 5.12:
अभिक्रिया :
CO(g) + ½O₂(g) → CO₂(g) , ΔH = –110 kJ mol⁻¹
N₂O(g) + 3CO(g) → N₂(g) + 3CO₂(g)
के लिए ΔH ज्ञात कीजिए।
🟢 उत्तर:
✏ चरण 1:
दी गई दूसरी अभिक्रिया में 3 mol CO से 3 mol CO₂ बनते हैं।
प्रत्येक CO → CO₂ के लिए ΔH = –110 kJ/mol
तो 3 mol के लिए ΔH = 3 × (–110) = –330 kJ
✏ चरण 2:
N₂O(g) → N₂(g) + ½O₂(g)
इसका उलटा लेने पर ΔH = +81 kJ mol⁻¹
✏ चरण 3:
कुल ΔH = (–330) + (+81) = –249 kJ
✔ अंतिम उत्तर: ΔH = –249 kJ (ऊष्माक्षेपी)
🔵 प्रश्न 5.13:
अभिक्रिया :
N₂(g) + 3H₂(g) → 2NH₃(g),
ΔH = –92.4 kJ mol⁻¹
1 mol NH₃ बनने पर ΔH = ?
🟢 उत्तर:
2 mol NH₃ बनने पर = –92.4 kJ
तो 1 mol के लिए = –92.4 ÷ 2 = –46.2 kJ
✔ अंतिम उत्तर: ΔH = –46.2 kJ mol⁻¹
🔵 प्रश्न 5.14:
CH₃OH(g) + 3/2 O₂(g) → CO₂(g) + 2H₂O(l)
के लिए ΔH ज्ञात कीजिए,
दिया गया:
ΔH°(CO₂) = –393 kJ mol⁻¹,
ΔH°(H₂O) = –286 kJ mol⁻¹,
ΔH°(CH₃OH) = –726 kJ mol⁻¹
🟢 उत्तर:
✏ उत्पादों की एन्थैल्पी = (–393) + 2(–286) = –393 – 572 = –965
✏ अभिकारकों की एन्थैल्पी = –726
ΔH = –965 – (–726) = –239 kJ
✔ अंतिम उत्तर: ΔH = –239 kJ mol⁻¹ (ऊष्माक्षेपी)
🔵 प्रश्न 5.15:
CCl₄(g) → C(g) + 4Cl(g)
के लिए ΔH ज्ञात कीजिए।
दिया गया:
ΔHf(CCl₄) = –135.5 kJ mol⁻¹
ΔHf(C) = 715.0 kJ mol⁻¹
ΔHf(Cl) = 242.0 kJ mol⁻¹
🟢 उत्तर:
✏ ΔH = [715 + 4(242)] – (–135.5)
= [715 + 968] + 135.5 = 1818.5 kJ mol⁻¹
✔ अंतिम उत्तर: ΔH = +1818.5 kJ mol⁻¹ (ऊष्माशोषी)
🔵 प्रश्न 5.16:
यदि किसी प्रक्रिया में ΔU = 0 है, तो ΔS क्या होगा?
🟢 उत्तर:
✏ ऊष्मागतिक संबंध:
ΔU = q + w
यदि ΔU = 0, तो q = –w
✔ अतः प्रणाली की कुल एंट्रॉपी (ΔS) शून्य होगी।
ΔS = 0
🔵 प्रश्न 5.17:
298 K पर अभिक्रिया:
2A + B → C
ΔH = 400 kJ mol⁻¹,
ΔS = 0.2 kJ mol⁻¹ K⁻¹
ΔG ज्ञात कीजिए।
🟢 उत्तर:
✏ सूत्र: ΔG = ΔH – TΔS
= 400 – (298 × 0.2)
= 400 – 59.6 = 340.4 kJ mol⁻¹
✔ अंतिम उत्तर: ΔG = +340.4 kJ mol⁻¹
(धनात्मक → अभिक्रिया स्वस्फूर्त नहीं)
🔵 प्रश्न 5.18:
अभिक्रिया : Cl₂(g) → 2Cl(g)
के लिए ΔS ज्ञात कीजिए।
🟢 उत्तर:
✏ गैस के मोल बढ़ने से अव्यवस्था बढ़ती है।
1 mol → 2 mol
✔ अतः ΔS = धनात्मक (+)
🔵 प्रश्न 5.19:
2A(g) + B(g) → 2D(g)
ΔU = –10.5 kJ, ΔS = –44.1 J K⁻¹
298 K पर ΔG ज्ञात कीजिए।
🟢 उत्तर:
✏ ΔG = ΔH – TΔS
ΔH ≈ ΔU (गैस मोल परिवर्तन नगण्य)
ΔG = –10.5 – 298(–0.0441)
= –10.5 + 13.15 = +2.65 kJ
✔ अंतिम उत्तर: ΔG = +2.65 kJ → अभिक्रिया स्वस्फूर्त नहीं।
🔵 प्रश्न 5.20:
300 K पर ΔS = 10 J K⁻¹, ΔH = 5 kJ
ΔG ज्ञात करें।
🟢 उत्तर:
ΔG = ΔH – TΔS
= 5 – 300 × 0.01 = 5 – 3 = 2 kJ
✔ अंतिम उत्तर: ΔG = +2 kJ → अस्वस्फूर्त अभिक्रिया
🔵 प्रश्न 5.21:
½ N₂(g) + ½ O₂(g) → NO(g), ΔH = 90 kJ mol⁻¹
NO(g) + ½ O₂(g) → NO₂(g), ΔH = –74 kJ mol⁻¹
NO₂(g) → ?
कुल ΔH ज्ञात कीजिए।
🟢 उत्तर:
पहली अभिक्रिया: +90 kJ
दूसरी: –74 kJ
कुल = +16 kJ
✔ अंतिम उत्तर: ΔH = +16 kJ mol⁻¹
🔵 प्रश्न 5.22:
1 mol H₂O(l) → H₂(g) + ½O₂(g)
के लिए ΔH ज्ञात करें।
दिया गया: ΔHf(H₂O) = –286 kJ mol⁻¹
🟢 उत्तर:
उल्टी अभिक्रिया के लिए ΔH = +286 kJ mol⁻¹
✔ अंतिम उत्तर: ΔH = +286 kJ mol⁻¹ (ऊष्माशोषी)
————————————————————————————————————————————————————————————————————————————
अन्य महत्वपूर्ण प्रश्न
(CBSE MODEL प्रश्न पत्र)
सिर्फ इसी पाठ से निर्मित CBSE MODEL प्रश्न पत्र।
खंड A — बहुविकल्पीय प्रश्न (Q1–Q16, प्रत्येक 1 अंक)
प्रश्न 1. ऊष्मागतिकी का प्रथम नियम किस रूप में व्यक्त किया जाता है?
ΔU = q − w
ΔU = q + w
ΔH = ΔU + PΔV
ΔG = ΔH − TΔS
Answer: 2
प्रश्न 2. एनथैल्पी (H) की परिभाषा है:
H = U − PV
H = U + PV
H = q − w
H = ΔE + ΔnRT
Answer: 2
प्रश्न 3. आइसोथर्मल प्रक्रिया में तापमान:
स्थिर
बढ़ता है
घटता है
अनन्त
Answer: 1
प्रश्न 4. ऐडियाबैटिक प्रक्रिया में किसका आदान–प्रदान नहीं होता?
कार्य
ऊष्मा
आयतन
दाब
Answer: 2
कथन–कारण हेतु विकल्प-कुंजी
कथन (A) एवं कारण (R) दोनों सत्य हैं तथा R, A का सही कारण है
कथन (A) एवं कारण (R) दोनों सत्य हैं परन्तु R, A का सही कारण नहीं
कथन (A) सत्य है परन्तु R असत्य
कथन (A) असत्य है परन्तु R सत्य
प्रश्न 5 (A/R).
कथन (A): ऊष्मागतिकी का प्रथम नियम ऊर्जा संरक्षण का नियम है।
कारण (R): ऊर्जा का न तो निर्माण होता है न विनाश, केवल रूपान्तरण होता है।
Answer: 1
प्रश्न 6. ΔU का चिह्न धनात्मक कब होता है?
जब तन्त्र ऊष्मा छोड़ता है
जब तन्त्र कार्य करता है
जब तन्त्र ऊर्जा प्राप्त करता है
जब ताप स्थिर रहता है
Answer: 3
प्रश्न 7. ऊष्मागतिकी का द्वितीय नियम मुख्यतः किससे सम्बन्धित है?
कार्य
एंट्रॉपी
दाब
एनथैल्पी
Answer: 2
प्रश्न 8. ΔH < 0 किस प्रकार की अभिक्रिया को सूचित करता है?
ऊष्माशोषी
ऊष्माक्षेपी
ऐडियाबैटिक
प्रतिवर्ती
Answer: 2
प्रश्न 9. मानक निर्माण एन्थैल्पी किसे कहते हैं?
1 mol यौगिक का निर्माण तत्वों से 298 K पर
1 g यौगिक का निर्माण
1 mol गैस का निर्माण
किसी भी मात्रा का निर्माण
Answer: 1
प्रश्न 10 (A/R).
कथन (A): स्वतःस्फूर्त अभिक्रिया में ΔG < 0 होता है।
कारण (R): गिब्स ऊर्जा का घटाव स्वतःस्फूर्तता की शर्त है।
Answer: 1
प्रश्न 11. एंट्रॉपी (S) किसका माप है?
ऊर्जा
कार्य
अव्यवस्था
एनथैल्पी
Answer: 3
प्रश्न 12. हेस का नियम किसके संरक्षण पर आधारित है?
द्रव्यमान
ऊर्जा
आवेश
दाब
Answer: 2
प्रश्न 13. ΔG = ΔH − TΔS समीकरण किसने दिया?
गिब्स
हेल्महोल्ट्ज़
रदरफोर्ड
डाल्टन
Answer: 1
प्रश्न 14. यदि ΔH = −40 kJ, ΔS = −100 J K⁻¹, T = 300 K, तो ΔG का मान kJ में होगा:
−10
−70
−10
+10
Answer: 4
प्रश्न 15 (A/R).
कथन (A): स्वतःस्फूर्त अभिक्रियाएँ प्रायः ऊष्माक्षेपी होती हैं।
कारण (R): ऊर्जा का उत्सर्जन स्थायित्व प्रदान करता है।
Answer: 2
प्रश्न 16. कार्य (w) का सूत्र आइसोथर्मल प्रसार के लिए है:
w = −PΔV
w = −nRT ln(V₂/V₁)
w = −ΔU
w = q + ΔU
Answer: 2
खंड B — अति लघु उत्तरीय प्रश्न (Q17–Q21, प्रत्येक 2 अंक)
प्रश्न 17. हेस का नियम लिखिए।
उत्तर:
🟦 कथन: किसी अभिक्रिया की एन्थैल्पी परिवर्तन प्रारम्भिक और अंतिम अवस्था पर निर्भर करता है, पथ पर नहीं।
🟩 परिणाम: ΔH कुल = ΔH₁ + ΔH₂ + …
प्रश्न 18. स्वतःस्फूर्तता की गिब्स शर्त लिखिए।
उत्तर:
🟦 यदि ΔG < 0 ⇒ अभिक्रिया स्वतःस्फूर्त। 🟩 यदि ΔG > 0 ⇒ अभिक्रिया अस्वतःस्फूर्त।
प्रश्न 19. एन्थैल्पी और आन्तरिक ऊर्जा में सम्बन्ध लिखिए।
उत्तर:
🟦 सूत्र: H = U + PV
🟩 अतः ΔH = ΔU + Δ(PV)
प्रश्न 20. एक मोल आदर्श गैस के लिए आइसोथर्मल प्रसार में कार्य का सूत्र लिखिए।
उत्तर:
🟦 w = −nRT ln(V₂/V₁)
🟩 n = 1 mol होने पर: w = −RT ln(V₂/V₁)
प्रश्न 21. एंट्रॉपी परिवर्तन (ΔS) का सूत्र लिखिए।
उत्तर:
🟦 ΔS = q_rev/T
🟩 यहाँ q_rev = प्रतिवर्ती ऊष्मा, T = ताप (K में)।
खंड C — लघु उत्तरीय प्रश्न (Q22–Q28, प्रत्येक 3 अंक)
प्रश्न 22. ऊष्मागतिकी का प्रथम नियम लिखिए और उसका महत्व समझाइए।
उत्तर:
🟦 प्रथम नियम: ΔU = q + w।
🟩 यह ऊर्जा संरक्षण का नियम है।
🟪 महत्व: किसी भी रासायनिक अथवा भौतिक प्रक्रिया में कुल ऊर्जा स्थिर रहती है।
प्रश्न 23. आइसोथर्मल तथा ऐडियाबैटिक प्रक्रिया में अन्तर बताइए।
उत्तर:
🟦 आइसोथर्मल: ताप स्थिर; q ≠ 0, ΔU = 0, w = −q।
🟩 ऐडियाबैटिक: q = 0; ΔU = w।
🟪 अन्तर: आइसोथर्मल में ऊष्मा आदान–प्रदान होता है, ऐडियाबैटिक में नहीं।
प्रश्न 24. 298 K पर H₂(g) + ½O₂(g) → H₂O(l) के लिए ΔH = −286 kJ mol⁻¹ है। इसका अर्थ समझाइए।
उत्तर:
🟦 1 mol द्रव जल बनने पर 286 kJ ऊष्मा मुक्त होती है।
🟩 यह ऊष्माक्षेपी प्रक्रिया है।
🟪 मानक निर्माण एन्थैल्पी = −286 kJ mol⁻¹।
प्रश्न 25. गिब्स समीकरण से स्वतःस्फूर्तता की शर्तें समझाइए।
उत्तर:
🟦 ΔG = ΔH − TΔS।
🟩 यदि ΔH < 0, ΔS > 0 ⇒ ΔG सदैव ऋणात्मक ⇒ स्वतःस्फूर्त।
🟪 यदि ΔH > 0, ΔS < 0 ⇒ स्वतःस्फूर्त नहीं।
प्रश्न 26. हेस का नियम प्रयोग करके C(graphite) से CO₂ के निर्माण की एन्थैल्पी ज्ञात करने का सिद्धान्त लिखिए।
उत्तर:
🟦 C + O₂ → CO₂ (ΔH = ?)
🟩 C + ½O₂ → CO (ΔH₁), CO + ½O₂ → CO₂ (ΔH₂)
🟪 कुल ΔH = ΔH₁ + ΔH₂।
प्रश्न 27. ऊष्माशोषी और ऊष्माक्षेपी अभिक्रियाओं में भेद उदाहरण सहित लिखिए।
उत्तर:
🟦 ऊष्माशोषी: ΔH > 0; उदाहरण – CaCO₃ → CaO + CO₂।
🟩 ऊष्माक्षेपी: ΔH < 0; उदाहरण – H₂ + Cl₂ → 2HCl।
🟪 अन्तर: पहली में ऊष्मा अवशोषित, दूसरी में उत्सर्जित।
प्रश्न 28. एक आदर्श गैस का 2 mol 300 K पर 10 L से 20 L तक आइसोथर्मल प्रसार करता है। R = 8.314 J mol⁻¹ K⁻¹। कार्य (w) ज्ञात कीजिए।
उत्तर:
🧮 w = −nRT ln(V₂/V₁)
= −2 × 8.314 × 300 × ln(20/10)
= −4988 J
✅ उत्तर: w ≈ −5.0 kJ
खंड D — प्रकरण आधारित प्रश्न (Q29–Q30, प्रत्येक 4 अंक)
प्रश्न 29.
“एक विद्यार्थी ने आदर्श गैस का आइसोथर्मल प्रसार 1 mol गैस के लिए 300 K पर 5 L से 10 L तक किया।”
(i) इस प्रक्रिया में आन्तरिक ऊर्जा परिवर्तन (ΔU) क्या होगा? (1)
(ii) कार्य (w) का सूत्र लिखिए। (1)
(iii) संख्यात्मक मान ज्ञात कीजिए। (2)
उत्तर:
🟦 (i) ΔU = 0 (आइसोथर्मल प्रक्रिया में)।
🟩 (ii) w = −nRT ln(V₂/V₁)।
🧮 (iii) w = −1 × 8.314 × 300 × ln(10/5)
= −2494 J × ln 2 ≈ −2494 × 0.693 = −1728 J ≈ −1.73 kJ
✅ उत्तर: w = −1.73 kJ
प्रश्न 30.
“किसी रासायनिक अभिक्रिया की एन्थैल्पी परिवर्तन −100 kJ तथा एंट्रॉपी परिवर्तन −200 J K⁻¹ mol⁻¹ है।”
(i) 298 K पर ΔG का मान ज्ञात कीजिए। (2)
(ii) यह अभिक्रिया स्वतःस्फूर्त है या नहीं? (1)
(iii) उच्च ताप पर इसका परिणाम क्या होगा? (1)
उत्तर:
🟦 (i) ΔG = ΔH − TΔS = (−100000 J) − 298 × (−200 J K⁻¹)
= −100000 + 59600 = −40400 J = −40.4 kJ
🟩 (ii) ΔG < 0 ⇒ अभिक्रिया स्वतःस्फूर्त।
🟪 (iii) उच्च ताप पर −TΔS धनात्मक बड़ा हो जाएगा ⇒ ΔG धनात्मक हो सकता है ⇒ स्वतःस्फूर्तता घटेगी।
खंड E — दीर्घ उत्तरीय प्रश्न (Q31–Q33, प्रत्येक 5 अंक)
प्रश्न 31.
ऊष्मागतिकी का द्वितीय नियम लिखिए और इसे एंट्रॉपी की दृष्टि से समझाइए।
उत्तर:
🟦 द्वितीय नियम: स्वतःस्फूर्त प्रक्रियाओं में ब्रह्माण्ड की एंट्रॉपी (ΔS_total) सदैव बढ़ती है।
🟩 गणितीय रूप: ΔS_universe = ΔS_system + ΔS_surroundings > 0।
🟪 उदाहरण: ऊष्मा का स्वतः उच्च ताप से निम्न ताप की ओर प्रवाह।
✅ निष्कर्ष: द्वितीय नियम ऊर्जा रूपान्तरण की दिशा व सम्भाव्यता निर्धारित करता है।
या
हेल्महोल्ट्ज़ मुक्त ऊर्जा (A = U − TS) की संकल्पना लिखिए और इसकी स्वतःस्फूर्तता की शर्त बताइए।
प्रश्न 32.
298 K पर N₂(g) + 3H₂(g) → 2NH₃(g) के लिए ΔH = −92 kJ mol⁻¹ और ΔS = −198 J K⁻¹ mol⁻¹ है। ΔG की गणना कीजिए और स्वतःस्फूर्तता पर टिप्पणी करें।
उत्तर:
🧮 ΔG = ΔH − TΔS = (−92000 J) − 298 × (−198 J K⁻¹)
= −92000 + 59000 = −33000 J = −33 kJ
🟦 ΔG < 0 ⇒ अभिक्रिया स्वतःस्फूर्त।
✅ परन्तु ΔS ऋणात्मक होने से उच्च ताप पर स्वतःस्फूर्तता घट सकती है।
या
“गिब्स ऊर्जा” की संकल्पना लिखिए और बताइए कि यह स्वतःस्फूर्तता का मानदण्ड क्यों है।
प्रश्न 33.
हेस के नियम की सहायता से C(graphite) से CO₂ की निर्माण एन्थैल्पी की गणना समझाइए।
उत्तर:
🟦 अभिक्रियाएँ:
C + ½O₂ → CO (ΔH₁)
CO + ½O₂ → CO₂ (ΔH₂)
🟩 हेस का नियम: ΔH_total = ΔH₁ + ΔH₂
🟪 अतः C + O₂ → CO₂ की एन्थैल्पी = ΔH₁ + ΔH₂।
✅ हेस के नियम से किसी भी जटिल अभिक्रिया की एन्थैल्पी ज्ञात की जा सकती है।
या
“मानक निर्माण एन्थैल्पी” की परिभाषा दीजिए और एक संख्यात्मक उदाहरण द्वारा समझाइए।
————————————————————————————————————————————————————————————————————————————
Neet पिछले सालों के प्रश्न
🔵 प्रश्न 1:
ऊष्मागतिकी का प्रथम नियम किसके संरक्षण का नियम है?
🔴 ① द्रव्यमान
🟢 ② ऊर्जा
🟡 ③ एंट्रॉपी
🔵 ④ तापमान
🟢 उत्तर: ② ऊर्जा
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: L
🔵 प्रश्न 2:
ΔU = q + w समीकरण में q किसका द्योतक है?
🔴 ① कार्य
🟢 ② ऊष्मा
🟡 ③ दाब
🔵 ④ आयतन
🟢 उत्तर: ② ऊष्मा
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: P
🔵 प्रश्न 3:
ΔH = ΔU + pΔV किस स्थिति में सत्य है?
🔴 ① स्थिर आयतन पर
🟢 ② स्थिर दाब पर
🟡 ③ शून्य कार्य पर
🔵 ④ शून्य ऊष्मा पर
🟢 उत्तर: ② स्थिर दाब पर
📘 परीक्षा: AIPMT
📅 वर्ष: 2013 | सेट: C
🔵 प्रश्न 4:
एन्थैल्पी परिवर्तन किस प्रकार की राशि है?
🔴 ① पथ फलन
🟢 ② अवस्था फलन
🟡 ③ कोई नहीं
🔵 ④ यादृच्छिक फलन
🟢 उत्तर: ② अवस्था फलन
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: J
🔵 प्रश्न 5:
एंट्रॉपी (S) का मान किस स्थिति में अधिकतम होता है?
🔴 ① ठोस
🟢 ② द्रव
🟡 ③ गैस
🔵 ④ प्लाज्मा
🟢 उत्तर: ③ गैस
📘 परीक्षा: NEET
📅 वर्ष: 2015 | सेट: O
🔵 प्रश्न 6:
किस अवस्था में ΔU = q होता है?
🔴 ① स्थिर दाब पर
🟢 ② स्थिर आयतन पर
🟡 ③ समतापी पर
🔵 ④ समदाबी पर
🟢 उत्तर: ② स्थिर आयतन पर
📘 परीक्षा: AIPMT
📅 वर्ष: 2012 | सेट: A
🔵 प्रश्न 7:
गिब्स मुक्त ऊर्जा (ΔG) का समीकरण है:
🔴 ① ΔG = ΔH – TΔS
🟢 ② ΔG = ΔH + TΔS
🟡 ③ ΔG = ΔU – TΔS
🔵 ④ ΔG = ΔH/T
🟢 उत्तर: ① ΔG = ΔH – TΔS
📘 परीक्षा: NEET
📅 वर्ष: 2021 | सेट: Q
🔵 प्रश्न 8:
किसी स्वतःस्फूर्त अभिक्रिया में ΔG का मान कैसा होगा?
🔴 ① धनात्मक
🟢 ② ऋणात्मक
🟡 ③ शून्य
🔵 ④ कोई भी
🟢 उत्तर: ② ऋणात्मक
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: S
🔵 प्रश्न 9:
ऊष्मागतिकी का द्वितीय नियम किससे सम्बन्धित है?
🔴 ① ऊर्जा संरक्षण
🟢 ② एंट्रॉपी की वृद्धि
🟡 ③ ऊष्मा = कार्य
🔵 ④ द्रव्यमान संरक्षण
🟢 उत्तर: ② एंट्रॉपी की वृद्धि
📘 परीक्षा: NEET
📅 वर्ष: 2014 | सेट: D
🔵 प्रश्न 10:
ΔG = 0 का अर्थ है:
🔴 ① अभिक्रिया स्वतःस्फूर्त है
🟢 ② साम्यावस्था है
🟡 ③ असंभव अभिक्रिया है
🔵 ④ ऊष्मा का उत्सर्जन
🟢 उत्तर: ② साम्यावस्था है
📘 परीक्षा: AIPMT
📅 वर्ष: 2011 | सेट: B
🔵 प्रश्न 11:
ΔH = ऋणात्मक और ΔS = धनात्मक होने पर अभिक्रिया कैसी होगी?
🔴 ① अस्वतःस्फूर्त
🟢 ② स्वतःस्फूर्त
🟡 ③ साम्यावस्था
🔵 ④ असंभव
🟢 उत्तर: ② स्वतःस्फूर्त
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: L
🔵 प्रश्न 12:
मानक एन्थैल्पी परिवर्तन किस स्थिति में मापा जाता है?
🔴 ① 25 °C, 1 atm
🟢 ② 0 °C, 1 atm
🟡 ③ 100 °C, 1 atm
🔵 ④ 273 K, 1 bar
🟢 उत्तर: ① 25 °C, 1 atm
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: P
🔵 प्रश्न 13:
हैस का नियम किससे सम्बन्धित है?
🔴 ① एंट्रॉपी
🟢 ② एन्थैल्पी
🟡 ③ गिब्स ऊर्जा
🔵 ④ एंट्रॉपी + एन्थैल्पी
🟢 उत्तर: ② एन्थैल्पी
📘 परीक्षा: AIPMT
📅 वर्ष: 2010 | सेट: C
🔵 प्रश्न 14:
ऊष्मागतिकी का तृतीय नियम कहता है कि:
🔴 ① शून्य K पर एंट्रॉपी शून्य होती है
🟢 ② शून्य K पर एंट्रॉपी अधिकतम होती है
🟡 ③ एन्थैल्पी स्थिर रहती है
🔵 ④ गिब्स ऊर्जा शून्य होती है
🟢 उत्तर: ① शून्य K पर एंट्रॉपी शून्य होती है
📘 परीक्षा: NEET
📅 वर्ष: 2013 | सेट: A
🔵 प्रश्न 15:
स्वतन्त्र ऊर्जा (Free Energy) किसे कहते हैं?
🔴 ① ΔH
🟢 ② ΔU
🟡 ③ ΔG
🔵 ④ ΔS
🟢 उत्तर: ③ ΔG
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: Q
🔵 प्रश्न 16:
एन्थैल्पी का प्रतीक क्या है?
🔴 ① U
🟢 ② H
🟡 ③ S
🔵 ④ G
🟢 उत्तर: ② H
📘 परीक्षा: NEET
📅 वर्ष: 2011 | सेट: Y
🔵 प्रश्न 17:
किस स्थिति में ΔH = ΔU होता है?
🔴 ① ठोस → द्रव
🟢 ② स्थिर आयतन
🟡 ③ गैस विस्तार
🔵 ④ स्थिर दाब
🟢 उत्तर: ② स्थिर आयतन
📘 परीक्षा: NEET
📅 वर्ष: 2020 | सेट: T
🔵 प्रश्न 18:
स्वतःस्फूर्त अभिक्रिया की मुख्य चालक शक्ति है:
🔴 ① न्यूनतम ΔH
🟢 ② अधिकतम ΔS
🟡 ③ न्यूनतम ΔG
🔵 ④ न्यूनतम ΔU
🟢 उत्तर: ③ न्यूनतम ΔG
📘 परीक्षा: AIPMT
📅 वर्ष: 2012 | सेट: D
🔵 प्रश्न 19:
ΔH = धनात्मक और ΔS = ऋणात्मक होने पर अभिक्रिया कैसी होगी?
🔴 ① स्वतःस्फूर्त
🟢 ② अस्वतःस्फूर्त
🟡 ③ साम्यावस्था
🔵 ④ अनिश्चित
🟢 उत्तर: ② अस्वतःस्फूर्त
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: R
🔵 प्रश्न 20:
ΔU का मान किस पर निर्भर करता है?
🔴 ① पथ पर
🟢 ② अवस्था पर
🟡 ③ समय पर
🔵 ④ तापमान पर
🟢 उत्तर: ② अवस्था पर
📘 परीक्षा: NEET
📅 वर्ष: 2014 | सेट: C
🔵 प्रश्न 21:
ΔH°f (मानक गठन एन्थैल्पी) किसके लिए शून्य होता है?
🔴 ① यौगिक
🟢 ② तत्व
🟡 ③ मिश्रण
🔵 ④ विलयन
🟢 उत्तर: ② तत्व
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: K
🔵 प्रश्न 22:
किसी रासायनिक अभिक्रिया की स्वतःस्फूर्तता किससे ज्ञात की जाती है?
🔴 ① ΔH
🟢 ② ΔS
🟡 ③ ΔG
🔵 ④ ΔU
🟢 उत्तर: ③ ΔG
📘 परीक्षा: AIPMT
📅 वर्ष: 2011 | सेट: A
🔵 प्रश्न 23:
साम्यावस्था में गिब्स ऊर्जा का मान होता है:
🔴 ① ऋणात्मक
🟢 ② शून्य
🟡 ③ धनात्मक
🔵 ④ अनिश्चित
🟢 उत्तर: ② शून्य
📘 परीक्षा: NEET
📅 वर्ष: 2020 | सेट: M
🔵 प्रश्न 24:
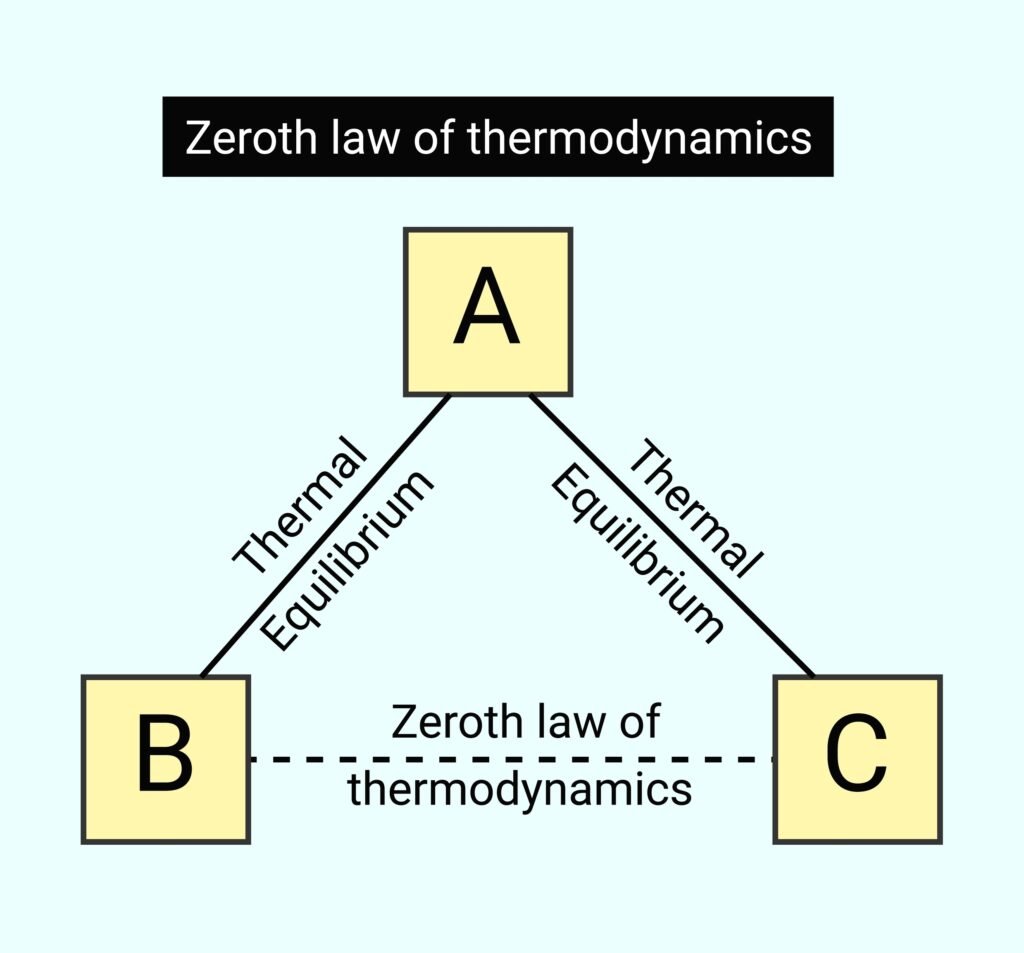
ऊष्मागतिकी का शून्यवाँ नियम किसे स्थापित करता है?
🔴 ① एन्थैल्पी
🟢 ② तापमान
🟡 ③ एंट्रॉपी
🔵 ④ दाब
🟢 उत्तर: ② तापमान
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: L
🔵 प्रश्न 25:
प्रथम नियम के अनुसार ऊर्जा का आदान-प्रदान किस रूप में होता है?
🔴 ① ऊष्मा एवं कार्य
🟢 ② केवल ऊष्मा
🟡 ③ केवल कार्य
🔵 ④ केवल एन्थैल्पी
🟢 उत्तर: ① ऊष्मा एवं कार्य
📘 परीक्षा: NEET
📅 वर्ष: 2015 | सेट: S
🔵 प्रश्न 26:
गिब्स मुक्त ऊर्जा का ऋणात्मक मान किसे इंगित करता है?
🔴 ① अभिक्रिया अस्वतःस्फूर्त है
🟢 ② अभिक्रिया स्वतःस्फूर्त है
🟡 ③ साम्यावस्था है
🔵 ④ असंभव अभिक्रिया है
🟢 उत्तर: ② अभिक्रिया स्वतःस्फूर्त है
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: K
🔵 प्रश्न 27:
ऊष्मागतिकी का शून्यवाँ नियम किसका आधार है?
🔴 ① तापमान मापन
🟢 ② ऊष्मा प्रवाह
🟡 ③ एंट्रॉपी
🔵 ④ ऊर्जा संरक्षण
🟢 उत्तर: ① तापमान मापन
📘 परीक्षा: AIPMT
📅 वर्ष: 2014 | सेट: D
🔵 प्रश्न 28:
ΔH = धनात्मक, ΔS = धनात्मक और उच्च तापमान पर अभिक्रिया कैसी होगी?
🔴 ① स्वतःस्फूर्त
🟢 ② अस्वतःस्फूर्त
🟡 ③ साम्यावस्था
🔵 ④ असंभव
🟢 उत्तर: ① स्वतःस्फूर्त
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: L
🔵 प्रश्न 29:
ऊष्मागतिकी का प्रथम नियम किस समीकरण से व्यक्त होता है?
🔴 ① ΔU = q – w
🟢 ② ΔU = q + w
🟡 ③ ΔU = w – q
🔵 ④ ΔU = pΔV
🟢 उत्तर: ② ΔU = q + w
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: P
🔵 प्रश्न 30:
किसी आदर्श गैस का आंतरिक ऊर्जा परिवर्तन किस पर निर्भर करता है?
🔴 ① दाब और आयतन पर
🟢 ② केवल तापमान पर
🟡 ③ केवल आयतन पर
🔵 ④ केवल दाब पर
🟢 उत्तर: ② केवल तापमान पर
📘 परीक्षा: NEET
📅 वर्ष: 2015 | सेट: S
🔵 प्रश्न 31:
एंट्रॉपी किसका माप है?
🔴 ① ऊष्मा का आदान-प्रदान
🟢 ② अव्यवस्था (disorder)
🟡 ③ एन्थैल्पी
🔵 ④ कार्य
🟢 उत्तर: ② अव्यवस्था (disorder)
📘 परीक्षा: AIPMT
📅 वर्ष: 2013 | सेट: B
🔵 प्रश्न 32:
किसी स्वतःस्फूर्त अभिक्रिया के लिए ΔS(ब्रह्मांड) कैसा होना चाहिए?
🔴 ① धनात्मक
🟢 ② ऋणात्मक
🟡 ③ शून्य
🔵 ④ कोई नहीं
🟢 उत्तर: ① धनात्मक
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: R
🔵 प्रश्न 33:
एन्थैल्पी (H) को किस प्रकार परिभाषित किया जाता है?
🔴 ① H = U – pV
🟢 ② H = U + pV
🟡 ③ H = U × pV
🔵 ④ H = U/pV
🟢 उत्तर: ② H = U + pV
📘 परीक्षा: NEET
📅 वर्ष: 2020 | सेट: J
🔵 प्रश्न 34:
एंट्रॉपी का SI मात्रक क्या है?
🔴 ① J mol⁻¹ K⁻¹
🟢 ② J mol⁻¹
🟡 ③ cal mol⁻¹
🔵 ④ J K⁻¹
🟢 उत्तर: ① J mol⁻¹ K⁻¹
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: N
🔵 प्रश्न 35:
एन्थैल्पी परिवर्तन एक … है।
🔴 ① पथ फलन
🟢 ② अवस्था फलन
🟡 ③ असत्य फलन
🔵 ④ स्थिर फलन
🟢 उत्तर: ② अवस्था फलन
📘 परीक्षा: AIPMT
📅 वर्ष: 2012 | सेट: A
🔵 प्रश्न 36:
ΔH = ΔU + RT समीकरण किसके लिए प्रयुक्त होता है?
🔴 ① ठोस अवस्था
🟢 ② 1 मोल गैस
🟡 ③ द्रव अवस्था
🔵 ④ किसी भी अवस्था
🟢 उत्तर: ② 1 मोल गैस
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: Q
🔵 प्रश्न 37:
ΔH = ऋणात्मक, ΔS = ऋणात्मक और निम्न तापमान पर अभिक्रिया कैसी होगी?
🔴 ① स्वतःस्फूर्त
🟢 ② अस्वतःस्फूर्त
🟡 ③ साम्यावस्था
🔵 ④ असंभव
🟢 उत्तर: ① स्वतःस्फूर्त
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: M
🔵 प्रश्न 38:
गिब्स मुक्त ऊर्जा की SI इकाई क्या है?
🔴 ① J
🟢 ② J mol⁻¹
🟡 ③ J K⁻¹
🔵 ④ J mol⁻¹ K⁻¹
🟢 उत्तर: ② J mol⁻¹
📘 परीक्षा: NEET
📅 वर्ष: 2015 | सेट: C
🔵 प्रश्न 39:
साम्यावस्था पर ΔG का मान क्या होता है?
🔴 ① ऋणात्मक
🟢 ② शून्य
🟡 ③ धनात्मक
🔵 ④ अधिकतम
🟢 उत्तर: ② शून्य
📘 परीक्षा: AIPMT
📅 वर्ष: 2011 | सेट: B
🔵 प्रश्न 40:
किस स्थिति में ΔH = ΔU होता है?
🔴 ① जब ΔV = 0
🟢 ② जब Δp = 0
🟡 ③ जब T = 0
🔵 ④ जब q = 0
🟢 उत्तर: ① जब ΔV = 0
📘 परीक्षा: NEET
📅 वर्ष: 2014 | सेट: A
🔵 प्रश्न 41:
हैस का नियम क्या बताता है?
🔴 ① ΔH पथ पर निर्भर करता है
🟢 ② ΔH पथ से स्वतंत्र है
🟡 ③ ΔS पथ पर निर्भर करता है
🔵 ④ ΔU पथ पर निर्भर करता है
🟢 उत्तर: ② ΔH पथ से स्वतंत्र है
📘 परीक्षा: NEET
📅 वर्ष: 2013 | सेट: D
🔵 प्रश्न 42:
ΔU का SI मात्रक क्या है?
🔴 ① J
🟢 ② cal
🟡 ③ eV
🔵 ④ KJ mol⁻¹
🟢 उत्तर: ① J
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: S
🔵 प्रश्न 43:
ΔH धनात्मक और ΔS धनात्मक होने पर उच्च तापमान पर अभिक्रिया कैसी होगी?
🔴 ① स्वतःस्फूर्त
🟢 ② अस्वतःस्फूर्त
🟡 ③ साम्यावस्था
🔵 ④ कोई नहीं
🟢 उत्तर: ① स्वतःस्फूर्त
📘 परीक्षा: AIPMT
📅 वर्ष: 2010 | सेट: C
🔵 प्रश्न 44:
एंट्रॉपी परिवर्तन का चिन्ह किस स्थिति में ऋणात्मक होगा?
🔴 ① ठोस → द्रव
🟢 ② गैस → द्रव
🟡 ③ द्रव → गैस
🔵 ④ ठोस → गैस
🟢 उत्तर: ② गैस → द्रव
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: K
🔵 प्रश्न 45:
एन्थैल्पी परिवर्तन मापा जाता है:
🔴 ① स्थिर दाब पर
🟢 ② स्थिर आयतन पर
🟡 ③ स्थिर तापमान पर
🔵 ④ स्थिर एंट्रॉपी पर
🟢 उत्तर: ① स्थिर दाब पर
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: L
🔵 प्रश्न 46:
एंट्रॉपी किसका माप है?
🔴 ① यादृच्छिकता
🟢 ② साम्यावस्था
🟡 ③ कार्य
🔵 ④ एन्थैल्पी
🟢 उत्तर: ① यादृच्छिकता
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: N
🔵 प्रश्न 47:
ΔH धनात्मक और ΔS ऋणात्मक होने पर अभिक्रिया कैसी होगी?
🔴 ① स्वतःस्फूर्त
🟢 ② अस्वतःस्फूर्त
🟡 ③ साम्यावस्था
🔵 ④ कोई नहीं
🟢 उत्तर: ② अस्वतःस्फूर्त
📘 परीक्षा: NEET
📅 वर्ष: 2015 | सेट: R
🔵 प्रश्न 48:
एन्थैल्पी और आंतरिक ऊर्जा का संबंध किससे है?
🔴 ① ΔH = ΔU + pΔV
🟢 ② ΔH = ΔU – pΔV
🟡 ③ ΔH = ΔU × pΔV
🔵 ④ ΔH = ΔU/pΔV
🟢 उत्तर: ① ΔH = ΔU + pΔV
📘 परीक्षा: NEET
📅 वर्ष: 2013 | सेट: S
🔵 प्रश्न 49:
किस अभिक्रिया में ΔS ऋणात्मक होता है?
🔴 ① NH₃ (g) → N₂ (g) + H₂ (g)
🟢 ② H₂O (g) → H₂O (l)
🟡 ③ NaCl (s) → Na⁺ (aq) + Cl⁻ (aq)
🔵 ④ N₂ (g) + 3H₂ (g) → 2NH₃ (g)
🟢 उत्तर: ② H₂O (g) → H₂O (l)
📘 परीक्षा: NEET
📅 वर्ष: 2011 | सेट: B
🔵 प्रश्न 50:
एंट्रॉपी परिवर्तन (ΔS) की इकाई क्या है?
🔴 ① cal K⁻¹ mol⁻¹
🟢 ② J K⁻¹ mol⁻¹
🟡 ③ J mol⁻¹
🔵 ④ eV
🟢 उत्तर: ② J K⁻¹ mol⁻¹
📘 परीक्षा: NEET
📅 वर्ष: 2021 | सेट: T
————————————————————————————————————————————————————————————————————————————
JEE MAINS पिछले सालों के प्रश्न
🔵 प्रश्न 1: ऊष्मागतिकी का प्रथम नियम किस सिद्धान्त का कथन है?
🔴 ① ऊर्जा संरक्षण
🟢 ② द्रव्यमान संरक्षण
🟡 ③ संवेग संरक्षण
🔵 ④ बल संतुलन
🟢 उत्तर: ① ऊर्जा संरक्षण
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | पाली: प्रातःकाल
🔵 प्रश्न 2: ΔH = ΔU + Δn₉RT सूत्र कब प्रयुक्त होता है?
🔴 ① ठोस-ठोस अभिक्रियाएँ
🟢 ② केवल द्रव अवस्था
🟡 ③ गैसीय अवस्था
🔵 ④ लवण विलयन
🟢 उत्तर: ③ गैसीय अवस्था
📘 परीक्षा: JEE Main
📅 वर्ष: 2022 | पाली: सायंकाल
🔵 प्रश्न 3: यदि ΔH = −x kJ और ΔS = −y J/K हो, तो अभिक्रिया किस दशा में स्वतःस्फूर्त होगी?
🔴 ① उच्च ताप पर
🟢 ② निम्न ताप पर
🟡 ③ सभी ताप पर
🔵 ④ किसी भी ताप पर नहीं
🟢 उत्तर: ② निम्न ताप पर
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | पाली: सायंकाल
🔵 प्रश्न 4: किसी तंत्र में एन्थैलपी परिवर्तन (ΔH) की परिभाषा है:
🔴 ① स्थिर आयतन पर ऊष्मा
🟢 ② स्थिर दाब पर ऊष्मा
🟡 ③ कार्य
🔵 ④ आंतरिक ऊर्जा
🟢 उत्तर: ② स्थिर दाब पर ऊष्मा
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | पाली: प्रातःकाल
🔵 प्रश्न 5: ΔG = ΔH − TΔS समीकरण को क्या कहते हैं?
🔴 ① हेस का नियम
🟢 ② गिब्स–हेल्महोल्त्ज़ समीकरण
🟡 ③ बॉर्न–हैबर चक्र
🔵 ④ बॉयल का नियम
🟢 उत्तर: ② गिब्स–हेल्महोल्त्ज़ समीकरण
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | पाली: सायंकाल
🔵 प्रश्न 6: स्वतःस्फूर्तता की शर्त क्या है?
🔴 ① ΔG > 0
🟢 ② ΔG < 0 🟡 ③ ΔS < 0 🔵 ④ ΔH > 0
🟢 उत्तर: ② ΔG < 0
📘 परीक्षा: JEE Main
📅 वर्ष: 2023 | पाली: प्रातःकाल
🔵 प्रश्न 7: हेस का नियम किस पर आधारित है?
🔴 ① ऊर्जा संरक्षण
🟢 ② दाब का नियम
🟡 ③ आयतन का नियम
🔵 ④ आदर्श गैस का नियम
🟢 उत्तर: ① ऊर्जा संरक्षण
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | पाली: सायंकाल
🔵 प्रश्न 8: यदि ΔH और ΔU ज्ञात हों, तो किसी अभिक्रिया में गैस के मोल परिवर्तन की गणना किससे की जाती है?
🔴 ① Δn₉ = (ΔH − ΔU)/(RT)
🟢 ② Δn₉ = (ΔU − ΔH)/(RT)
🟡 ③ Δn₉ = ΔH/RT
🔵 ④ Δn₉ = ΔU/RT
🟢 उत्तर: ① Δn₉ = (ΔH − ΔU)/(RT)
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | पाली: प्रातःकाल
🔵 प्रश्न 9: शुद्ध क्रिस्टल का एंट्रॉपी 0 K पर शून्य होती है। यह किस नियम का कथन है?
🔴 ① प्रथम नियम
🟢 ② द्वितीय नियम
🟡 ③ तृतीय नियम
🔵 ④ शून्यवाँ नियम
🟢 उत्तर: ③ तृतीय नियम
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | पाली: सायंकाल
🔵 प्रश्न 10: आंतरिक ऊर्जा (U) किस प्रकार का फलन है?
🔴 ① पथ फलन
🟢 ② अवस्था फलन
🟡 ③ कोई नहीं
🔵 ④ केवल तापमान पर निर्भर
🟢 उत्तर: ② अवस्था फलन
📘 परीक्षा: JEE Main
📅 वर्ष: 2021 | पाली: प्रातःकाल
🔵 प्रश्न 11: एंट्रॉपी का SI मात्रक क्या है?
🔴 ① J/mol
🟢 ② J/K·mol
🟡 ③ J/K
🔵 ④ cal/mol
🟢 उत्तर: ② J/K·mol
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | पाली: सायंकाल
🔵 प्रश्न 12: यदि ΔH = 0 और ΔS < 0 हो, तो ΔG का मान क्या होगा?
🔴 ① सदैव धनात्मक
🟢 ② सदैव ऋणात्मक
🟡 ③ शून्य
🔵 ④ कभी +ve, कभी −ve
🟢 उत्तर: ① सदैव धनात्मक
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | पाली: प्रातःकाल
🔵 प्रश्न 13: बॉर्न–हैबर चक्र का उपयोग किसके लिये होता है?
🔴 ① ऊष्मा धारिता
🟢 ② जाली एन्थैलपी
🟡 ③ इलेक्ट्रॉन अभिलाक्षणिकता
🔵 ④ हाइड्रेशन एन्थैलपी
🟢 उत्तर: ② जाली एन्थैलपी
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | पाली: सायंकाल
🔵 प्रश्न 14: एक आदर्श गैस के लिये आंतरिक ऊर्जा परिवर्तन (dU) किस पर निर्भर है?
🔴 ① दाब
🟢 ② तापमान
🟡 ③ आयतन
🔵 ④ मोल संख्या
🟢 उत्तर: ② तापमान
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | पाली: प्रातःकाल
🔵 प्रश्न 15: ऊष्मागतिकी का शून्यवाँ नियम किससे सम्बन्धित है?
🔴 ① एंट्रॉपी
🟢 ② ऊष्मा संतुलन
🟡 ③ कार्य
🔵 ④ द्रव्यमान
🟢 उत्तर: ② ऊष्मा संतुलन
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | पाली: प्रातःकाल
🔵 प्रश्न 16: किसी प्रक्रिया की स्वतःस्फूर्तता केवल किससे निर्धारित होती है?
🔴 ① ΔH से
🟢 ② ΔG से
🟡 ③ ΔS से
🔵 ④ तापमान से
🟢 उत्तर: ② ΔG से
📘 परीक्षा: JEE Main
📅 वर्ष: 2022 | पाली: सायंकाल
🔵 प्रश्न 17: ΔH = ΔU + PΔV समीकरण कब सत्य होता है?
🔴 ① स्थिर आयतन पर
🟢 ② स्थिर दाब पर
🟡 ③ सभी दशाओं में
🔵 ④ शून्य दाब पर
🟢 उत्तर: ② स्थिर दाब पर
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | पाली: प्रातःकाल
🔵 प्रश्न 18: यदि ΔH = +10 kJ और ΔS = +50 J/K हो, तो किस तापमान पर प्रक्रिया स्वतःस्फूर्त होगी?
🔴 ① T < 200 K 🟢 ② T > 200 K
🟡 ③ सभी T
🔵 ④ कोई नहीं
🟢 उत्तर: ② T > 200 K
📘 परीक्षा: JEE Main
📅 वर्ष: 2021 | पाली: सायंकाल
🔵 प्रश्न 19: आंतरिक ऊर्जा परिवर्तन (ΔU) किस प्रकार का फलन है?
🔴 ① पथ फलन
🟢 ② अवस्था फलन
🟡 ③ कोई नहीं
🔵 ④ केवल कार्य
🟢 उत्तर: ② अवस्था फलन
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | पाली: प्रातःकाल
🔵 प्रश्न 20: यदि ΔH = ΔU हो, तो क्या निष्कर्ष है?
🔴 ① Δn₉ = 0
🟢 ② Δn₉ = 1
🟡 ③ Δn₉ = −1
🔵 ④ Δn₉ ≠ 0
🟢 उत्तर: ① Δn₉ = 0
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | पाली: सायंकाल
🔵 प्रश्न 21: किसी प्रणाली का प्रतिवर्ती ऐडियाबैटिक प्रसार किस नियम से नियंत्रित होता है?
🔴 ① pV = nRT
🟢 ② pV^γ = स्थिरांक
🟡 ③ T ∝ V
🔵 ④ p/T = स्थिरांक
🟢 उत्तर: ② pV^γ = स्थिरांक
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | पाली: प्रातःकाल
🔵 प्रश्न 22: यदि ΔS > 0 और ΔH < 0, तो प्रक्रिया कैसी होगी?
🔴 ① अस्वतःस्फूर्त
🟢 ② स्वतःस्फूर्त
🟡 ③ संतुलन पर
🔵 ④ असम्भव
🟢 उत्तर: ② स्वतःस्फूर्त
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | पाली: प्रातःकाल
🔵 प्रश्न 23: गिब्स मुक्त ऊर्जा (ΔG) किस पर निर्भर है?
🔴 ① ΔH और ΔS पर
🟢 ② ΔH और TΔS पर
🟡 ③ केवल ΔS पर
🔵 ④ केवल ΔH पर
🟢 उत्तर: ② ΔH और TΔS पर
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | पाली: सायंकाल
🔵 प्रश्न 24: एन्थैलपी (H) किसके बराबर होती है?
🔴 ① U − PV
🟢 ② U + PV
🟡 ③ U + TΔS
🔵 ④ U − TS
🟢 उत्तर: ② U + PV
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | पाली: प्रातःकाल
🔵 प्रश्न 25: यदि ΔH = +20 kJ और ΔS = −100 J/K हो, तो ΔG किस तापमान पर ऋणात्मक होगा?
🔴 ① किसी भी T पर नहीं
🟢 ② सभी T पर
🟡 ③ केवल उच्च T पर
🔵 ④ केवल निम्न T पर
🟢 उत्तर: ① किसी भी T पर नहीं
📘 परीक्षा: JEE Main
📅 वर्ष: 2023 | पाली: सायंकाल
🔵 प्रश्न 26: किसी आदर्श गैस का समतापी प्रसार करने पर आंतरिक ऊर्जा में क्या परिवर्तन होगा?
🔴 ① घटेगा
🟢 ② बढ़ेगा
🟡 ③ अपरिवर्तित रहेगा
🔵 ④ पहले घटेगा फिर बढ़ेगा
🟢 उत्तर: ③ अपरिवर्तित रहेगा
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | पाली: प्रातःकाल
🔵 प्रश्न 27: ΔG = 0 का अर्थ है —
🔴 ① स्वतःस्फूर्त प्रक्रिया
🟢 ② अस्वतःस्फूर्त प्रक्रिया
🟡 ③ साम्यावस्था
🔵 ④ असम्भव प्रक्रिया
🟢 उत्तर: ③ साम्यावस्था
📘 परीक्षा: JEE Main
📅 वर्ष: 2021 | पाली: सायंकाल
🔵 प्रश्न 28: यदि ΔH = −10 kJ और ΔS = +50 J/K हो, तो प्रक्रिया कैसी होगी?
🔴 ① स्वतःस्फूर्त
🟢 ② अस्वतःस्फूर्त
🟡 ③ साम्य पर
🔵 ④ ताप पर निर्भर
🟢 उत्तर: ① स्वतःस्फूर्त
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | पाली: सायंकाल
🔵 प्रश्न 29: किसी प्रतिवर्ती ऐडियाबैटिक प्रसार में कार्य किसके बराबर होता है?
🔴 ① ΔU
🟢 ② ΔH
🟡 ③ q
🔵 ④ ΔS
🟢 उत्तर: ① ΔU
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | पाली: प्रातःकाल
🔵 प्रश्न 30: मानक निर्माण एन्थैलपी (ΔHf°) किसके लिये शून्य होती है?
🔴 ① H₂O(l)
🟢 ② O₂(g)
🟡 ③ NaCl(s)
🔵 ④ CO₂(g)
🟢 उत्तर: ② O₂(g)
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | पाली: सायंकाल
🔵 प्रश्न 31: मुक्त प्रसार (free expansion) में कार्य (w) और ऊष्मा (q) का मान क्या होगा?
🔴 ① w=0, q=0
🟢 ② w≠0, q=0
🟡 ③ w=0, q≠0
🔵 ④ w≠0, q≠0
🟢 उत्तर: ① w=0, q=0
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | पाली: प्रातःकाल
🔵 प्रश्न 32: यदि ΔH < 0 और ΔS > 0, तो प्रक्रिया —
🔴 ① अस्वतःस्फूर्त
🟢 ② स्वतःस्फूर्त
🟡 ③ साम्य पर
🔵 ④ ताप पर निर्भर
🟢 उत्तर: ② स्वतःस्फूर्त
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | पाली: सायंकाल
🔵 प्रश्न 33: स्थिर आयतन पर एन्थैलपी परिवर्तन (ΔH) किसके बराबर होता है?
🔴 ① ΔU
🟢 ② ΔU + pΔV
🟡 ③ qv
🔵 ④ qp
🟢 उत्तर: ③ qv
📘 परीक्षा: JEE Main
📅 वर्ष: 2021 | पाली: प्रातःकाल
🔵 प्रश्न 34: एक आदर्श गैस में ΔU = nCvΔT. यह किस नियम पर आधारित है?
🔴 ① प्रथम नियम
🟢 ② द्वितीय नियम
🟡 ③ तृतीय नियम
🔵 ④ शून्यवाँ नियम
🟢 उत्तर: ① प्रथम नियम
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | पाली: सायंकाल
🔵 प्रश्न 35: एन्थैलपी परिवर्तन (ΔH) और आंतरिक ऊर्जा परिवर्तन (ΔU) में अंतर किस कारण से होता है?
🔴 ① तापमान
🟢 ② दाब-आयतन कार्य
🟡 ③ एंट्रॉपी
🔵 ④ मोल संख्या
🟢 उत्तर: ② दाब-आयतन कार्य
📘 परीक्षा: JEE Main
📅 वर्ष: 2023 | पाली: प्रातःकाल
🔵 प्रश्न 36: किसी प्रक्रिया के लिये यदि ΔG > 0 है, तो —
🔴 ① स्वतःस्फूर्त
🟢 ② अस्वतःस्फूर्त
🟡 ③ साम्यावस्था
🔵 ④ ऊष्मा उत्सर्जक
🟢 उत्तर: ② अस्वतःस्फूर्त
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | पाली: प्रातःकाल
🔵 प्रश्न 37: मानक अवस्था (298 K, 1 bar) में किसी तत्व की एन्थैलपी कितनी ली जाती है?
🔴 ① 1 kJ/mol
🟢 ② 0
🟡 ③ −1 kJ/mol
🔵 ④ 100 kJ/mol
🟢 उत्तर: ② 0
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | पाली: प्रातःकाल
🔵 प्रश्न 38: तृतीय नियम के अनुसार शुद्ध क्रिस्टल की एंट्रॉपी किस ताप पर शून्य होती है?
🔴 ① 100 K
🟢 ② 0 K
🟡 ③ 273 K
🔵 ④ 298 K
🟢 उत्तर: ② 0 K
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | पाली: प्रातःकाल
🔵 प्रश्न 39: ΔH = ΔU + Δn₉RT सूत्र में Δn₉ क्या दर्शाता है?
🔴 ① सभी मोल परिवर्तन
🟢 ② गैस मोल परिवर्तन
🟡 ③ ठोस मोल परिवर्तन
🔵 ④ द्रव मोल परिवर्तन
🟢 उत्तर: ② गैस मोल परिवर्तन
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | पाली: प्रातःकाल
🔵 प्रश्न 40: गिब्स मुक्त ऊर्जा का SI मात्रक क्या है?
🔴 ① kJ
🟢 ② J/mol
🟡 ③ J/mol·K
🔵 ④ J
🟢 उत्तर: ② J/mol
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | पाली: सायंकाल
🔵 प्रश्न 41: यदि किसी अभिक्रिया के लिये ΔH = +ve और ΔS = +ve है, तो प्रक्रिया कब स्वतःस्फूर्त होगी?
🔴 ① उच्च T पर
🟢 ② निम्न T पर
🟡 ③ किसी भी T पर
🔵 ④ कभी नहीं
🟢 उत्तर: ① उच्च T पर
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | पाली: सायंकाल
🔵 प्रश्न 42: एक आदर्श गैस का समदाबीय प्रसार करने पर —
🔴 ① ΔU=0
🟢 ② ΔH = q
🟡 ③ ΔH=0
🔵 ④ ΔS=0
🟢 उत्तर: ② ΔH = q
📘 परीक्षा: JEE Main
📅 वर्ष: 2021 | पाली: सायंकाल
🔵 प्रश्न 43: एंट्रॉपी (S) की परिभाषा किसने दी थी?
🔴 ① क्लॉज़ियस
🟢 ② गिब्स
🟡 ③ हैस
🔵 ④ बॉयल
🟢 उत्तर: ① क्लॉज़ियस
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | पाली: सायंकाल
🔵 प्रश्न 44: ΔU किस प्रकार का फलन है?
🔴 ① पथ फलन
🟢 ② अवस्था फलन
🟡 ③ कोई नहीं
🔵 ④ केवल दबाव पर निर्भर
🟢 उत्तर: ② अवस्था फलन
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | पाली: सायंकाल
🔵 प्रश्न 45: यदि ΔH = −ve और ΔS = −ve है, तो प्रक्रिया कब स्वतःस्फूर्त होगी?
🔴 ① निम्न T पर
🟢 ② उच्च T पर
🟡 ③ सभी T पर
🔵 ④ कभी नहीं
🟢 उत्तर: ① निम्न T पर
📘 परीक्षा: JEE Main
📅 वर्ष: 2022 | पाली: प्रातःकाल
🔵 प्रश्न 46: एन्थैलपी (H) को किस प्रकार परिभाषित किया जाता है?
🔴 ① H = U − PV
🟢 ② H = U + PV
🟡 ③ H = U + TS
🔵 ④ H = U − TS
🟢 उत्तर: ② H = U + PV
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | पाली: सायंकाल
🔵 प्रश्न 47: ऊष्मागतिकी का द्वितीय नियम किस अवधारणा से सम्बद्ध है?
🔴 ① एंट्रॉपी
🟢 ② एन्थैलपी
🟡 ③ आंतरिक ऊर्जा
🔵 ④ मुक्त ऊर्जा
🟢 उत्तर: ① एंट्रॉपी
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | पाली: प्रातःकाल
🔵 प्रश्न 48: यदि ΔS = 0 हो, तो प्रक्रिया कैसी होगी?
🔴 ① प्रतिवर्ती
🟢 ② अप्रतिवर्ती
🟡 ③ स्वतःस्फूर्त
🔵 ④ अस्वतःस्फूर्त
🟢 उत्तर: ① प्रतिवर्ती
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | पाली: सायंकाल
🔵 प्रश्न 49: किसी अभिक्रिया के लिये ΔG = ΔH − TΔS. यदि ΔH=0 और ΔS > 0 हो, तो —
🔴 ① ΔG > 0
🟢 ② ΔG < 0
🟡 ③ ΔG = 0
🔵 ④ ΔG पर निर्भर नहीं
🟢 उत्तर: ② ΔG < 0
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | पाली: प्रातःकाल
🔵 प्रश्न 50: ऊष्मागतिकी का प्रथम नियम किस रूप में व्यक्त किया जाता है?
🔴 ① ΔU = q + w
🟢 ② ΔU = q − w
🟡 ③ ΔU = q
🔵 ④ ΔU = w
🟢 उत्तर: ① ΔU = q + w
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | पाली: प्रातःकाल
————————————————————————————————————————————————————————————————————————————
JEE ADVANCED पिछले सालों के प्रश्न
🧪 प्रश्न 1 से 25 (NEET-स्तर)
🔵 प्रश्न 1:
ऊष्मागतिकी किससे सम्बन्धित है?
🔴 ① दाब और आयतन का अध्ययन
🟢 ② ऊर्जा तथा उसके रूपांतरण का अध्ययन
🟡 ③ पदार्थों के वर्गीकरण का अध्ययन
🔵 ④ रासायनिक बन्धनों का अध्ययन
🟢 उत्तर: ② ऊर्जा तथा उसके रूपांतरण का अध्ययन
🎯 कठिनाई: NEET
🔵 प्रश्न 2:
सिस्टम और परिवेश का योग कहलाता है —
🔴 ① अवस्था
🟢 ② ब्रह्माण्ड
🟡 ③ ऊर्जा
🔵 ④ ऊष्मा
🟢 उत्तर: ② ब्रह्माण्ड
🎯 कठिनाई: NEET
🔵 प्रश्न 3:
ऊष्मागतिकी का प्रथम नियम किस सिद्धांत पर आधारित है?
🔴 ① द्रव्यमान संरक्षण
🟢 ② ऊर्जा संरक्षण
🟡 ③ आवेश संरक्षण
🔵 ④ दाब संरक्षण
🟢 उत्तर: ② ऊर्जा संरक्षण
🎯 कठिनाई: NEET
🔵 प्रश्न 4:
यदि किसी प्रणाली द्वारा ऊष्मा ग्रहण की जाती है और कार्य भी किया जाता है, तो ΔU = ?
🔴 ① Q + W
🟢 ② Q − W
🟡 ③ W − Q
🔵 ④ −(Q + W)
🟢 उत्तर: ② Q − W
🎯 कठिनाई: NEET
🔵 प्रश्न 5:
आदर्श गैस समीकरण PV = nRT में R का मान SI प्रणाली में —
🔴 ① 0.0821 L·atm·mol⁻¹·K⁻¹
🟢 ② 8.314 J·mol⁻¹·K⁻¹
🟡 ③ 1.987 cal·mol⁻¹·K⁻¹
🔵 ④ 273 J·mol⁻¹·K⁻¹
🟢 उत्तर: ② 8.314 J·mol⁻¹·K⁻¹
🎯 कठिनाई: NEET
🔵 प्रश्न 6:
कौन-सी मात्रा अवस्थागुण (State Function) है?
🔴 ① कार्य (W)
🟢 ② आंतरिक ऊर्जा (U)
🟡 ③ ऊष्मा (Q)
🔵 ④ पथ (Path)
🟢 उत्तर: ② आंतरिक ऊर्जा (U)
🎯 कठिनाई: NEET
🔵 प्रश्न 7:
किस प्रक्रिया में ΔU = 0 होता है?
🔴 ① ऐडियाबैटिक
🟢 ② समतापीय
🟡 ③ समदाब
🔵 ④ समआयतन
🟢 उत्तर: ② समतापीय
🎯 कठिनाई: NEET
🔵 प्रश्न 8:
किस प्रक्रिया में Q = 0 होता है?
🔴 ① ऐडियाबैटिक
🟢 ② समतापीय
🟡 ③ समदाब
🔵 ④ समआयतन
🟢 उत्तर: ① ऐडियाबैटिक
🎯 कठिनाई: NEET
🔵 प्रश्न 9:
यदि किसी प्रक्रिया में दाब नियत है, तो उसे क्या कहते हैं?
🔴 ① समतापीय
🟢 ② समदाबीय
🟡 ③ समआयतन
🔵 ④ ऐडियाबैटिक
🟢 उत्तर: ② समदाबीय
🎯 कठिनाई: NEET
🔵 प्रश्न 10:
किसी प्रक्रिया में ताप नियत है, तो कार्य का सूत्र क्या होगा?
🔴 ① W = PΔV
🟢 ② W = nRT ln(V₂/V₁)
🟡 ③ W = ΔU
🔵 ④ W = 0
🟢 उत्तर: ② W = nRT ln(V₂/V₁)
🎯 कठिनाई: NEET
🔵 प्रश्न 11:
समआयतन प्रक्रिया में कार्य का मान होता है —
🔴 ① 0
🟢 ② PV
🟡 ③ nRT ln(V₂/V₁)
🔵 ④ Q
🟢 उत्तर: ① 0
🎯 कठिनाई: NEET
🔵 प्रश्न 12:
एन्थैल्पी (H) का संबंध आंतरिक ऊर्जा से —
🔴 ① H = U + PV
🟢 ② H = U − PV
🟡 ③ H = Q − W
🔵 ④ H = PV − U
🟢 उत्तर: ① H = U + PV
🎯 कठिनाई: NEET
🔵 प्रश्न 13:
एक्सोथर्मिक अभिक्रिया में ΔH का चिन्ह क्या होगा?
🔴 ① धनात्मक
🟢 ② ऋणात्मक
🟡 ③ शून्य
🔵 ④ कोई नहीं
🟢 उत्तर: ② ऋणात्मक
🎯 कठिनाई: NEET
🔵 प्रश्न 14:
एंडोथर्मिक अभिक्रिया में ऊर्जा —
🔴 ① उत्पन्न होती है
🟢 ② अवशोषित होती है
🟡 ③ स्थिर रहती है
🔵 ④ समाप्त होती है
🟢 उत्तर: ② अवशोषित होती है
🎯 कठिनाई: NEET
🔵 प्रश्न 15:
आदर्श गैस के लिए आंतरिक ऊर्जा केवल किस पर निर्भर करती है?
🔴 ① दाब
🟢 ② तापमान
🟡 ③ आयतन
🔵 ④ पदार्थ की मात्रा
🟢 उत्तर: ② तापमान
🎯 कठिनाई: NEET
🔵 प्रश्न 16:
हेस का नियम किसके लिए लागू होता है?
🔴 ① दाब
🟢 ② एन्थैल्पी
🟡 ③ तापमान
🔵 ④ घनत्व
🟢 उत्तर: ② एन्थैल्पी
🎯 कठिनाई: NEET
🔵 प्रश्न 17:
यदि ΔH = −Q है, तो अभिक्रिया —
🔴 ① ऊष्माशोषी
🟢 ② ऊष्मा उत्सर्जक
🟡 ③ कोई नहीं
🔵 ④ शून्य
🟢 उत्तर: ② ऊष्मा उत्सर्जक
🎯 कठिनाई: NEET
🔵 प्रश्न 18:
कार्य का मान ऋणात्मक कब माना जाता है?
🔴 ① जब गैस कार्य करती है
🟢 ② जब कार्य गैस पर किया जाता है
🟡 ③ जब ऊष्मा दी जाती है
🔵 ④ जब तापमान बढ़ता है
🟢 उत्तर: ② जब कार्य गैस पर किया जाता है
🎯 कठिनाई: NEET
🔵 प्रश्न 19:
ऊष्मागतिकी का दूसरा नियम किसे बताता है?
🔴 ① ऊर्जा संरक्षण
🟢 ② एंट्रॉपी की वृद्धि
🟡 ③ द्रव्यमान संरक्षण
🔵 ④ रासायनिक ऊर्जा
🟢 उत्तर: ② एंट्रॉपी की वृद्धि
🎯 कठिनाई: NEET
🔵 प्रश्न 20:
एंट्रॉपी (S) की SI इकाई क्या है?
🔴 ① J
🟢 ② J·mol⁻¹·K⁻¹
🟡 ③ kJ
🔵 ④ cal
🟢 उत्तर: ② J·mol⁻¹·K⁻¹
🎯 कठिनाई: NEET
🔵 प्रश्न 21:
स्वतःस्फूर्त अभिक्रिया के लिए ΔG का मान —
🔴 ① धनात्मक
🟢 ② ऋणात्मक
🟡 ③ शून्य
🔵 ④ कोई नहीं
🟢 उत्तर: ② ऋणात्मक
🎯 कठिनाई: NEET
🔵 प्रश्न 22:
ΔG = ΔH − TΔS में यदि ΔH ऋणात्मक और ΔS धनात्मक हो, तो अभिक्रिया —
🔴 ① सदैव स्वतःस्फूर्त
🟢 ② सदैव अस्वतःस्फूर्त
🟡 ③ ताप पर निर्भर
🔵 ④ कोई नहीं
🟢 उत्तर: ① सदैव स्वतःस्फूर्त
🎯 कठिनाई: NEET
🔵 प्रश्न 23:
1 L = ? J के बराबर होता है (कार्य के लिए)
🔴 ① 100 J
🟢 ② 101.3 J
🟡 ③ 1 J
🔵 ④ 273 J
🟢 उत्तर: ② 101.3 J
🎯 कठिनाई: NEET
🔵 प्रश्न 24:
यदि किसी प्रणाली की ऊर्जा बढ़ती है, तो ΔU —
🔴 ① ऋणात्मक
🟢 ② धनात्मक
🟡 ③ शून्य
🔵 ④ कोई नहीं
🟢 उत्तर: ② धनात्मक
🎯 कठिनाई: NEET
🔵 प्रश्न 25:
किस प्रक्रिया में न तो ऊष्मा का आदान-प्रदान होता है न कार्य किया जाता है?
🔴 ① पृथक (Isolated) प्रणाली
🟢 ② बंद प्रणाली
🟡 ③ खुली प्रणाली
🔵 ④ स्थिर प्रणाली
🟢 उत्तर: ① पृथक (Isolated) प्रणाली
🎯 कठिनाई: NEET
⚙ प्रश्न 26 से 40 (JEE Main-स्तर
🔵 प्रश्न 26:
एक समतापीय प्रसार में गैस द्वारा किया गया कार्य —
🔴 ① W = nRT ln(V₂/V₁)
🟢 ② W = PΔV
🟡 ③ W = ΔU
🔵 ④ W = 0
🟢 उत्तर: ① W = nRT ln(V₂/V₁)
🎯 कठिनाई: JEE Main
🔵 प्रश्न 27:
एन्थैल्पी परिवर्तन (ΔH) और आंतरिक ऊर्जा परिवर्तन (ΔU) के बीच संबंध —
🔴 ① ΔH = ΔU + ΔnRT
🟢 ② ΔH = ΔU − ΔnRT
🟡 ③ ΔH = ΔU
🔵 ④ ΔH = Q − W
🟢 उत्तर: ① ΔH = ΔU + ΔnRT
🎯 कठिनाई: JEE Main
🔵 प्रश्न 28:
1 मोल आदर्श गैस का ऐडियाबैटिक प्रसार करते समय कार्य का सूत्र —
🔴 ① W = (P₁V₁ − P₂V₂)/(γ − 1)
🟢 ② W = nR(T₁ − T₂)/(γ − 1)
🟡 ③ W = PΔV
🔵 ④ W = Q
🟢 उत्तर: ② W = nR(T₁ − T₂)/(γ − 1)
🎯 कठिनाई: JEE Main
🔵 प्रश्न 29:
किस प्रक्रिया में तापमान स्थिर रहता है?
🔴 ① समतापीय
🟢 ② समदाबीय
🟡 ③ समआयतन
🔵 ④ ऐडियाबैटिक
🟢 उत्तर: ① समतापीय
🎯 कठिनाई: JEE Main
🔵 प्रश्न 30:
एन्थैल्पी किस प्रकार का गुण है?
🔴 ① पथ गुण
🟢 ② अवस्था गुण
🟡 ③ चर गुण
🔵 ④ असतत गुण
🟢 उत्तर: ② अवस्था गुण
🎯 कठिनाई: JEE Main
🔵 प्रश्न 31:
किस स्थिति में ΔH और ΔU समान होंगे?
🔴 ① जब Δn = 0
🟢 ② जब Δn = 1
🟡 ③ जब दाब नियत न हो
🔵 ④ कोई नहीं
🟢 उत्तर: ① जब Δn = 0
🎯 कठिनाई: JEE Main
🔵 प्रश्न 32:
एन्थैल्पी परिवर्तन धनात्मक होने का अर्थ —
🔴 ① ऊष्मा उत्सर्जन
🟢 ② ऊष्मा अवशोषण
🟡 ③ कोई परिवर्तन नहीं
🔵 ④ कार्य शून्य
🟢 उत्तर: ② ऊष्मा अवशोषण
🎯 कठिनाई: JEE Main
🔵 प्रश्न 33:
आदर्श गैस के लिए Cₚ − Cᵥ = ?
🔴 ① R
🟢 ② 2R
🟡 ③ R/2
🔵 ④ 0
🟢 उत्तर: ① R
🎯 कठिनाई: JEE Main
🔵 प्रश्न 34:
एक मोल आदर्श गैस के लिए आंतरिक ऊर्जा परिवर्तन ΔU = nCᵥΔT है। यदि Cᵥ = (3/2)R हो, तो ΔU = ?
🔴 ① (3/2)nRΔT
🟢 ② (5/2)nRΔT
🟡 ③ (7/2)nRΔT
🔵 ④ nRΔT
🟢 उत्तर: ① (3/2)nRΔT
🎯 कठिनाई: JEE Main
🔵 प्रश्न 35:
एक आदर्श गैस के लिए कार्य अधिकतम कब होगा?
🔴 ① समदाबीय
🟢 ② समतापीय
🟡 ③ समआयतन
🔵 ④ ऐडियाबैटिक
🟢 उत्तर: ② समतापीय
🎯 कठिनाई: JEE Main
🔵 प्रश्न 36:
एंट्रॉपी का प्रतीक क्या है?
🔴 ① U
🟢 ② S
🟡 ③ H
🔵 ④ G
🟢 उत्तर: ② S
🎯 कठिनाई: JEE Main
🔵 प्रश्न 37:
यदि किसी अभिक्रिया में ΔH = −200 kJ/mol और ΔS = −50 J·mol⁻¹·K⁻¹ है, तो 298 K पर ΔG होगा —
🔴 ① −185 kJ
🟢 ② −185.1 kJ
🟡 ③ +185 kJ
🔵 ④ +200 kJ
🟢 उत्तर: ② −185.1 kJ
🎯 कठिनाई: JEE Main
🔵 प्रश्न 38:
गिब्स ऊर्जा समीकरण ΔG = ΔH − TΔS में यदि ΔG = 0 हो, तो प्रणाली —
🔴 ① स्वतःस्फूर्त
🟢 ② साम्यावस्था में
🟡 ③ अस्वतःस्फूर्त
🔵 ④ ऊष्माशोषी
🟢 उत्तर: ② साम्यावस्था में
🎯 कठिनाई: JEE Main
🔵 प्रश्न 39:
ऊष्मागतिकी का तीसरा नियम बताता है —
🔴 ① 0 K पर एंट्रॉपी न्यूनतम होती है
🟢 ② 0 K पर एंट्रॉपी शून्य होती है
🟡 ③ 0 K पर ऊर्जा अधिकतम
🔵 ④ 0 K पर ऊष्मा शून्य
🟢 उत्तर: ② 0 K पर एंट्रॉपी शून्य होती है
🎯 कठिनाई: JEE Main
🔵 प्रश्न 40:
यदि किसी प्रणाली में ΔS > 0 और ΔH < 0 हो, तो अभिक्रिया —
🔴 ① अस्वतःस्फूर्त
🟢 ② स्वतःस्फूर्त
🟡 ③ साम्यावस्था
🔵 ④ ऊष्माशोषी
🟢 उत्तर: ② स्वतःस्फूर्त
🎯 कठिनाई: JEE Main
🚀 प्रश्न 41 से 50 (JEE Advanced-स्तर)
🔵 प्रश्न 41:
1 मोल आदर्श गैस का ऐडियाबैटिक प्रसार 300 K से 200 K तक होता है (γ = 1.4)। कार्य का मान होगा —
🔴 ① 2496 J
🟢 ② 1780 J
🟡 ③ 3560 J
🔵 ④ 4980 J
🟢 उत्तर: ② 1780 J
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 42:
यदि ΔH = 0 और ΔS = −10 J·mol⁻¹·K⁻¹ है, तो 300 K पर ΔG का मान —
🔴 ① +3 kJ
🟢 ② −3 kJ
🟡 ③ 0
🔵 ④ +30 kJ
🟢 उत्तर: ① +3 kJ (अस्वतःस्फूर्त)
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 43:
किसी प्रक्रिया में ΔH = 20 kJ/mol और ΔS = 100 J·mol⁻¹·K⁻¹ है। यह स्वतःस्फूर्त कब होगी?
🔴 ① T < 200 K 🟢 ② T > 200 K
🟡 ③ T = 200 K
🔵 ④ सभी ताप पर
🟢 उत्तर: ② T > 200 K
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 44:
एक गैस के लिए Cₚ/Cᵥ = 1.67 है। यह गैस कौन-सी हो सकती है?
🔴 ① द्विपरमाणुक
🟢 ② एकपरमाणुक
🟡 ③ त्रिपरमाणुक
🔵 ④ कोई नहीं
🟢 उत्तर: ② एकपरमाणुक
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 45:
ऐडियाबैटिक समीकरण का रूप होता है —
🔴 ① PV = constant
🟢 ② PV^γ = constant
🟡 ③ P/T = constant
🔵 ④ V/T = constant
🟢 उत्तर: ② PV^γ = constant
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 46:
यदि किसी प्रणाली के लिए ΔH धनात्मक और ΔS ऋणात्मक हो, तो अभिक्रिया —
🔴 ① सदैव स्वतःस्फूर्त
🟢 ② सदैव अस्वतःस्फूर्त
🟡 ③ उच्च ताप पर स्वतःस्फूर्त
🔵 ④ निम्न ताप पर स्वतःस्फूर्त
🟢 उत्तर: ② सदैव अस्वतःस्फूर्त
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 47:
किसी आदर्श गैस के ऐडियाबैटिक प्रसार में तापमान घटने का कारण —
🔴 ① गैस का घनत्व बढ़ना
🟢 ② गैस द्वारा कार्य करना
🟡 ③ ऊष्मा का ग्रहण
🔵 ④ दाब बढ़ना
🟢 उत्तर: ② गैस द्वारा कार्य करना
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 48:
एंट्रॉपी परिवर्तन का सामान्य सूत्र क्या है?
🔴 ① ΔS = ΔH/T
🟢 ② ΔS = q_rev/T
🟡 ③ ΔS = T/ΔH
🔵 ④ ΔS = W/T
🟢 उत्तर: ② ΔS = q_rev/T
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 49:
यदि किसी अभिक्रिया में ΔH = 50 kJ/mol और ΔS = 200 J·mol⁻¹·K⁻¹ है, तो वह स्वतःस्फूर्त कब होगी?
🔴 ① T > 250 K
🟢 ② T < 250 K 🟡 ③ T = 250 K 🔵 ④ सभी ताप पर 🟢 उत्तर: ① T > 250 K
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 50:
क्लॉसियस कथन ऊष्मागतिकी के किस नियम से सम्बंधित है?
🔴 ① प्रथम
🟢 ② द्वितीय
🟡 ③ तृतीय
🔵 ④ शून्यवाँ
🟢 उत्तर: ② द्वितीय
🎯 कठिनाई: JEE Advanced
————————————————————————————————————————————————————————————————————————————
