Class 12 : Chemistry (Hindi) – Lesson 2. वैद्युत रसायन
पाठ का विश्लेषण एवं विवेचन
🔵 प्रस्तावना: विद्युत रसायन का परिचय
विद्युत रसायन वह शाखा है जो रासायनिक अभिक्रियाओं और विद्युत ऊर्जा के बीच संबंध का अध्ययन करती है। यह अध्याय दो प्रमुख विषयों को समझाता है:
➡️ वे रासायनिक अभिक्रियाएँ जो विद्युत ऊर्जा उत्पन्न करती हैं (जैसे वोल्टाइक कोश)
➡️ वे अभिक्रियाएँ जिनमें विद्युत ऊर्जा प्रयोग कर रासायनिक परिवर्तन कराए जाते हैं (जैसे इलेक्ट्रोलिसिस)
✏️ नोट: विद्युत रसायन जीवन, उद्योग और विज्ञान में अत्यंत महत्वपूर्ण भूमिका निभाता है।
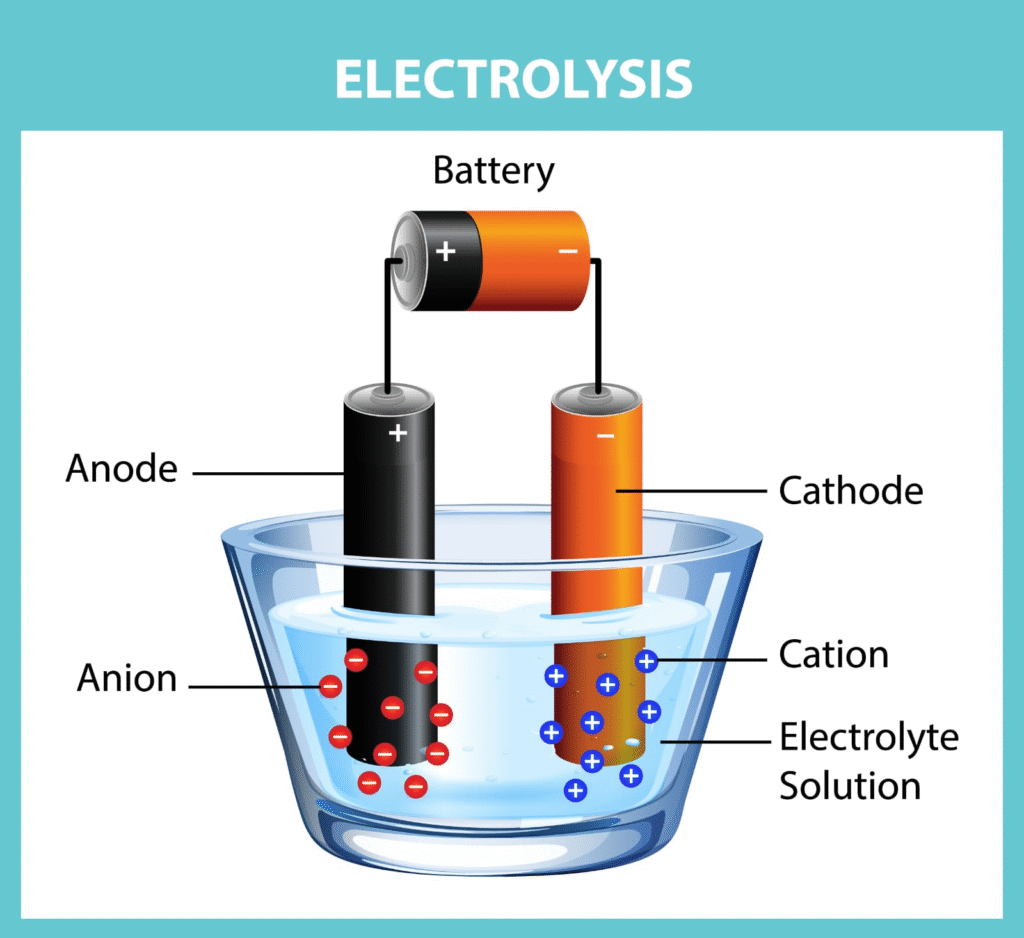
🟢 1. ऑक्सीकरण तथा अपचयन
🌿 ऑक्सीकरण – वह प्रक्रिया जिसमें किसी पदार्थ से इलेक्ट्रॉन निकलते हैं।
🌿 अपचयन – वह प्रक्रिया जिसमें किसी पदार्थ को इलेक्ट्रॉन प्राप्त होते हैं।
🧠 इस अध्याय में इलेक्ट्रॉनों का प्रवाह ही विद्युत धारा के रूप में प्रकट होता है।
✔️ कुल मिलाकर, यदि एक पदार्थ इलेक्ट्रॉन खोता है तो वह ऑक्सीकरण करता है, और यदि कोई इलेक्ट्रॉन प्राप्त करता है तो वह अपचयन करता है।
🟡 2. गैल्वैनिक कोश (वोल्टाइक कोश)
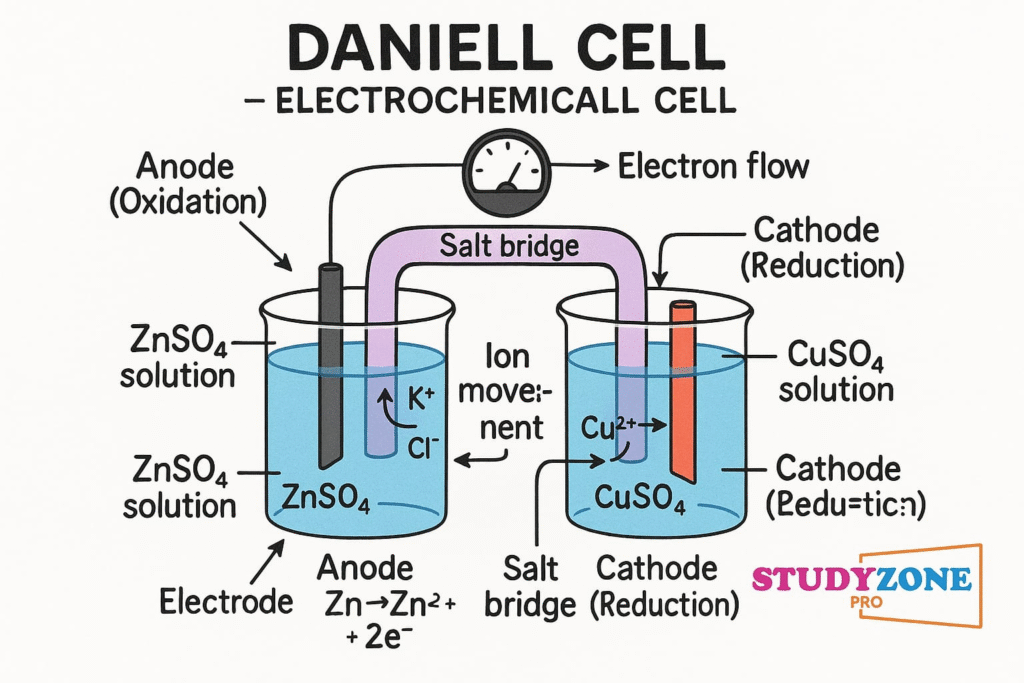
गैल्वैनिक कोश वह यंत्र है जिसमें रासायनिक ऊर्जा को विद्युत ऊर्जा में बदला जाता है। इसमें एक ऑक्सीकरण आधाकोश और एक अपचयन आधाकोश होता है।
⚡ मुख्य घटक:
✔️ दो अर्धकोश – एक ऑक्सीकरण हेतु (धनाग्र) और एक अपचयन हेतु (ऋणाग्र)
✔️ लवण पुल या झिल्लीनुमा सेतुपथ
✔️ बाह्य परिपथ में इलेक्ट्रॉन प्रवाह
💡 उदाहरण: दानियल कोश – इसमें जस्ता और ताँबा के इलेक्ट्रोड प्रयुक्त होते हैं।
🔴 3. कोश विभव (कोश विभव)
कोश विभव (Eᶜᵉˡˡ) वह विभव है जो दो अर्धकोशों के बीच की क्षमता का अंतर दर्शाता है। यह कोश की कार्य करने की क्षमता का संकेतक है।
🧠 सूत्र:
Eᶜᵉˡˡ = Eऋणाग्र – Eधनाग्र
✏️ नोट: कोश विभव का मान जितना अधिक, कोश की कार्यक्षमता उतनी अधिक।
🟢 4. मानक इलेक्ट्रोड विभव
मानक इलेक्ट्रोड विभव किसी अर्धकोश का वह विभव होता है जब उसे मानक स्थितियों (1 मोल सांद्रता, 1 वायुमंडलीय दाब, 298 K) पर मापा जाए।
✔️ मानक हाइड्रोजन इलेक्ट्रोड (SHE) को शून्य वोल्ट पर माना गया है। इससे अन्य अर्धकोशों की तुलना की जाती है।
💡 कार्य: विभिन्न अर्धकोशों की अभिक्रियात्मक प्रवृत्ति मापना।
🟡 5. विद्युत रासायनिक श्रेणी
विद्युत रासायनिक श्रेणी एक ऐसा क्रम है जिसमें तत्वों को उनके मानक इलेक्ट्रोड विभव के अनुसार क्रमबद्ध किया जाता है।
✔️ जिन तत्वों का मान ऋणात्मक होता है, वे ऑक्सीकरण प्रवृत्ति में अधिक होते हैं।
✔️ जिनका मान धनात्मक होता है, वे अपचयन में अधिक प्रवृत्त होते हैं।
🧠 यह श्रेणी यह निर्धारित करने में सहायक होती है कि कौन-सी धातु किसी अन्य धातु को वियोजित कर सकती है।
🔴 6. गिब्स मुक्त ऊर्जा एवं कोश विभव
गिब्स मुक्त ऊर्जा परिवर्तन (ΔG) और कोश विभव (Eᶜᵉˡˡ) में सीधा संबंध होता है।
🧠 सूत्र:
ΔG = -nFEᶜᵉˡˡ
जहाँ,
n = स्थानांतरित इलेक्ट्रॉनों की संख्या
F = फैराडे नियतांक
Eᶜᵉˡˡ = कोश विभव
✏️ नोट: यदि ΔG ऋणात्मक है, तो कोश स्वयंस्फूर्त रूप से कार्य करता है।
🟢 7. नेर्न्स्ट समीकरण
नेर्न्स्ट समीकरण उस स्थिति में कोश विभव का मान बताता है जब अभिक्रियाएँ मानक स्थितियों में न हों।
⚡ नेर्न्स्ट समीकरण:
E = E° – (0.0591/n) log [उत्पादों की सांद्रता / अभिकारकों की सांद्रता]
💡 अनुप्रयोग: सेल की गतिविधि विभिन्न परिस्थितियों में समझने में सहायक।
🟡 8. बैटरियाँ
बैटरियाँ एक या एक से अधिक गैल्वैनिक कोशों से बनी होती हैं जो विद्युत ऊर्जा प्रदान करती हैं।
✔️ प्राथमिक बैटरियाँ: एक बार प्रयोग के बाद फेंकी जाती हैं (जैसे – शुष्क कोश)
✔️ द्वितीयक बैटरियाँ: पुनः आवेशित की जा सकती हैं (जैसे – लेड-सल्फ्यूरिक बैटरी)
🧠 वर्तमान अनुप्रयोग: मोबाइल, लैपटॉप, वाहनों में उपयोग।
🔴 9. ईंधन कोश
ईंधन कोश ऐसी बैटरियाँ हैं जहाँ ईंधन (जैसे – हाइड्रोजन) और ऑक्सीकारक (जैसे – ऑक्सीजन) की निरंतर आपूर्ति से विद्युत ऊर्जा प्राप्त होती है।
✔️ ये पर्यावरणीय रूप से अनुकूल होती हैं क्योंकि अपशिष्ट उत्पाद केवल जल होता है।
✏️ नोट: अंतरिक्ष यानों में हाइड्रोजन-ऑक्सीजन ईंधन कोश का प्रयोग होता है।
🟢 10. विद्युत अपघटन (इलेक्ट्रोलिसिस)
विद्युत अपघटन वह प्रक्रिया है जिसमें विद्युत धारा द्वारा रासायनिक परिवर्तन कराए जाते हैं।
🧠 उदाहरण:
➡️ जल का अपघटन – H₂O → H₂ + O₂
➡️ NaCl का अपघटन – NaCl → Na + Cl₂
💡 अनुप्रयोग: विद्युत आसंजन, शुद्धिकरण, विद्युतलेपन।
🟡 11. फैराडे के विद्युत अपघटन के नियम
फैराडे के नियम बताते हैं कि विद्युत प्रवाह से अपचयित पदार्थ की मात्रा कितनी होगी।
1️⃣ पहला नियम:
वियोजित पदार्थ की मात्रा विद्युत आवेश के समानुपाती होती है।
2️⃣ दूसरा नियम:
विभिन्न पदार्थों के लिए बराबर आवेश पर वियोजन की मात्रा उनके रासायनिक तुल्य भार के समानुपाती होती है।
🧠 सूत्र:
W = ZIt
जहाँ,
W = वियोजित पदार्थ का भार
Z = विद्युत रासायनिक तुल्यांक
I = धारा
t = समय
🔴 12. विद्युत रासायनिक कोश में अर्धकोश अभिक्रियाएँ
हर गैल्वैनिक कोश में दो आधाकोश होते हैं जिनमें एक ऑक्सीकरण और दूसरा अपचयन करता है।
✔️ इलेक्ट्रोड की प्रकृति और सांद्रता यह निर्धारित करती है कि इलेक्ट्रॉन कहाँ से कहाँ बहेंगे।
💡 नियम: इलेक्ट्रॉन सदा ऑक्सीकरण आधाकोश से अपचयन आधाकोश की ओर जाते हैं।
🌟 यह अध्याय क्यों महत्वपूर्ण है? 🌟
(📦 Why This Lesson Matters Box)
➡️ बैटरियाँ, ईंधन कोश और इलेक्ट्रोलिसिस जैसे विषय विज्ञान, ऊर्जा और जीवन की रीढ़ हैं।
➡️ विद्युत रसायन का ज्ञान हमारी ऊर्जा आवश्यकताओं की दिशा में नवाचार की कुंजी है।
📝 Quick Recap: (स्मृति-पुनरावलोकन)
🔵 ऑक्सीकरण = इलेक्ट्रॉन हानि
🟢 अपचयन = इलेक्ट्रॉन प्राप्ति
🟡 गैल्वैनिक कोश = रासायनिक ऊर्जा ➡️ विद्युत ऊर्जा
🔴 Eᶜᵉˡˡ = Eऋणाग्र – Eधनाग्र
🟢 ΔG = -nFEᶜᵉˡˡ
🟡 नेर्न्स्ट समीकरण = कोश विभव व सांद्रता का संबंध
🔴 बैटरियाँ = प्राथमिक और द्वितीयक
🟢 ईंधन कोश = हाइड्रोजन-ऑक्सीजन, पर्यावरण के अनुकूल
🟡 विद्युत अपघटन = धारा द्वारा रासायनिक परिवर्तन
🔴 फैराडे नियम = विद्युत से उत्पन्न पदार्थ की गणना
🔻 सारांश (Summary in ~300 Words) 🔻
🔹 विद्युत रसायन रसायन विज्ञान की वह शाखा है जो रासायनिक और विद्युत ऊर्जा के संबंध को समझाती है। यह अध्याय दो प्रमुख भागों पर केंद्रित है – गैल्वैनिक कोश और विद्युत अपघटन।
🔸 ऑक्सीकरण और अपचयन की मूल अवधारणाओं से प्रारंभ होकर यह अध्याय कोश विभव, मानक इलेक्ट्रोड विभव, विद्युत रासायनिक श्रेणी की व्याख्या करता है।
🔹 गैल्वैनिक कोश, जैसे दानियल कोश, विद्युत ऊर्जा उत्पन्न करते हैं। कोश विभव का मान गिब्स मुक्त ऊर्जा से संबंधित होता है, और नेर्न्स्ट समीकरण से विभिन्न परिस्थितियों में विभव की गणना की जाती है।
🔸 बैटरियाँ विद्युत ऊर्जा का व्यावहारिक स्रोत हैं – जिनमें प्राथमिक, द्वितीयक और ईंधन कोश शामिल हैं। ये हमारे दैनिक जीवन में अत्यधिक उपयोगी हैं।
🔹 विद्युत अपघटन, जैसे जल या NaCl का अपघटन, रसायनिक परिवर्तन में प्रयोग होता है। फैराडे के नियमों से अपचयन की मात्रा ज्ञात की जाती है।
यह अध्याय विद्युत ऊर्जा के स्रोतों, विज्ञान की उन्नति, तथा तकनीकी विकास को समझने का मार्ग प्रशस्त करता है। यह दैनिक जीवन, उद्योग, तथा पर्यावरण संरक्षण से गहरे स्तर पर जुड़ा हुआ है।
————————————————————————————————————————————————————————————————————————————
पाठ्यपुस्तक के प्रश्न
प्रश्न 3.1
विद्युत अपघटन तथा गैल्वैनिक सेल में विद्युत ऊर्जा के उत्पादन तथा उपयोग में क्या अंतर है?
उत्तर:
गैल्वैनिक सेल में रासायनिक ऊर्जा को विद्युत ऊर्जा में बदला जाता है जबकि विद्युत अपघटन में विद्युत ऊर्जा को रासायनिक ऊर्जा में बदला जाता है।
गैल्वैनिक सेल में अभिक्रिया स्वतः होती है, जबकि विद्युत अपघटन में अभिक्रिया को बाह्य स्रोत द्वारा प्रेरित किया जाता है।
गैल्वैनिक सेल में धनाग्र पर अपचयन तथा ऋणाग्र पर ऑक्सीकरण होता है, जबकि विद्युत अपघटन में धनाग्र पर ऑक्सीकरण तथा ऋणाग्र पर अपचयन होता है।
प्रश्न 3.2
एक इलेक्ट्रोलाइट विलयन की चालकता तथा मोल चालकता में क्या अंतर होता है?
उत्तर:
चालकता (κ): यह दर्शाती है कि एक घन मीटर आयतन में इलेक्ट्रोलाइट कितना विद्युत प्रवाह कर सकता है। इसकी इकाई S·m⁻¹ होती है।
मोल चालकता (Λm): यह दर्शाती है कि एक मोल इलेक्ट्रोलाइट द्वारा उत्पन्न सभी आयन कितनी विद्युत प्रवाहित कर सकते हैं।
Λm = κ × (1000 / C)
जहाँ C = मोल प्रति लीटर में सांद्रता
प्रश्न 3.3
फैराडे के द्वितीय नियम का कथन कीजिए।
उत्तर:
फैराडे का द्वितीय नियम कहता है कि यदि एक ही विद्युत आवेश विभिन्न इलेक्ट्रोलाइटों पर प्रवाहित किया जाए, तो इलेक्ट्रोड पर जमने वाले विभिन्न तत्वों का द्रव्यमान उनके रासायनिक तुल्यांक के अनुपात में होता है।
गणितीय रूप:
m₁ / m₂ = E₁ / E₂
जहाँ E = रासायनिक तुल्यांक
प्रश्न 3.4
Cu²⁺ + 2e⁻ → Cu, इस अभिक्रिया के लिए नर्न्स्ट समीकरण लिखिए।
उत्तर:
नर्न्स्ट समीकरण:
E = E° – (0.0591 / n) × log(1 / [Cu²⁺])
⇒ E = E° + (0.0591 / 2) × log[Cu²⁺]
यहाँ n = 2 है, Cu²⁺ आयन की सांद्रता पर विभव निर्भर करता है।
प्रश्न 3.5
विद्युत रासायनिक श्रृंखला में निम्नलिखित में से कौन-सा युग्म सबसे शक्तिशाली अपचायक है?
(A) Fe²⁺/Fe
(B) I₂/I⁻
(C) Cu²⁺/Cu
(D) Ag⁺/Ag
उत्तर:
(A) Fe²⁺/Fe
क्योंकि इस युग्म की मानक अपचयन विभवता सबसे अधिक ऋणात्मक होती है, जिससे यह सबसे शक्तिशाली अपचायक होता है।
प्रश्न 3.6
फैराडे का द्वितीय नियम कैसे यह दर्शाता है कि विद्युत अपघटन के दौरान विभिन्न पदार्थों के जमाव का अनुपात उनके रासायनिक तुल्यांक के अनुपात में होता है?
उत्तर:
फैराडे के द्वितीय नियम के अनुसार:
यदि समान विद्युत आवेश (Q) विभिन्न इलेक्ट्रोलाइटों से प्रवाहित किया जाए, तो
m ∝ E (रासायनिक तुल्यांक)
⇒ m₁ / m₂ = E₁ / E₂
इस प्रकार यह सिद्ध होता है कि जमने वाले पदार्थों का अनुपात उनके रासायनिक तुल्यांक के अनुपात में होता है।
प्रश्न 3.7
फैराडे के नियमों का प्रयोग करके यह प्रदर्शित कीजिए कि 1 फा. विद्युत आवेश द्वारा 1 मोल एक संयोजक के कितने ग्राम तत्व जमा होंगे।
उत्तर:
फैराडे के प्रथम नियम के अनुसार:
m = (E × Q) / F
Q = F (1 फा. = 96500 C)
⇒ m = E
जहाँ E = रासायनिक तुल्यांक = परमाणु द्रव्यमान / n
⇒ इस प्रकार, 1 फा. विद्युत द्वारा 1 मोल n संयोजक के लिए E ग्राम तत्व जमा होंगे।
प्रश्न 3.8
यदि सेल अभिक्रिया Zn + Cu²⁺ → Zn²⁺ + Cu के लिए Zn²⁺ और Cu²⁺ की सांद्रता क्रमशः 0.1 M और 0.01 M हो, तो EMF ज्ञात कीजिए।
मानक विभव Zn²⁺/Zn = –0.76 V और Cu²⁺/Cu = +0.34 V है।
(T = 298 K पर)
उत्तर:
Ecell = E°cell – (0.0591 / n) × log([Zn²⁺] / [Cu²⁺])
E°cell = 0.34 – (–0.76) = 1.10 V
n = 2
E = 1.10 – (0.0591 / 2) × log(0.1 / 0.01)
= 1.10 – 0.02955 × log(10)
= 1.10 – 0.02955 × 1 = 1.070 V
प्रश्न 3.9
Zn + Cu²⁺ → Zn²⁺ + Cu की सेल अभिक्रिया के लिए ΔG° ज्ञात कीजिए।
E°cell = 1.10 V
n = 2, F = 96500 C/mol
उत्तर:
ΔG° = –nFE°
= –2 × 96500 × 1.10
= –212300 J
= –212.3 kJ
प्रश्न 3.10
एक गैल्वैनिक सेल में ऋणाग्र और धनाग्र को परिभाषित कीजिए। साथ ही यह दर्शाइए कि वहाँ क्या अभिक्रिया होती है।
उत्तर:
ऋणाग्र (एनोड): वह इलेक्ट्रोड जहाँ ऑक्सीकरण होता है; यह नकारात्मक होता है।
धनाग्र (कैथोड): वह इलेक्ट्रोड जहाँ अपचयन होता है; यह सकारात्मक होता है।
उदाहरण: Zn | Zn²⁺ || Cu²⁺ | Cu
Zn पर ऑक्सीकरण: Zn → Zn²⁺ + 2e⁻
Cu²⁺ पर अपचयन: Cu²⁺ + 2e⁻ → Cu
प्रश्न 3.11
किसी सेल में EMF और ΔG के बीच क्या संबंध है?
उत्तर:
ΔG = –nFE
जहाँ,
ΔG = गिब्स ऊर्जा परिवर्तन (J)
n = स्थानांतरित इलेक्ट्रॉनों की संख्या
F = फैराडे नियतांक (96500 C/mol)
E = सेल विभव (V)
यदि E > 0 ⇒ ΔG < 0 ⇒ अभिक्रिया स्वतः होती है।
प्रश्न 3.12
सामान्य तापमान (298 K) पर एक सेल का EMF 0.59 V है, n = 2 है। इस सेल के लिए K (संतुलन नियतांक) ज्ञात कीजिए।
उत्तर:
E° = (0.0591 / n) × log K
0.59 = (0.0591 / 2) × log K
⇒ log K = (0.59 × 2) / 0.0591 ≈ 19.96
⇒ K = 10^19.96 ≈ 9.12 × 10¹⁹
प्रश्न 3.13
विद्युत अपघटन और गैल्वैनिक सेल में विद्युत प्रवाह की दिशा में क्या अंतर होता है?
उत्तर:
गैल्वैनिक सेल में विद्युत धारा ऋणाग्र से धनाग्र की ओर बहती है (स्वतः अभिक्रिया), जबकि विद्युत अपघटन में बाह्य विद्युत स्रोत द्वारा धारा प्रवाहित करवाई जाती है और धारा धनाग्र से ऋणाग्र की ओर जाती है (बाह्य रूप से प्रेरित अभिक्रिया)।
प्रश्न 3.14
विद्युत चालकता और मोल चालकता में तापमान का क्या प्रभाव होता है?
उत्तर:
तापमान बढ़ने से:
विद्युत चालकता (κ) बढ़ती है क्योंकि आयनों की गतिशीलता और आयनीकरण की डिग्री बढ़ती है।
मोल चालकता (Λm) भी पतले विलयनों में विशेषकर अधिक बढ़ती है क्योंकि आयन मुक्त होकर अधिक प्रभावी ढंग से विद्युत धारा प्रवाहित करते हैं।
प्रश्न 3.15
मोल चालकता और सांद्रता के बीच संबंध को समझाइए।
उत्तर:
शक्तिशाली इलेक्ट्रोलाइट: मोल चालकता के मान में थोड़ी वृद्धि होती है जब सांद्रता घटती है।
दुर्बल इलेक्ट्रोलाइट: मोल चालकता में अत्यधिक वृद्धि होती है जब सांद्रता घटती है क्योंकि आयनों का आयनीकरण बढ़ जाता है।
समीकरण: Λm = κ × (1000 / C)
प्रश्न 3.16
फैराडे के नियमों के अनुसार, यदि I = 0.5 A धारा 30 मिनट तक प्रवाहित की जाए, तो कुल आवेश ज्ञात कीजिए।
उत्तर:
Q = I × t
t = 30 × 60 = 1800 s
Q = 0.5 × 1800 = 900 C
प्रश्न 3.17
यदि 1.5 A धारा प्रवाहित की जाए और 1.5 g Ag इलेक्ट्रोड पर जमा हो जाए, तो यह प्रवाह कितने समय तक हुआ होगा?
(Ag का परमाणु द्रव्यमान = 108, n = 1)
उत्तर:
m = (E × I × t) / 96500
⇒ 1.5 = (108 × 1.5 × t) / 96500
⇒ t = (1.5 × 96500) / (108 × 1.5) = 96500 / 108 ≈ 893.5 s
प्रश्न 3.18
किसी विद्युत रासायनिक सेल में लवण सेतु का क्या कार्य होता है?
उत्तर:
लवण सेतु आयनों की आवाजाही को संतुलित करता है और इलेक्ट्रोलाइटिक सेल में विद्युत वृत्त को पूर्ण करता है। यह समाधान में चार्ज असंतुलन को रोकता है और सेल में विभव को स्थिर बनाए रखता है।
————————————————————————————————————————————————————————————————————————————
अन्य महत्वपूर्ण प्रश्न
(CBSE MODEL प्रश्न पत्र)
सिर्फ इसी पाठ से निर्मित CBSE MODEL प्रश्न पत्र।
प्रश्न 1. गैल्वैनिक सेल में कौन-सी प्रक्रिया धनाग्र (कैथोड) पर होती है?
(A) ऑक्सीकरण
(B) न्यूट्रलाइजेशन
(C) अपचयन
(D) अवक्षेपण
उत्तर: (C) अपचयन
प्रश्न 2. EMF को किस उपकरण से मापा जाता है?
(A) एमीटर
(B) वोल्टमीटर
(C) पोटेंशियोमीटर
(D) गैल्वेनोमीटर
उत्तर: (C) पोटेंशियोमीटर
प्रश्न 3. विद्युत अपघटन में फैराडे का प्रथम नियम किस पर आधारित है?
(A) वोल्टता
(B) समय
(C) विद्युत धारा की तीव्रता
(D) विद्युत आवेश की मात्रा
उत्तर: (D) विद्युत आवेश की मात्रा
प्रश्न 4. निम्नलिखित में से कौन-सी बैटरी रिचार्ज नहीं की जा सकती?
(A) लेड-एसिड बैटरी
(B) निकल-कैडमियम बैटरी
(C) एल्कलाइन बैटरी
(D) लिथियम आयन बैटरी
उत्तर: (C) एल्कलाइन बैटरी
प्रश्न 5. यदि किसी इलेक्ट्रोड की अपरिवर्तनीय क्षमता –0.76 V है, तो वह किस प्रकार की प्रक्रिया दर्शाता है?
(A) शक्तिशाली ऑक्सीकारक
(B) शक्तिशाली अपचायक
(C) न्यूट्रल
(D) संयुग्मी
उत्तर: (B) शक्तिशाली अपचायक
प्रश्न 6. ई.एम.एफ. की इकाई है:
(A) ओम
(B) एम्पीयर
(C) वोल्ट
(D) कूलॉम्ब
उत्तर: (C) वोल्ट
प्रश्न 7. कुचालक के रूप में प्रयुक्त इलेक्ट्रोलाइट की भूमिका क्या है?
(A) धारा प्रवाह को रोकना
(B) घनत्व बढ़ाना
(C) आयनों का वहन करना
(D) गैस अवशोषण
उत्तर: (C) आयनों का वहन करना
प्रश्न 8. फ़ैराडे का द्वितीय नियम किस पर आधारित है?
(A) पदार्थ की प्रकृति पर
(B) विद्युत धारा पर
(C) समय पर
(D) विद्युत विभव पर
उत्तर: (A) पदार्थ की प्रकृति पर
प्रश्न 9. Zn | Zn²⁺ (1 M) || Cu²⁺ (1 M) | Cu सेल का EMF लगभग होता है:
(A) –1.10 V
(B) 1.10 V
(C) 0.34 V
(D) –0.76 V
उत्तर: (B) 1.10 V
प्रश्न 10. यदि किसी बैटरी का EMF शून्य हो जाए, तो इसका तात्पर्य है:
(A) सेल अभी कार्यशील है
(B) रासायनिक ऊर्जा शेष है
(C) सेल डिस्चार्ज हो चुका है
(D) वोल्टता बढ़ गई है
उत्तर: (C) सेल डिस्चार्ज हो चुका है
प्रश्न 11. निम्नलिखित में से कौन-सा कथन फैराडे के द्वितीय नियम से संबंधित है?
Assertion (A): विभिन्न इलेक्ट्रोडों पर जमा द्रव्यमान उनके रासायनिक तुल्यांक के अनुपात में होता है।
Reason (R): जमा द्रव्यमान विद्युत धारा के समय के साथ बदलता है।
(A) A और R दोनों सही हैं तथा R, A की सही व्याख्या है।
(B) A और R दोनों सही हैं, परन्तु R, A की सही व्याख्या नहीं है।
(C) A सही है, R गलत है।
(D) A गलत है, R सही है।
उत्तर: (B)
प्रश्न 12. सेल के EMF को प्रभावित करता है:
(A) तापमान
(B) आयनों की सांद्रता
(C) इलेक्ट्रोड की प्रकृति
(D) उपरोक्त सभी
उत्तर: (D) उपरोक्त सभी
प्रश्न 13. नर्न्स्ट समीकरण का प्रयोग किसके लिए होता है?
(A) गैस घनत्व ज्ञात करने हेतु
(B) विद्युत विभव और सांद्रता के बीच संबंध बताने हेतु
(C) प्रतिरोध ज्ञात करने हेतु
(D) ऊष्मा परिवर्तन ज्ञात करने हेतु
उत्तर: (B)
प्रश्न 14. इलेक्ट्रोलाइसिस में प्रति सेकंड स्थानांतरित आवेश को कहते हैं:
(A) शक्ति
(B) धारा
(C) विभव
(D) ऊर्जा
उत्तर: (B) धारा
प्रश्न 15. विद्युत अपघटन की इकाई प्रणाली में विद्युत आवेश की मात्रक है:
(A) न्यूटन
(B) जूल
(C) कूलॉम्ब
(D) वोल्ट
उत्तर: (C) कूलॉम्ब
प्रश्न 16. एक गैल्वैनिक सेल में इलेक्ट्रोड की संभाव्यता ऋणात्मक है। इसका अर्थ है:
(A) इलेक्ट्रोड पर ऑक्सीकरण होता है
(B) इलेक्ट्रोड पर अपचयन होता है
(C) इलेक्ट्रोड निष्क्रिय है
(D) सेल अनुपयोगी है
उत्तर: (A)
प्रश्न 17. निम्नलिखित में से कौन-सा कथन सही नहीं है?
(A) रेडॉक्स अभिक्रिया में एक तत्व ऑक्सीकरण करता है
(B) गैल्वैनिक सेल में रासायनिक ऊर्जा विद्युत ऊर्जा में परिवर्तित होती है
(C) इलेक्ट्रोलाइट सेल में स्वतः अभिक्रिया होती है
(D) लिथियम का अपचयन संभाव्यता अत्यधिक ऋणात्मक होती है
उत्तर: (C)
प्रश्न 18. (केस आधारित MCQ)
एक गैल्वैनिक सेल में Zn और Cu इलेक्ट्रोड प्रयुक्त हैं। Zn इलेक्ट्रोड की संभाव्यता –0.76 V तथा Cu इलेक्ट्रोड की संभाव्यता +0.34 V है।
प्रश्न: सेल के एनोड पर कौन-सी क्रिया होती है?
(A) Zn का ऑक्सीकरण
(B) Cu का ऑक्सीकरण
(C) Zn का अपचयन
(D) Cu का अपचयन
उत्तर: (A) Zn का ऑक्सीकरण
प्रश्न 19. विद्युत चालकता और मोल चालकता में क्या अंतर होता है?
उत्तर:
विद्युत चालकता (κ): वह मात्रा है जो बताती है कि कोई विलयन विद्युत धारा कितनी सुगमता से प्रवाहित करता है। इसकी इकाई S·m⁻¹ है।
मोल चालकता (Λm): वह चालकता है जो एक मोल इलेक्ट्रोलाइट के आयनों द्वारा प्रदर्शित होती है।
Λm = κ × 1000 / C
जहाँ C = सांद्रता (mol/m³)
प्रश्न 20. यदि किसी इलेक्ट्रोलाइट की चालकता समय के साथ घटती जाती है, तो इसका क्या कारण हो सकता है?
उत्तर:
यह इस कारण हो सकता है कि इलेक्ट्रोलाइट का आयनीकरण घट रहा है या आयन विलयन से बाहर निकलकर इलेक्ट्रोड्स पर जम रहे हैं, जिससे मुक्त आयनों की संख्या घट जाती है।
प्रश्न 21. Zn | Zn²⁺ (1 M) || Cu²⁺ (1 M) | Cu सेल का शुद्ध इलेक्ट्रोड विभव कितना होगा? Zn²⁺/Zn = –0.76 V, Cu²⁺/Cu = +0.34 V
उत्तर:
E°cell = E°cathode – E°anode
= (+0.34 V) – (–0.76 V)
= 0.34 + 0.76 = 1.10 V
प्रश्न 22. फैराडे के द्वितीय नियम का कथन लिखिए और उसका गणितीय रूप दीजिए।
उत्तर:
कथन: यदि एक ही विद्युत मात्रा विभिन्न पदार्थों पर प्रवाहित की जाए, तो जमा पदार्थों के द्रव्यमान उनके रासायनिक तुल्यांक के अनुपात में होता है।
गणितीय रूप:
m₁/m₂ = E₁/E₂
जहाँ m = जमा द्रव्यमान, E = रासायनिक तुल्यांक
प्रश्न 23. नर्न्स्ट समीकरण का उपयोग करके यह दिखाइए कि EMF सांद्रता पर निर्भर करता है।
उत्तर:
नर्न्स्ट समीकरण:
E = E° – (0.0591/n) × log([Red]/[Ox])
जहाँ E = इलेक्ट्रोड विभव,
E° = मानक विभव,
n = इलेक्ट्रॉनों की संख्या
⇒ जब सांद्रता बदलेगी, तो log([Red]/[Ox]) बदलेगा और इसलिए E बदलेगा।
Section C — प्रत्येक प्रश्न 3 अंक
प्रश्न 24. एक इलेक्ट्रोलाइटिक सेल में 0.965 g Ag को विद्युत प्रवाह द्वारा निकाला गया। ज्ञात कीजिए कि कितने कुलॉम्ब आवेश प्रवाहित किए गए? (Ag का रासायनिक तुल्यांक = 108, n = 1)
उत्तर:
Q = (m × 96500) / E
E = 108, m = 0.965 g
Q = (0.965 × 96500) / 108 = 860.65 C (लगभग)
प्रश्न 25. एक सेल का E° 1.1 V है। यदि Zn²⁺ की सांद्रता 0.01 M तथा Cu²⁺ की सांद्रता 1.0 M हो, तो नर्न्स्ट समीकरण का उपयोग करके EMF ज्ञात कीजिए।
(मानिए n = 2)
उत्तर:
E = E° – (0.0591/n) × log([Zn²⁺]/[Cu²⁺])
= 1.10 – (0.0591/2) × log(0.01/1)
= 1.10 – 0.02955 × (–2)
= 1.10 + 0.0591 = 1.1591 V
प्रश्न 26. 1 M NaCl के विलयन की चालकता 12.0 S·m⁻¹ है। यदि यह विलयन 0.01 M है, तो इसकी मोल चालकता ज्ञात कीजिए।
उत्तर:
Λm = κ × 1000 / C
= 12 × 1000 / 0.01 = 1.2 × 10⁶ S·cm²/mol
प्रश्न 27. लेड-एसिड बैटरी की दो विशेषताएँ लिखिए एवं इसका रासायनिक अभिक्रिया समीकरण दीजिए।
उत्तर:
विशेषताएँ:
रिचार्ज करने योग्य है
वाहन चालकों में सामान्यतः उपयोग की जाती है
विसर्जन अभिक्रिया:
Pb + PbO₂ + 2H₂SO₄ → 2PbSO₄ + 2H₂O
प्रश्न 28. विद्युत अपघटन के लिए प्रयुक्त धारा यदि 0.5 A है और इसे 30 मिनट तक प्रवाहित किया गया हो, तो कुल प्रवाहित आवेश ज्ञात कीजिए।
उत्तर:
Q = I × t
I = 0.5 A, t = 30 × 60 = 1800 s
Q = 0.5 × 1800 = 900 C
🔷 Section D – केस आधारित प्रश्न (4 अंक)
प्रश्न 29.
स्थिति: एक गैल्वैनिक सेल Zn | Zn²⁺ (1 M) || Cu²⁺ (1 M) | Cu से बनाया गया है। Zn इलेक्ट्रोड की मानक विभवता –0.76 V है और Cu इलेक्ट्रोड की +0.34 V।
(a) इस सेल की कुल ई.एम.एफ. ज्ञात कीजिए।
(b) सेल अभिक्रिया को लिखिए।
(c) कौन-सा इलेक्ट्रोड धनाग्र और कौन-सा ऋणाग्र होगा?
उत्तर:
(a) E°cell = E°cathode – E°anode = 0.34 – (–0.76) = 1.10 V
(b) Zn → Zn²⁺ + 2e⁻ (ऑक्सीकरण)
Cu²⁺ + 2e⁻ → Cu (अपचयन)
सेल अभिक्रिया: Zn + Cu²⁺ → Zn²⁺ + Cu
(c) Zn = ऋणाग्र (एनोड), Cu = धनाग्र (कैथोड)
प्रश्न 30.
स्थिति: एक इलेक्ट्रोलाइटिक सेल में 9650 C विद्युत आवेश प्रवाहित किया गया, जिससे धातु जमा हुई।
(a) यदि n = 2 हो, तो कितने मोल धातु जमा होंगे?
(b) यदि धातु Zn है, तो जमा द्रव्यमान ज्ञात कीजिए। (Zn का परमाणु द्रव्यमान = 65.4)
उत्तर:
(a) n = 2, F = 96500 C/mol
मोल = Q / (nF) = 9650 / (2 × 96500) = 0.05 mol
(b) द्रव्यमान = moles × atomic mass = 0.05 × 65.4 = 3.27 g
प्रश्न 31.
स्थिति: एक गैल्वैनिक सेल में दो इलेक्ट्रोडों के लिए मानक विभवता निम्न है:
Ag⁺/Ag = +0.80 V, Fe²⁺/Fe = –0.44 V
(a) किस धातु का ऑक्सीकरण होगा?
(b) सेल का कुल विभव ज्ञात कीजिए।
(c) सेल अभिक्रिया लिखिए।
उत्तर:
(a) Fe की विभवता ऋणात्मक है, अतः Fe का ऑक्सीकरण होगा।
(b) E°cell = 0.80 – (–0.44) = 1.24 V
(c) Fe + 2Ag⁺ → Fe²⁺ + 2Ag
🔶 Section E – दीर्घ उत्तर प्रश्न (5 अंक)
प्रश्न 32.
फैराडे के नियमों का विस्तृत वर्णन कीजिए।
साथ ही फैराडे के प्रथम नियम का गणितीय निरूपण कीजिए।
एक उदाहरण द्वारा समझाइए।
उत्तर:
फैराडे का प्रथम नियम: विद्युत अपघटन में जमा द्रव्यमान उस विद्युत आवेश के समानुपाती होता है।
Q ∝ m ⇒ m = ZQ, जहाँ Z = विद्युत रासायनिक तुल्यांक
गणितीय रूप: m = (E × I × t) / 96500
उदाहरण: यदि Cu²⁺ विलयन में 96500 C विद्युत प्रवाहित किया जाए (n = 2), तो जमा Cu = 63.5 g
फैराडे का द्वितीय नियम:
जब एक ही विद्युत आवेश विभिन्न इलेक्ट्रोलाइटों में प्रवाहित किया जाता है, तो जमा द्रव्यमान उनके रासायनिक तुल्यांक के अनुपात में होता है।
m₁/m₂ = E₁/E₂
प्रश्न 33.
नर्न्स्ट समीकरण की व्युत्पत्ति कीजिए।
Zn²⁺/Zn तथा Cu²⁺/Cu के लिए इसका प्रयोग करके Zn-Cu सेल की EMF सांद्रता पर निर्भरता दिखाइए।
उत्तर:
नर्न्स्ट समीकरण (विद्युत विभव के लिए):
E = E° – (0.0591/n) × log([Ox]/[Red])
Zn | Zn²⁺ || Cu²⁺ | Cu
E°cell = E°cathode – E°anode
= 0.34 – (–0.76) = 1.10 V
यदि Cu²⁺ = 1 M, Zn²⁺ = 0.01 M हो,
E = 1.10 – (0.0591/2) × log(0.01/1) = 1.10 + 0.0591 = 1.1591 V
⇒ EMF सांद्रता के साथ बदलता है।
प्रश्न 34.
विद्युत अपघटन के सिद्धांत के अनुसार विद्युत रासायनिक तुल्यांक (Z), रासायनिक तुल्यांक (E) और इलेक्ट्रोड अभिक्रिया में n का महत्व स्पष्ट कीजिए।
साथ ही कोई उपयुक्त समीकरण लिखिए।
उत्तर:
Z = E / F
जहाँ F = 96500 C/mol,
E = परमाणु द्रव्यमान / n
n = इलेक्ट्रॉनों की संख्या जो आयन को धातु में बदलते हैं
जमा द्रव्यमान का सूत्र:
m = (Z × I × t)
या
m = (E × I × t) / 96500
⇒ यह संबंध दिखाता है कि n जितना अधिक होगा, उतना अधिक आवेश आवश्यक होगा।
प्रश्न 35.
एक परिपूर्ण गैल्वैनिक सेल का चित्र बनाइए एवं निम्न लिखिए:
(a) एनोड व कैथोड पर अभिक्रियाएँ
(b) सेल अभिक्रिया
(c) सेल की EMF कैसे ज्ञात की जाती है?
उत्तर:
(a)
एनोड (Zn): Zn → Zn²⁺ + 2e⁻ (ऑक्सीकरण)
कैथोड (Cu): Cu²⁺ + 2e⁻ → Cu (अपचयन)
(b)
Zn + Cu²⁺ → Zn²⁺ + Cu
(c)
E°cell = E°cathode – E°anode
= 0.34 – (–0.76) = 1.10 V
⇒ EMF = कैथोड विभव – एनोड विभव
————————————————————————————————————————————————————————————————————————————
Neet पिछले सालों के प्रश्न
Q1. नर्न्स्ट समीकरण में प्रयुक्त 0.0591 का महत्व किस पर आधारित होता है?
(A) तापमान
(B) दाब
(C) इलेक्ट्रोड विभव
(D) सेल की रचना
Answer: (A) तापमान
Year: 2025 | Set: Z
Q2. Zn और Cu से बना एक गैल्वैनिक सेल है। Zn का विद्युत विभव –0.76 V और Cu का +0.34 V है। सेल का ईएमएफ होगा:
(A) 1.10 V
(B) –1.10 V
(C) 0.76 V
(D) –0.34 V
Answer: (A) 1.10 V
Year: 2024 | Set: Q
Q3. एक गैल्वैनिक सेल में कौन-सा इलेक्ट्रोड ऋणाग्र होता है?
(A) जहाँ इलेक्ट्रॉनों की प्राप्ति होती है
(B) जहाँ ऑक्सीकरण होता है
(C) जहाँ गैस उत्सर्जन होता है
(D) जहाँ अपचयन होता है
Answer: (B) जहाँ ऑक्सीकरण होता है
Year: 2024 | Set: S1
Q4. विद्युत अपघटन में जमा पदार्थ की मात्रा किसके समानुपाती होती है?
(A) कुल वोल्टता
(B) इलेक्ट्रोड विभव
(C) प्रवाहित कुल आवेश
(D) समय
Answer: (C) प्रवाहित कुल आवेश
Year: 2023 | Set: R
Q5. सेल अभिक्रिया Zn + Cu²⁺ → Zn²⁺ + Cu में कौन-सा अभिकारक ऑक्सीकरण में भाग लेता है?
(A) Cu
(B) Zn²⁺
(C) Zn
(D) Cu²⁺
Answer: (C) Zn
Year: 2023 | Set: Q
Q6. यदि किसी सेल की EMF शून्य है, तो यह दर्शाता है:
(A) सेल चार्ज हो चुका है
(B) अभिक्रिया आगे बढ़ रही है
(C) सेल संतुलन पर है
(D) विद्युत धारा तीव्र हो गई है
Answer: (C) सेल संतुलन पर है
Year: 2022 | Set: Z
Q7. यदि किसी इलेक्ट्रोलाइटिक सेल में 9650 C विद्युत आवेश प्रवाहित किया जाए, तो 1 मोल एक संयोजक के लिए जमा द्रव्यमान होगा:
(A) 0.1 mol
(B) 0.01 mol
(C) 1 mol
(D) 10 mol
Answer: (A) 0.1 mol
Year: 2022 | Set: M
Q8. Cu²⁺ + 2e⁻ → Cu यह अभिक्रिया किस प्रकार की है?
(A) ऑक्सीकरण
(B) अपचयन
(C) विस्थापन
(D) जलीकरण
Answer: (B) अपचयन
Year: 2021 | Set: S2
Q9. सेल EMF और गिब्स ऊर्जा परिवर्तन के बीच संबंध है:
(A) ΔG = –nFE
(B) ΔG = +nFE
(C) ΔG = nFE
(D) ΔG = –FE/n
Answer: (A) ΔG = –nFE
Year: 2021 | Set: Q
Q10. यदि किसी सेल का EMF बढ़ता है, तो उस पर प्रभाव होगा:
(A) अपचयन घटेगा
(B) ऑक्सीकरण बढ़ेगा
(C) विद्युत धारा घटेगी
(D) विद्युत धारा बढ़ेगी
Answer: (D) विद्युत धारा बढ़ेगी
Year: 2020 | Set: R2
Q11. सेल EMF को प्रभावित करता है:
(A) इलेक्ट्रोड का क्षेत्रफल
(B) इलेक्ट्रोलाइट की सांद्रता
(C) तार की लंबाई
(D) गैस का आयतन
Answer: (B) इलेक्ट्रोलाइट की सांद्रता
Year: 2020 | Set: Z
Q12. Zn²⁺ + 2e⁻ → Zn, E° = –0.76 V. इस अभिक्रिया में Zn क्या है?
(A) ऑक्सीकारक
(B) अपचायक
(C) निष्क्रिय
(D) यौगिक
Answer: (B) अपचायक
Year: 2019 | Set: P2
Q13. विद्युत चालकता की इकाई होती है:
(A) Ohm
(B) S m⁻¹
(C) A s
(D) V m⁻¹
Answer: (B) S m⁻¹
Year: 2019 | Set: Q1
Q14. फैराडे के अनुसार, विद्युत अपघटन में 1 फा. आवेश से एक संयोजक के कितने मोल जमते हैं (n = 1)?
(A) 1 mol
(B) 0.5 mol
(C) 0.1 mol
(D) 2 mol
Answer: (A) 1 mol
Year: 2018 | Set: Z
Q15. 0.0591 का उपयोग नर्न्स्ट समीकरण में किस तापमान पर किया जाता है?
(A) 25°C
(B) 0°C
(C) 50°C
(D) 100°C
Answer: (A) 25°C
Year: 2018 | Set: S2
Q16. यदि E°cell धनात्मक हो, तो गिब्स ऊर्जा परिवर्तन होगा:
(A) धनात्मक
(B) शून्य
(C) ऋणात्मक
(D) अनंत
Answer: (C) ऋणात्मक
Year: 2017 | Set: P1
Q17. Zn का विद्युत विभव –0.76 V है। यदि Zn²⁺ की सांद्रता बढ़ा दी जाए, तो Zn का विभव होगा:
(A) अधिक ऋणात्मक
(B) अधिक धनात्मक
(C) अपरिवर्तित
(D) शून्य
Answer: (A) अधिक ऋणात्मक
Year: 2017 | Set: R
Q18. विद्युत रासायनिक श्रृंखला में ऊपर की ओर स्थित तत्व:
(A) शक्तिशाली अपचायक होते हैं
(B) शक्तिशाली ऑक्सीकारक होते हैं
(C) निष्क्रिय होते हैं
(D) वाष्पशील होते हैं
Answer: (A) शक्तिशाली अपचायक होते हैं
Year: 2016 | Set: Q2
Q19. Cu²⁺/Cu और Zn²⁺/Zn के बीच सेल में कौन-सा इलेक्ट्रोड धनाग्र होता है?
(A) Zn
(B) Cu
(C) दोनों
(D) कोई नहीं
Answer: (B) Cu
Year: 2016 | Set: S1
Q20. फैराडे का द्वितीय नियम दर्शाता है:
(A) जमा द्रव्यमान समय के समानुपाती होता है
(B) विद्युत आवेश के समानुपाती होता है
(C) रासायनिक तुल्यांक के अनुपात में होता है
(D) वोल्टता के अनुपात में होता है
Answer: (C) रासायनिक तुल्यांक के अनुपात में होता है
Year: 2015 | Set: Q1
Q21. इलेक्ट्रोलाइट सेल में किस प्रकार की अभिक्रिया होती है?
(A) स्वतः
(B) ऊर्जा मुक्त
(C) ऊर्जा आवश्यक
(D) विस्थापन
Answer: (C) ऊर्जा आवश्यक
Year: 2015 | Set: M
Q22. विद्युत अपघटन के समय जमा पदार्थ का द्रव्यमान किसके द्वारा निर्धारित होता है?
(A) अभिक्रिया की गति
(B) इलेक्ट्रोड क्षेत्रफल
(C) कुल विद्युत आवेश
(D) तापमान
Answer: (C) कुल विद्युत आवेश
Year: 2014 | Set: Z
Q23. कौन-सा सेल रिचार्ज नहीं किया जा सकता?
(A) लीड-एसिड
(B) लिथियम आयन
(C) निकल-कैडमियम
(D) शुष्क सेल
Answer: (D) शुष्क सेल
Year: 2013 | Set: P2
Q24. गैल्वैनिक सेल में ऊर्जा परिवर्तन होता है:
(A) ताप ऊर्जा से विद्युत ऊर्जा
(B) रासायनिक ऊर्जा से विद्युत ऊर्जा
(C) विद्युत ऊर्जा से रासायनिक ऊर्जा
(D) रासायनिक ऊर्जा से ताप ऊर्जा
Answer: (B) रासायनिक ऊर्जा से विद्युत ऊर्जा
Year: 2013 | Set: S
Q25. विद्युत रासायनिक सेल में कौन-सी अभिक्रिया प्राथमिक होती है?
(A) ऑक्सीकरण
(B) अपचयन
(C) रेडॉक्स
(D) संयोग
Answer: (C) रेडॉक्स
Year: 2012 | Set: Q1
Q26. सेल का E° यदि ऋणात्मक है, तो उसका ΔG होगा:
(A) धनात्मक
(B) ऋणात्मक
(C) शून्य
(D) अनंत
Answer: (A) धनात्मक
Year: 2012 | Set: M
Q27. गैल्वैनिक सेल का ऋणाग्र (एनोड) वह इलेक्ट्रोड होता है:
(A) जहाँ अपचयन होता है
(B) जहाँ ऑक्सीकरण होता है
(C) जहाँ गैस निकलती है
(D) जिसमें उच्च विभवता होती है
Answer: (B) जहाँ ऑक्सीकरण होता है
Year: 2011 | Set: Z
Q28. नर्न्स्ट समीकरण के अनुसार, सेल विभव किस पर निर्भर करता है?
(A) केवल तापमान
(B) केवल इलेक्ट्रोड
(C) आयनों की सांद्रता
(D) द्रव्यमान
Answer: (C) आयनों की सांद्रता
Year: 2011 | Set: Q2
Q29. फैराडे का नियम किस पर लागू नहीं होता?
(A) धातु जमा करने पर
(B) गैस उत्सर्जन पर
(C) तटस्थीकरण पर
(D) जलीकरण पर
Answer: (D) जलीकरण पर
Year: 2010 | Set: P1
Q30. निम्नलिखित में से कौन-सा बैटरी का उदाहरण है?
(A) Zn – Cu सेल
(B) शुष्क सेल
(C) विद्युत रासायनिक श्रृंखला
(D) पोटेंशियोमीटर
Answer: (B) शुष्क सेल
Year: 2010 | Set: R
Q31. एक सेल में निम्नलिखित सेल अभिक्रिया हो रही है:
Mg + Cu²⁺ → Mg²⁺ + Cu
तो EMF कैसा होगा?
(A) ऋणात्मक
(B) धनात्मक
(C) शून्य
(D) ज्ञात नहीं
Answer: (B) धनात्मक
Year: 2009 | Set: S
Q32. विद्युत अपघटन में यदि n = 2 है और आवेश 19300 C है, तो जमा मोल = ?
(A) 0.1
(B) 0.2
(C) 0.05
(D) 1
Answer: (A) 0.1
Year: 2009 | Set: M
Q33. यदि किसी सेल में EMF = 0 हो, तो:
(A) कोई रासायनिक अभिक्रिया नहीं होती
(B) सेल निष्क्रिय है
(C) सेल संतुलन पर है
(D) अपचयन नहीं होगा
Answer: (C) सेल संतुलन पर है
Year: 2008 | Set: P1
Q34. विद्युत चालकता तापमान बढ़ाने पर:
(A) घटती है
(B) बढ़ती है
(C) अपरिवर्तित रहती है
(D) पहले बढ़ती फिर घटती
Answer: (B) बढ़ती है
Year: 2008 | Set: Q
Q35. फैराडे का प्रथम नियम विद्युत अपघटन में किसका संबंध बताता है?
(A) समय और द्रव्यमान
(B) वोल्टता और द्रव्यमान
(C) विद्युत आवेश और द्रव्यमान
(D) करंट और गैस की मात्रा
Answer: (C) विद्युत आवेश और द्रव्यमान
Year: 2007 | Set: S
Q36. निम्नलिखित में से कौन-सी विधि विद्युत विभव को मापने के लिए उपयुक्त है?
(A) गैस वॉल्यूम मीटर
(B) पोटेंशियोमीटर
(C) ऐमीटर
(D) वोल्टमीटर
Answer: (B) पोटेंशियोमीटर
Year: 2007 | Set: Z
Q37. Cu²⁺/Cu सेल में Cu²⁺ की सांद्रता घटाने पर EMF:
(A) घटेगा
(B) बढ़ेगा
(C) अपरिवर्तित रहेगा
(D) पहले बढ़ेगा फिर घटेगा
Answer: (A) घटेगा
Year: 2006 | Set: Q2
Q38. Zn²⁺/Zn और Cu²⁺/Cu सेल में कौन-सा अधिक शक्तिशाली अपचायक है?
(A) Cu
(B) Zn
(C) दोनों समान
(D) Cu²⁺
Answer: (B) Zn
Year: 2006 | Set: S1
Q39. नर्न्स्ट समीकरण में log के स्थान पर ln का उपयोग करने पर सूत्र होगा:
(A) E = E° – 0.0257/n × lnQ
(B) E = E° + 0.0591/n × lnQ
(C) E = E° – 0.0591/n × lnQ
(D) E = E° – 0.015/n × lnQ
Answer: (A) E = E° – 0.0257/n × lnQ
Year: 2005 | Set: P
Q40. विद्युत अपघटन के दौरान यदि 1930 C आवेश प्रवाहित किया गया, तो n = 1 के लिए जमा मोल = ?
(A) 0.1
(B) 0.02
(C) 0.05
(D) 0.01
Answer: (C) 0.05
Year: 2005 | Set: Q
Q41. फैराडे का द्वितीय नियम किसे जोड़ता है?
(A) वोल्टता और समय
(B) गैस और धातु
(C) विभिन्न आयनों के तुल्यांक
(D) तापमान और द्रव्यमान
Answer: (C) विभिन्न आयनों के तुल्यांक
Year: 2004 | Set: R
Q42. गैल्वैनिक सेल के लिए सही कथन है:
(A) विद्युत ऊर्जा → रासायनिक ऊर्जा
(B) रासायनिक ऊर्जा → विद्युत ऊर्जा
(C) कोई ऊर्जा परिवर्तन नहीं
(D) ऊष्मा ऊर्जा → प्रकाश ऊर्जा
Answer: (B) रासायनिक ऊर्जा → विद्युत ऊर्जा
Year: 2004 | Set: S
Q43. Zn²⁺ + 2e⁻ → Zn, यह अभिक्रिया दर्शाती है:
(A) ऑक्सीकरण
(B) अपचयन
(C) विस्थापन
(D) संघनन
Answer: (B) अपचयन
Year: 2003 | Set: Q
Q44. एक सेल में EMF मापन का सही यंत्र है:
(A) ऐमीटर
(B) गैल्वेनोमीटर
(C) पोटेंशियोमीटर
(D) थर्मामीटर
Answer: (C) पोटेंशियोमीटर
Year: 2003 | Set: M
Q45. विद्युत अपघटन में जमा द्रव्यमान अधिकतम होता है जब:
(A) समय अधिक हो
(B) विद्युत धारा अधिक हो
(C) दोनों
(D) कोई नहीं
Answer: (C) दोनों
Year: 2002 | Set: Z
Q46. यदि EMF ऋणात्मक है, तो वह अभिक्रिया:
(A) स्वतः होगी
(B) नहीं होगी
(C) संतुलन में होगी
(D) अधिक तीव्र होगी
Answer: (B) नहीं होगी
Year: 2002 | Set: R
Q47. Zn और Cu से बना सेल यदि संतुलन पर हो, तो EMF होगा:
(A) 0
(B) 1.10
(C) –1.10
(D) 2.0
Answer: (A) 0
Year: 2001 | Set: P1
Q48. विद्युत अपघटन में आयनों की गति पर निर्भर करता है:
(A) विभव
(B) धारा
(C) विद्युत चालकता
(D) संवेग
Answer: (C) विद्युत चालकता
Year: 2001 | Set: Q
Q49. सेल का EMF किस परिस्थिति में अधिक होता है?
(A) जब रेडॉक्स क्षमता अधिक हो
(B) जब आयन सांद्रता अधिक हो
(C) जब ताप कम हो
(D) जब इलेक्ट्रोड निष्क्रिय हो
Answer: (A) जब रेडॉक्स क्षमता अधिक हो
Year: 2001 | Set: S
Q50. Zn-Cu सेल में यदि Cu²⁺ की सांद्रता बढ़ाई जाए, तो EMF:
(A) घटेगा
(B) बढ़ेगा
(C) अपरिवर्तित रहेगा
(D) शून्य होगा
Answer: (B) बढ़ेगा
Year: 2001 | Set: Q2
————————————————————————————————————————————————————————————————————————————
JEE MAINS पिछले सालों के प्रश्न
Q1. गैल्वैनिक सेल में धनाग्र (Cathode) पर कौन-सी क्रिया होती है?
(A) ऑक्सीकरण
(B) अपघटन
(C) अपचयन
(D) गैसीकरण
Answer: (C)
Year: 2024 | Shift: 2 | Set: B
Q2. यदि किसी गैल्वैनिक सेल में जस्ता और ताँबा इलेक्ट्रोड का उपयोग किया गया है, तो इलेक्ट्रॉनों की दिशा क्या होगी?
(A) ताँबा से जस्ता
(B) जस्ता से ताँबा
(C) दोनों दिशाओं में
(D) कोई प्रवाह नहीं
Answer: (B)
Year: 2023 | Shift: 1 | Set: A
Q3. शून्य के समीप मान वाली मानक गिब्स मुक्त ऊर्जा परिवर्तन (ΔG⁰) किस प्रतिक्रिया के लिए संकेत करती है?
(A) तीव्र अपचयन
(B) तीव्र ऑक्सीकरण
(C) संतुलित प्रतिक्रिया
(D) अपरिवर्तनीय प्रतिक्रिया
Answer: (C)
Year: 2022 | Shift: 2 | Set: C
Q4. विद्युत अपघटन में फैराडे का प्रथम नियम क्या कहता है?
(A) वज़न आवेश पर निर्भर नहीं करता
(B) वज़न, प्रवाहित आवेश के समानुपाती होता है
(C) वज़न, आयतन के समानुपाती होता है
(D) कोई नियम नहीं
Answer: (B)
Year: 2022 | Shift: 1 | Set: A
Q5. निम्नलिखित में से किस तत्व का विद्युत रासायनिक श्रेणी में उच्चतम अपचयन संभाव्य है?
(A) Zn
(B) Cu
(C) K
(D) Ag
Answer: (C)
Year: 2021 | Shift: 2 | Set: D
Q6. निम्न अभिक्रिया के लिए मानक अपचयन संभाव्यता क्या होगी?
Zn²⁺ + 2e⁻ → Zn ; E⁰ = -0.76 V
(A) -0.76 V
(B) +0.76 V
(C) 0 V
(D) -1.52 V
Answer: (A)
Year: 2021 | Shift: 1 | Set: C
Q7. विद्युत चालकता की SI इकाई क्या है?
(A) S m
(B) S m⁻¹
(C) ohm m
(D) mho cm⁻¹
Answer: (B)
Year: 2020 | Shift: 1 | Set: A
Q8. कोशिका विभव किस पर निर्भर करता है?
(A) दाब
(B) तापमान
(C) सांद्रता
(D) उपरोक्त सभी
Answer: (D)
Year: 2020 | Shift: 2 | Set: D
Q9. नर्न्स्ट समीकरण का उपयोग किया जाता है –
(A) गिब्स ऊर्जा ज्ञात करने में
(B) सेल विभव ज्ञात करने में
(C) घुलनशीलता उत्पाद ज्ञात करने में
(D) ऊष्मा परिवर्तन ज्ञात करने में
Answer: (B)
Year: 2019 | Shift: 1 | Set: B
Q10. यदि किसी सेल में ΔG⁰ का मान ऋणात्मक है, तो यह दर्शाता है –
(A) प्रतिक्रिया अनैच्छिक है
(B) प्रतिक्रिया स्वतःस्फूर्त है
(C) कोई अभिक्रिया नहीं होगी
(D) ऊर्जा का अवशोषण होगा
Answer: (B)
Year: 2019 | Shift: 2 | Set: A
Q11. कौन-सा अपघट्य विद्युत अपघटन में कैथोड पर मुक्त होता है?
(A) धातु
(B) हाइड्रोजन
(C) ऑक्सीजन
(D) A और B दोनों
Answer: (D)
Year: 2018 | Shift: 1 | Set: C
Q12. किसी विलयन की विशिष्ट चालकता बढ़ती है –
(A) विलयन की तन्यता से
(B) विलयन की सांद्रता से
(C) तापमान बढ़ाने से
(D) उपरोक्त सभी से
Answer: (D)
Year: 2018 | Shift: 2 | Set: D
Q13. निम्न में से कौनसा सेल गैल्वैनिक सेल का उदाहरण नहीं है?
(A) डैनियल सेल
(B) ड्राय सेल
(C) लेड-ऐसिड सेल
(D) अपघट्य सेल
Answer: (D)
Year: 2017 | Shift: 1 | Set: B
Q14. फैराडे का द्वितीय नियम किससे संबंधित है?
(A) समय
(B) तापमान
(C) तुल्यभार
(D) सेल विभव
Answer: (C)
Year: 2017 | Shift: 2 | Set: A
Q15. विद्युत चालकता निम्न में से किस पर निर्भर करती है?
(A) आयन की चाल
(B) आयन का संख्याबल
(C) तापमान
(D) उपरोक्त सभी
Answer: (D)
Year: 2016 | Shift: 2 | Set: C
Q16. यदि 1 फेयराड विद्युत प्रवाहित की जाती है, तो किसमें 1 ग्राम समतुल्य द्रव्यमान जमा होता है?
(A) किसी भी विद्युत अपघट्य में
(B) केवल रजत में
(C) केवल ताँबा में
(D) किसी भी धातु में
Answer: (A)
Year: 2016 | Shift: 1 | Set: A
Q17. विद्युत रासायनिक श्रृंखला में अधिक ऋणात्मक E⁰ वाला तत्व –
(A) आसानी से ऑक्सीकरण करता है
(B) आसानी से अपचयन करता है
(C) निष्क्रिय होता है
(D) कोई क्रिया नहीं करता
Answer: (A)
Year: 2015 | Shift: 2 | Set: B
Q18. गिब्स ऊर्जा और विद्युत विभव के बीच संबंध –
(A) ΔG⁰ = -nFE⁰
(B) ΔG⁰ = +nFE⁰
(C) ΔG = RT ln K
(D) ΔG⁰ = -nE/F
Answer: (A)
Year: 2015 | Shift: 1 | Set: C
Q19. विद्युत चालना की इकाई क्या है?
(A) Ω⁻¹ m⁻¹
(B) mho m⁻¹
(C) S m⁻¹
(D) उपरोक्त सभी समान हैं
Answer: (D)
Year: 2014 | Set: A
Q20. किसी अपघट्य विलयन की कोशिका विभव किस समीकरण से ज्ञात होता है?
(A) गिब्स समीकरण
(B) फैराडे समीकरण
(C) नर्न्स्ट समीकरण
(D) वैन’t हॉफ समीकरण
Answer: (C)
Year: 2014 | Set: D
Q21. लेड-ऐसिड बैटरी में चार्जिंग के समय कैथोड पर क्या बनता है?
(A) Pb
(B) PbO₂
(C) PbSO₄
(D) H₂
Answer: (B)
Year: 2013 | Set: B
Q22. विद्युत अपघटन में गैस अधिक उत्पन्न होती है –
(A) जहाँ आयन कम होते हैं
(B) जहाँ आयन अधिक होते हैं
(C) जहाँ विद्युत घनत्व अधिक होता है
(D) सभी में बराबर
Answer: (C)
Year: 2012 | Set: A
Q23. विद्युत चालकता में वृद्धि होती है –
(A) विलयन के गाढ़ेपन से
(B) तापमान से
(C) pH से
(D) इलेक्ट्रोड की सतह से
Answer: (B)
Year: 2011 | Set: C
Q24. निम्न में से कौन-सा संयुग्म विद्युत रासायनिक श्रेणी में शीर्ष पर है?
(A) Na⁺/Na
(B) Zn²⁺/Zn
(C) H⁺/H₂
(D) Cu²⁺/Cu
Answer: (A)
Year: 2010 | Set: A
Q25. 1 फेयराड बराबर होता है –
(A) 96500 कूलॉम्ब
(B) 1 कूलॉम्ब
(C) 1 J
(D) 1 Ω
Answer: (A)
Year: 2009 | Set: D
Q26. नर्न्स्ट समीकरण में तापमान किस इकाई में होना चाहिए?
(A) सेल्सियस
(B) फेरेनहाइट
(C) रैंकाइन
(D) केल्विन
Answer: (D)
Year: 2008 | Set: B
Q27. एक विद्युत अपघट्य सेल में 2 फेयराड विद्युत प्रवाहित की जाती है। यदि Zn²⁺ आयन जमा हो रहे हैं, तो जमा जस्ता का द्रव्यमान होगा –
(A) 32.7 g
(B) 65.4 g
(C) 130.8 g
(D) 16.35 g
Answer: (B)
Year: 2008 | Set: D
Q28. निम्न में से कौन-सी धातु विद्युत रासायनिक श्रेणी में सबसे ऊपर है?
(A) Ag
(B) Au
(C) Na
(D) Cu
Answer: (C)
Year: 2007 | Set: A
Q29. यदि ΔG⁰ का मान धनात्मक हो, तो प्रतिक्रिया –
(A) स्वतःस्फूर्त है
(B) संतुलन में है
(C) स्वतः नहीं होती
(D) अनिश्चित
Answer: (C)
Year: 2007 | Set: C
Q30. 0.1 M NaCl विलयन की विशिष्ट चालकता किससे अधिक होगी?
(A) 0.01 M NaCl
(B) 0.5 M NaCl
(C) 1.0 M NaCl
(D) 0.1 M CH₃COOH
Answer: (C)
Year: 2006 | Set: D
Q31. विद्युत चालना और आयनिक चाल में मुख्य अंतर है –
(A) इकाई
(B) तापमान पर निर्भरता
(C) सांद्रता
(D) कोई अंतर नहीं
Answer: (A)
Year: 2006 | Set: A
Q32. निम्नलिखित में से कौन-सा युग्म जीनस इलेक्ट्रोड का नहीं है?
(A) Cu²⁺/Cu
(B) Zn²⁺/Zn
(C) Fe³⁺/Fe²⁺
(D) H⁺/H₂
Answer: (C)
Year: 2005 | Set: C
Q33. लेड-एसिड बैटरी में विद्युत रासायनिक क्रिया के दौरान उत्पन्न गैस है –
(A) हाइड्रोजन
(B) नाइट्रोजन
(C) ऑक्सीजन
(D) कोई नहीं
Answer: (A)
Year: 2005 | Set: B
Q34. निम्नलिखित में से कौन-सा विद्युत अपघट्य नहीं है?
(A) NaCl
(B) HCl
(C) CH₃COOH
(D) C₂H₅OH
Answer: (D)
Year: 2004 | Set: D
Q35. विद्युत चालना में वृद्धि किस कारण होती है?
(A) उच्च सांद्रता
(B) कम तापमान
(C) कम आयन आकार
(D) कोई संबंध नहीं
Answer: (C)
Year: 2004 | Set: B
Q36. नर्न्स्ट समीकरण में R का मान क्या होता है?
(A) 8.314 J mol⁻¹ K⁻¹
(B) 0.0821 atm L mol⁻¹ K⁻¹
(C) 1
(D) 9.8 m/s²
Answer: (A)
Year: 2003 | Set: A
Q37. विद्युत चालकता की SI इकाई है –
(A) ohm
(B) S m⁻¹
(C) mho cm
(D) W m⁻¹
Answer: (B)
Year: 2003 | Set: B
Q38. विद्युत रासायनिक श्रृंखला में उच्चतम अपचयन संभाव्यता वाला तत्व –
(A) F₂
(B) Cl₂
(C) Br₂
(D) I₂
Answer: (A)
Year: 2002 | Set: A
Q39. किस गैस को विद्युत अपघटन में ऑक्सीजन इलेक्ट्रोड से उत्पन्न किया जा सकता है?
(A) H₂
(B) O₂
(C) Cl₂
(D) CO₂
Answer: (B)
Year: 2002 | Set: C
Q40. यदि विद्युत प्रवाह 1 सेकंड के लिए 1 एम्पियर हो, तो कुल आवेश होगा –
(A) 1 C
(B) 1 F
(C) 96500 C
(D) 0.1 C
Answer: (A)
Year: 2001 | Set: D
Q41. कौन-सा युग्म द्रव्य का संचरण करता है?
(A) Zn / Zn²⁺
(B) Ag / AgCl
(C) Cu / Cu²⁺
(D) Pt / H₂
Answer: (A)
Year: 2023 | Shift: 1 | Set: B
Q42. कौन-सा तत्व विद्युत रासायनिक श्रृंखला में सबसे निष्क्रिय होता है?
(A) Au
(B) Zn
(C) Na
(D) Mg
Answer: (A)
Year: 2022 | Shift: 2 | Set: A
Q43. एक गैल्वैनिक सेल में ध्रुवों को जोड़ने के लिए किस पदार्थ का प्रयोग होता है?
(A) नमक सेतु
(B) कॉपर तार
(C) बैटरी
(D) वाटर बैथ
Answer: (A)
Year: 2021 | Shift: 1 | Set: C
Q44. कोशिका विभव किस स्थिति में सबसे अधिक होगा?
(A) उच्च सांद्रता
(B) निम्न तापमान
(C) संतुलन स्थिति
(D) अधिक अपचयन संभाव्यता
Answer: (D)
Year: 2020 | Shift: 1 | Set: A
Q45. विद्युत रासायनिक सेल की स्वतःस्फूर्तता निर्धारित की जाती है –
(A) ΔG से
(B) ΔH से
(C) E⁰ से
(D) फैराडे से
Answer: (A)
Year: 2019 | Shift: 1 | Set: A
Q46. फैराडे के द्वितीय नियम में तुल्यभार किसके बराबर होता है?
(A) द्रव्यमान/आवेश
(B) द्रव्यमान/मोल
(C) परमाणु द्रव्यमान/आवेश
(D) कोई नहीं
Answer: (C)
Year: 2018 | Shift: 2 | Set: C
Q47. एक तत्व के इलेक्ट्रोड संभाव्यता मान का उपयोग किसमें किया जाता है?
(A) प्रतिक्रिया दिशा
(B) सेल विभव
(C) अपचयन की प्रवृत्ति
(D) उपरोक्त सभी
Answer: (D)
Year: 2017 | Shift: 1 | Set: B
Q48. लेड-एसिड बैटरी चार्ज होने पर क्या बनाती है?
(A) Pb
(B) PbO₂
(C) PbSO₄
(D) H₂O
Answer: (B)
Year: 2016 | Shift: 1 | Set: A
Q49. डैनियल सेल में ताँबा इलेक्ट्रोड का कार्य होता है –
(A) ऑक्सीकरण
(B) अपचयन
(C) विद्रावक
(D) गैस विकसित करना
Answer: (B)
Year: 2015 | Shift: 2 | Set: C
Q50. अपघटन की मात्रा किस पर निर्भर नहीं करती?
(A) विद्युत धारा
(B) समय
(C) तापमान
(D) विद्युत चालना
Answer: (D)
Year: 2014 | Set: B
————————————————————————————————————————————————————————————————————————————
JEE ADVANCED पिछले सालों के प्रश्न
🔷 Q1. यदि किसी कोशिका का EMF शून्य हो, तो निम्नलिखित में से क्या सत्य है?
(A) वह कोशिका विद्युत धारा उत्पन्न करेगी
(B) वह कोशिका विद्युतीय संतुलन में है
(C) वह कोशिका अनुपयोगी है
(D) उसका इलेक्ट्रोड संभावित अनंत है
Answer: (B)
Year: 2025 | Paper: 1 | Set: 1
🔷 Q2. निम्न में से किस युग्म के लिए मानक इलेक्ट्रोड विभव अधिकतम होता है?
(A) Zn²⁺/Zn
(B) Cu²⁺/Cu
(C) Fe²⁺/Fe
(D) Ag⁺/Ag
Answer: (D)
Year: 2025 | Paper: 1 | Set: 2
🔷 Q3. एक गैल्वैनिक सेल में, ऑक्सीडेशन की क्रिया कहाँ घटित होती है?
(A) कैथोड पर
(B) ऐनोड पर
(C) नमक पुल में
(D) सेल के बाहर
Answer: (B)
Year: 2024 | Paper: 1 | Set: 1
🔷 Q4. नमक पुल का कार्य क्या है?
(A) इलेक्ट्रॉनों को ले जाना
(B) विद्युत विभव को बढ़ाना
(C) आयनों के प्रवाह को संतुलित रखना
(D) विद्युत अपघटन को रोकना
Answer: (C)
Year: 2024 | Paper: 1 | Set: 2
🔷 Q5. यदि किसी गैल्वैनिक सेल में Zn का उपयोग ऐनोड तथा Cu का कैथोड के रूप में किया जाए, तो सेल का EMF कितना होगा?
(A) 0.34 V
(B) 1.10 V
(C) -0.76 V
(D) 1.50 V
Answer: (B)
Year: 2023 | Paper: 1 | Set: 2
🔷 Q6. नर्न्स्ट समीकरण में कौन-सी राशि गैस के प्रभाव को प्रदर्शित करती है?
(A) R
(B) T
(C) n
(D) Q
Answer: (D)
Year: 2023 | Paper: 1 | Set: 1
🔷 Q7. EMF की इकाई क्या है?
(A) जूल
(B) वोल्ट
(C) कूलम्ब
(D) वाट
Answer: (B)
Year: 2022 | Paper: 1 | Set: 1
🔷 Q8. विद्युत अपघटन के दौरान, कैथोड पर कौन-सी क्रिया होती है?
(A) ऑक्सीडेशन
(B) न्यूट्रलाइजेशन
(C) अवकरण
(D) संतुलन
Answer: (C)
Year: 2022 | Paper: 1 | Set: 2
🔷 Q9. १ फ़ैराडे विद्युत आवेश का मान क्या होता है?
(A) 96500 C
(B) 1 C
(C) 1000 C
(D) 6.023 × 10²³ C
Answer: (A)
Year: 2021 | Paper: 1 | Set: 1
🔷 Q10. फ़ैराडे का कौन-सा नियम द्रव्यमान और आवेश के संबंध को दर्शाता है?
(A) पहला
(B) दूसरा
(C) दोनों
(D) कोई नहीं
Answer: (A)
Year: 2021 | Paper: 1 | Set: 2
🔷 Q11. विद्युत अपघटन में ताँबे का एक इलेक्ट्रोड ऐनोड पर है, तो वहाँ क्या होगा?
(A) Cu जमा होगा
(B) Cu आयन बनाएगा
(C) O₂ निकलेगी
(D) कुछ नहीं होगा
Answer: (B)
Year: 2020 | Paper: 1 | Set: 1
🔷 Q12. निम्न में से कौन-सा कथन गलत है?
(A) कैथोड पर अवकरण होता है
(B) ऐनोड पर ऑक्सीडेशन होता है
(C) कैथोड धन आवेशित होता है
(D) ऐनोड ऋण आवेशित होता है
Answer: (D)
Year: 2020 | Paper: 1 | Set: 2
🔷 Q13. नर्न्स्ट समीकरण में ‘n’ का अर्थ क्या होता है?
(A) आयनों की संख्या
(B) इलेक्ट्रॉनों की संख्या
(C) सेल का विभव
(D) तापमान
Answer: (B)
Year: 2019 | Paper: 1 | Set: 3
🔷 Q14. यदि किसी गैल्वैनिक सेल का EMF ऋणात्मक है, तो वह क्रिया:
(A) स्वतःस्फूर्त है
(B) अनैच्छिक है
(C) संतुलित है
(D) त्वरित है
Answer: (B)
Year: 2019 | Paper: 1 | Set: 1
🔷 Q15. ZnSO₄ विलयन में Zn इलेक्ट्रोड रखने पर क्या होता है?
(A) Zn जमा होता है
(B) Zn ऑक्सीकृत होता है
(C) Zn में कोई परिवर्तन नहीं होता
(D) Zn अवकरण होता है
Answer: (B)
Year: 2018 | Paper: 1 | Set: 1
🔷 Q16. फ़ैराडे का द्वितीय नियम क्या बताता है?
(A) द्रव्यमान और विभव का संबंध
(B) विभिन्न आयनों के तुल्य भार का संबंध
(C) धारा और समय का संबंध
(D) विद्युत आवेश और द्रव्यमान का संबंध
Answer: (B)
Year: 2018 | Paper: 1 | Set: 2
🔷 Q17. EMF और ΔG का संबंध निम्न में से किस समीकरण से व्यक्त होता है?
(A) ΔG = -nFE
(B) ΔG = +nFE
(C) ΔG = nF/E
(D) ΔG = -E/F
Answer: (A)
Year: 2017 | Paper: 1 | Set: 2
🔷 Q18. नर्न्स्ट समीकरण में यदि तापमान को बढ़ा दिया जाए तो सेल विभव पर क्या प्रभाव होगा?
(A) घटेगा
(B) बढ़ेगा
(C) कोई प्रभाव नहीं
(D) पहले घटेगा फिर बढ़ेगा
Answer: (B)
Year: 2025 | Paper: 2 | Set: 1
🔷 Q19. विद्युत अपघटन में निम्न में से किसे घटाने के लिए अधिक फ़ैराडे की आवश्यकता होगी?
(A) Cu²⁺
(B) Al³⁺
(C) Ag⁺
(D) Zn²⁺
Answer: (B)
Year: 2024 | Paper: 2 | Set: 1
🔷 Q20. यदि सेल क्रिया का ΔG धनात्मक है, तो निम्न में से क्या सत्य है?
(A) क्रिया स्वतःस्फूर्त होगी
(B) सेल कार्य करेगा
(C) सेल EMF ऋणात्मक होगा
(D) इलेक्ट्रॉन प्रवाह नहीं होगा
Answer: (C)
Year: 2023 | Paper: 2 | Set: 1
🔷 Q21. निम्नलिखित में से किस कोशिका में धारा प्रवाह के साथ द्रव्यमान घटता है?
(A) ऐनोड
(B) कैथोड
(C) नमक पुल
(D) पूरी सेल
Answer: (A)
Year: 2022 | Paper: 2 | Set: 2
🔷 Q22. निम्न में से कौन-सी प्रतिक्रिया स्वतःस्फूर्त नहीं है?
(A) Zn + Cu²⁺ → Zn²⁺ + Cu
(B) Mg + Fe²⁺ → Mg²⁺ + Fe
(C) Cu + Zn²⁺ → Cu²⁺ + Zn
(D) Al + H⁺ → Al³⁺ + H₂
Answer: (C)
Year: 2022 | Paper: 2 | Set: 1
🔷 Q23. निम्न में से कौन-सी धातु सबसे अधिक सक्रिय है?
(A) Cu
(B) Ag
(C) Zn
(D) Au
Answer: (C)
Year: 2021 | Paper: 2 | Set: 2
🔷 Q24. एक गैल्वैनिक सेल में Zn और Cu इलेक्ट्रोड का उपयोग किया गया है। यदि Zn²⁺ का सांद्रण 0.1 M और Cu²⁺ का 1 M है, तो EMF कैसा होगा?
(A) 1.10 V
(B) 1.04 V
(C) 0.76 V
(D) 0 V
Answer: (B)
Year: 2020 | Paper: 2 | Set: 1
🔷 Q25. नर्न्स्ट समीकरण में कौन-सी राशि प्रतिक्रियाशील प्रजातियों का गुणोत्तर प्रदर्शित करती है?
(A) EMF
(B) Q
(C) ΔG
(D) F
Answer: (B)
Year: 2020 | Paper: 2 | Set: 2
🔷 Q26. विद्युत अपघटन में जमा हुए पदार्थ का द्रव्यमान किस पर निर्भर करता है?
(A) वोल्टेज
(B) तापमान
(C) प्रवाहित आवेश
(D) विद्युत प्रतिरोध
Answer: (C)
Year: 2019 | Paper: 2 | Set: 1
🔷 Q27. फ़ैराडे का कौन-सा नियम तुल्य भार के सिद्धांत पर आधारित है?
(A) प्रथम
(B) द्वितीय
(C) दोनों
(D) कोई नहीं
Answer: (B)
Year: 2019 | Paper: 2 | Set: 2
🔷 Q28. निम्न में से किस धातु का मानक अपचायक विभव सबसे अधिक ऋणात्मक है?
(A) Cu
(B) Zn
(C) Ag
(D) Fe
Answer: (B)
Year: 2018 | Paper: 2 | Set: 2
🔷 Q29. यदि किसी सेल की विद्युत वाहक शक्ति ऋणात्मक है, तो वह क्रिया:
(A) स्वतःस्फूर्त है
(B) केवल बाह्य शक्ति से चलेगी
(C) त्वरित है
(D) विस्फोटक है
Answer: (B)
Year: 2017 | Paper: 2 | Set: 1
🔷 Q30. निम्न में से किस धातु का मानक इलेक्ट्रोड विभव धनात्मक होता है?
(A) K
(B) Na
(C) Ag
(D) Zn
Answer: (C)
Year: 2017 | Paper: 2 | Set: 2
🔷 Q31. नर्न्स्ट समीकरण में यदि Q का मान बढ़े तो EMF पर क्या प्रभाव होगा?
(A) घटेगा
(B) बढ़ेगा
(C) अपरिवर्तित रहेगा
(D) अनंत हो जाएगा
Answer: (A)
Year: 2016 | Paper: 2 | Set: 1
🔷 Q32. यदि एक गैल्वैनिक सेल में धारा प्रवाहित की जा रही है, तो इलेक्ट्रॉन की दिशा क्या होगी?
(A) कैथोड से ऐनोड
(B) ऐनोड से कैथोड
(C) दोनों दिशाओं में
(D) नहीं बता सकते
Answer: (B)
Year: 2016 | Paper: 2 | Set: 2
🔷 Q33. इलेक्ट्रोड विभव को मापा जाता है:
(A) एकल इलेक्ट्रोड के लिए
(B) पूर्ण सेल के लिए
(C) केवल नमक पुल में
(D) गैस के दाब से
Answer: (A)
Year: 2015 | Paper: 2 | Set: 2
🔷 Q34. एक विद्युत अपघटन में 0.5 फ़ैराडे आवेश प्रवाहित करने पर कितने ग्राम ताँबा जमा होगा? (Cu = 63.5 g/mol, n = 2)
(A) 63.5 g
(B) 31.75 g
(C) 15.87 g
(D) 127 g
Answer: (B)
Year: 2015 | Paper: 2 | Set: 1
————————————————————————————————————————————————————————————————————————————
मॉडल प्रश्न पत्र, अभ्यास
🔷 Q1. विद्युत रासायनिक सेल में कौन-सी प्रक्रिया होती है?
(A) विद्युत ऊर्जा का रासायनिक ऊर्जा में परिवर्तन
(B) रासायनिक ऊर्जा का विद्युत ऊर्जा में परिवर्तन
(C) यांत्रिक ऊर्जा का ऊष्मा ऊर्जा में परिवर्तन
(D) ऊष्मा ऊर्जा का विद्युत ऊर्जा में परिवर्तन
Answer: (B)
🔷 Q2. एक गैल्वैनिक सेल में इलेक्ट्रॉनों का प्रवाह होता है:
(A) कैथोड से ऐनोड
(B) बाह्य परिपथ से कैथोड की ओर
(C) ऐनोड से कैथोड
(D) नमक पुल से इलेक्ट्रॉनों का प्रवाह होता है
Answer: (C)
🔷 Q3. गैल्वैनिक सेल में ऐनोड पर कौन-सी अभिक्रिया होती है?
(A) अपचयन
(B) ऑक्सीकरण
(C) अम्ल-क्षार प्रतिक्रिया
(D) कोई प्रतिक्रिया नहीं होती
Answer: (B)
🔷 Q4. निम्नलिखित में से किस धातु का विद्युत धनात्मक विभव अधिक होता है?
(A) Zn
(B) Cu
(C) K
(D) Ag
Answer: (D)
🔷 Q5. निम्नलिखित में से कौन-सा सेल रिचार्ज किया जा सकता है?
(A) डैनियल सेल
(B) ड्राइ सेल
(C) लेड एसिड सेल
(D) Zn-C सेल
Answer: (C)
🔷 Q6. नर्न्स्ट समीकरण में तापमान का मात्रक क्या होता है?
(A) डिग्री सेल्सियस
(B) केल्विन
(C) फेरेनहाइट
(D) एम्पीयर
Answer: (B)
🔷 Q7. फ़ैराडे का प्रथम नियम किस पर आधारित है?
(A) तापमान
(B) विद्युत विभव
(C) प्रवाहित आवेश
(D) गैस का दाब
Answer: (C)
🔷 Q8. विद्युत अपघटन के समय जमा हुए पदार्थ का द्रव्यमान किस पर निर्भर करता है?
(A) वोल्टेज
(B) दाब
(C) तापमान
(D) प्रवाहित आवेश
Answer: (D)
🔷 Q9. 1 फ़ैराडे में कितने कुलॉम्ब होते हैं?
(A) 96500 C
(B) 1 C
(C) 100000 C
(D) 60200 C
Answer: (A)
🔷 Q10. मानक इलेक्ट्रोड विभव को परिभाषित किया जाता है:
(A) 1 atm पर
(B) 1 M सांद्रता पर
(C) 25°C पर
(D) उपरोक्त सभी
Answer: (D)
🔷 Q11. निम्न में से कौन-सी प्रतिक्रिया एक इलेक्ट्रोलाइटिक सेल में घटित होती है?
(A) स्वतःस्फूर्त
(B) बाह्य विद्युत आपूर्ति से संचालित
(C) प्रकाश से संचालित
(D) ताप से संचालित
Answer: (B)
🔷 Q12. नमक पुल का कार्य है:
(A) इलेक्ट्रॉन प्रवाह करना
(B) संतुलन बनाए रखना
(C) दाब को नियंत्रित करना
(D) सेल विभव को बढ़ाना
Answer: (B)
🔷 Q13. 1 फ़ैराडे आवेश से जमा हुए पदार्थ का मोल कितना होगा यदि n = 2 हो?
(A) 2 mol
(B) 1 mol
(C) 0.5 mol
(D) 0.25 mol
Answer: (C)
🔷 Q14. EMF ऋणात्मक होने का अर्थ है:
(A) क्रिया स्वतःस्फूर्त है
(B) प्रतिक्रिया संभव नहीं
(C) ऊर्जा निकलती है
(D) इलेक्ट्रॉन प्रवाह नहीं होगा
Answer: (B)
🔷 Q15. विद्युत रासायनिक श्रेणी में सबसे अधिक अपचायक कौन है?
(A) F₂
(B) Cl₂
(C) Li
(D) H₂
Answer: (C)
🔷 Q16. विद्युत अपघटन में सबसे पहले कौन जमा होता है?
(A) सबसे कम इलेक्ट्रोड विभव वाली प्रजाति
(B) सबसे अधिक इलेक्ट्रोड विभव वाली प्रजाति
(C) सबसे हल्की प्रजाति
(D) सबसे भारी प्रजाति
Answer: (B)
🔷 Q17. फ़ैराडे के द्वितीय नियम के अनुसार यदि विभिन्न इलेक्ट्रोलाइटों में एक ही मात्रा का आवेश प्रवाहित किया जाए तो:
(A) समान मात्रा में पदार्थ जमा होगा
(B) तुल्य भार के अनुसार पदार्थ जमा होगा
(C) सबसे भारी पदार्थ जमा होगा
(D) सबसे हल्का पदार्थ जमा होगा
Answer: (B)
🔷 Q18. गैल्वैनिक सेल का EMF मापा जाता है:
(A) कैथोड के इलेक्ट्रोड विभव से
(B) ऐनोड के इलेक्ट्रोड विभव से
(C) दोनों के विभव के अंतर से
(D) नमक पुल से
Answer: (C)
🔷 Q19. नर्न्स्ट समीकरण में Q दर्शाता है:
(A) गैस नियतांक
(B) तापमान
(C) प्रतिक्रियाशील प्रजातियों का गुणोत्तर
(D) प्रवाहित आवेश
Answer: (C)
🔷 Q20. विद्युत अपघटन के लिए न्यूनतम वोल्टेज क्या कहलाता है?
(A) अपघटन विभव
(B) EMF
(C) न्यूनतम विभव
(D) पोटेंशियल ड्रॉप
Answer: (A)
🔷 Q21. यदि 0.5 फ़ैराडे आवेश प्रवाहित किया जाए, तो Zn²⁺ से Zn जमा होने पर कितने मोल Zn प्राप्त होंगे? (n = 2)
(A) 1 mol
(B) 0.5 mol
(C) 0.25 mol
(D) 2 mol
Answer: (C)
🔷 Q22. बैटरी की क्षमता को मापा जाता है:
(A) वोल्ट में
(B) एम्पीयर में
(C) एम्पीयर-घंटा में
(D) ओम में
Answer: (C)
🔷 Q23. निम्नलिखित में से कौन एक प्राथमिक सेल है?
(A) लेड-एसिड बैटरी
(B) निकेल-कैडमियम सेल
(C) Zn-C सेल
(D) लिथियम आयन बैटरी
Answer: (C)
🔷 Q24. निम्न में से कौनसा एक सेकेंडरी सेल नहीं है?
(A) लेड एसिड बैटरी
(B) लिथियम आयन बैटरी
(C) Zn-C सेल
(D) निकेल-कैडमियम बैटरी
Answer: (C)
🔷 Q25. लेड-एसिड बैटरी का विद्युत अपघटन किस माध्यम में होता है?
(A) H₂O
(B) H₂SO₄
(C) NaCl
(D) HNO₃
Answer: (B)
🔶 Q26. यदि Zn | Zn²⁺(1M) || Cu²⁺(1M) | Cu सेल का EMF 1.1 V है, तो Zn²⁺ का मानक इलेक्ट्रोड विभव होगा:
(E°(Cu²⁺/Cu) = +0.34 V)
(A) −0.76 V
(B) +0.76 V
(C) −0.44 V
(D) +0.44 V
Answer: (A)
🔶 Q27. निम्नलिखित सेल में EMF की गणना करें:
Fe | Fe²⁺(0.01 M) || H⁺(1M) | H₂(1 atm), Pt
(E°(Fe²⁺/Fe) = −0.44 V)
(A) −0.44 V
(B) −0.38 V
(C) −0.50 V
(D) 0.00 V
Answer: (B)
🔶 Q28. यदि 0.1 M Cu²⁺ और 1 M Zn²⁺ में डैनियल सेल स्थापित हो, तो किस दिशा में इलेक्ट्रॉनों का प्रवाह होगा?
(A) Cu से Zn
(B) Zn से Cu
(C) कोई प्रवाह नहीं
(D) दोनों दिशाओं में
Answer: (B)
🔶 Q29. एक गैल्वैनिक सेल में 0.01 M Zn²⁺ और 1 M Cu²⁺ है। EMF को प्रभावित करेगा:
(A) केवल Zn²⁺ का दाब
(B) केवल तापमान
(C) Zn²⁺ और Cu²⁺ की सांद्रता
(D) नमक पुल की लंबाई
Answer: (C)
🔶 Q30. यदि 1 फ़ैराडे आवेश से Al³⁺ को अपचय किया जाए, तो जमा हुए Al का द्रव्यमान होगा (Al = 27 g/mol)
(A) 27 g
(B) 9 g
(C) 13.5 g
(D) 18 g
Answer: (B)
🔶 Q31. निम्न सेल अभिक्रिया के लिए EMF ज्ञात कीजिए:
Ag⁺(1M) + Cu → Cu²⁺(1M) + Ag
(E°(Ag⁺/Ag) = +0.80 V, E°(Cu²⁺/Cu) = +0.34 V)
(A) +0.46 V
(B) −0.46 V
(C) +1.14 V
(D) −1.14 V
Answer: (A)
🔶 Q32. नर्न्स्ट समीकरण के अनुसार, EMF = E° − (0.0591/n) log Q. यदि n = 2 है, तो तापमान क्या माना गया है?
(A) 25°C
(B) 0°C
(C) 100°C
(D) 50°C
Answer: (A)
🔶 Q33. विद्युत रासायनिक श्रेणी में सबसे शक्तिशाली अपचायक है:
(A) F⁻
(B) Li
(C) Cu
(D) Ag
Answer: (B)
🔶 Q34. यदि Cu²⁺ का सांद्रण 0.001 M हो, तो नर्न्स्ट समीकरण से E का मान होगा:
E = E° − 0.0591 log(1/[Cu²⁺])
(E° = 0.34 V)
(A) 0.16 V
(B) 0.52 V
(C) 0.40 V
(D) 0.28 V
Answer: (B)
🔶 Q35. यदि किसी गैल्वैनिक सेल में EMF शून्य हो जाए, तो इसका क्या अर्थ है?
(A) प्रतिक्रिया रुक जाती है
(B) प्रतिक्रिया तीव्र हो जाती है
(C) प्रतिक्रिया अनंत हो जाती है
(D) तापमान बढ़ता है
Answer: (A)
🔶 Q36. एक रिचार्जेबल सेल है:
(A) Zn-Carbon
(B) लेड एसिड
(C) Dry सेल
(D) Fused salt cell
Answer: (B)
🔶 Q37. यदि किसी सेल का EMF −0.50 V है, तो प्रतिक्रिया:
(A) स्वतःस्फूर्त होगी
(B) नहीं चलेगी
(C) अव्यवस्थित होगी
(D) अनंत वोल्टेज पर होगी
Answer: (B)
🔶 Q38. यदि किसी अपघटन कोशिका में धारा 0.5 A और समय 1930 सेकंड है, तो प्रवाहित कुल आवेश होगा:
(A) 965 C
(B) 96500 C
(C) 0.965 C
(D) 3860 C
Answer: (A)
🔶 Q39. नर्न्स्ट समीकरण में log Q शून्य होने पर:
(A) EMF = E°
(B) EMF = 0
(C) EMF अनंत
(D) EMF ऋणात्मक
Answer: (A)
🔶 Q40. 0.5 फ़ैराडे से Fe³⁺ आयन का कितना मोल Fe जमा होगा? (n = 3)
(A) 0.5 mol
(B) 0.33 mol
(C) 0.167 mol
(D) 0.25 mol
Answer: (C)
🔶 Q41. फ़ैराडे का नियम किस प्रकार की अभिक्रियाओं पर लागू होता है?
(A) थर्मल
(B) इलेक्ट्रोलिटिक
(C) प्रकाशीय
(D) परमाणु
Answer: (B)
🔶 Q42. यदि किसी प्रतिक्रिया में n = 3 और Q = 10 हो, तो नर्न्स्ट समीकरण का यह पद (0.0591/n) log Q का मान होगा:
(A) 0.0197
(B) 0.0591
(C) 0.0394
(D) 0.0305
Answer: (C)
🔶 Q43. गैल्वैनिक सेल में EMF घटने का कारण हो सकता है:
(A) तापमान वृद्धि
(B) सेल की आयु
(C) नमक पुल का अवरोध
(D) सभी
Answer: (D)
🔶 Q44. नर्न्स्ट समीकरण के अनुसार, यदि Q = 1 हो, तो:
(A) log Q = 0
(B) log Q = 1
(C) log Q = −1
(D) log Q = ∞
Answer: (A)
🔶 Q45. विद्युत अपघटन के समय यदि धारा 2 A हो और 30 मिनट प्रवाहित हो, तो कुल कुलॉम्ब कितने होंगे?
(A) 3600 C
(B) 1800 C
(C) 2400 C
(D) 36000 C
Answer: (A)
🔶 Q46. यदि Zn को Zn²⁺ में ऑक्सीकरण किया जाए, तो कितने इलेक्ट्रॉन मुक्त होंगे प्रति मोल?
(A) 1
(B) 2
(C) 3
(D) 0
Answer: (B)
🔶 Q47. विद्युत रासायनिक सेल में प्रवाहित आवेश को मापने की इकाई है:
(A) वोल्ट
(B) एम्पीयर
(C) कुलॉम्ब
(D) ओम
Answer: (C)
🔶 Q48. निम्न में से कौन-सा बैटरी में उपयोगी नहीं है?
(A) पुनः चार्ज क्षमता
(B) उच्च ऊर्जा घनत्व
(C) ज्वलनशीलता
(D) दीर्घकालीन स्थिरता
Answer: (C)
🔶 Q49. Cu और Zn के मध्य EMF को प्रभावित करेगा:
(A) Zn²⁺ का मोलरता
(B) तापमान
(C) इलेक्ट्रोड सतह
(D) उपरोक्त सभी
Answer: (D)
🔶 Q50. यदि किसी अपघटन सेल में 96500 C प्रवाहित हो, और जमा पदार्थ का तुल्यभार 32 हो, तो जमा द्रव्यमान:
(A) 32 g
(B) 64 g
(C) 16 g
(D) 96 g
Answer: (A)
————————————————————————————————————————————————————————————————————————————
दृश्य सामग्री
————————————————————————————————————————————————————————————————————————————
