Class 12 : Chemistry (Hindi) – Lesson 3.रासायनिक गतिकी
पाठ का विश्लेषण एवं विवेचन
🔵 प्रस्तावना:
रासायनिक बलगतिकी उस शाखा को कहते हैं जिसमें यह अध्ययन किया जाता है कि किसी रासायनिक अभिक्रिया की गति (rate) किन कारकों पर निर्भर करती है और अभिक्रिया किस प्रकार आगे बढ़ती है। यह न केवल अभिक्रिया की गति का मात्रात्मक विश्लेषण देती है, बल्कि तंत्र (mechanism) के माध्यम से अभिक्रिया की आन्तरिक प्रक्रिया भी स्पष्ट करती है।
🟢 अभिक्रिया की गति (Reaction Rate):
📍 अभिक्रिया की गति को इस रूप में परिभाषित किया जाता है —
किसी अभिकारक की एकाग्रता में समय के प्रति इकाई परिवर्तन अथवा किसी उत्पाद की एकाग्रता में समय के प्रति इकाई वृद्धि।
✳ गणितीय रूप:
Rate = −Δ[R]/Δt = +Δ[P]/Δt
यहाँ [R] अभिकारक की एकाग्रता तथा [P] उत्पाद की एकाग्रता को निरूपित करता है। ऋण चिह्न इसलिए लगाया जाता है क्योंकि अभिकारक की एकाग्रता घटती है।
📐 इकाई:
यदि एकाग्रता mol L⁻¹ में और समय सेकण्ड में मापा जाए, तो गति की इकाई mol L⁻¹ s⁻¹ होती है।
🟡 क्षणिक गति (Instantaneous Rate):
यदि समय-अन्तराल अत्यन्त सूक्ष्म हो (Δt → 0), तो
Rate = −d[R]/dt = +d[P]/dt
यह किसी विशेष क्षण पर अभिक्रिया की वास्तविक गति को दर्शाता है।
🔵 अभिक्रिया की औसत गति (Average Rate):
यदि Δt का मान बड़ा हो, तो वह औसत गति कहलाती है —
Rate_avg = Δx/Δt
जहाँ Δx किसी पदार्थ की एकाग्रता में परिवर्तन है।
🟢 गति को प्रभावित करने वाले कारक:
1️⃣ अभिकारकों की एकाग्रता:
अभिकारकों की एकाग्रता बढ़ने पर टकरावों की संख्या बढ़ती है, अतः गति बढ़ती है।
2️⃣ तापमान:
तापमान बढ़ाने से अभिक्रिया की गति सामान्यतः बढ़ जाती है, क्योंकि उच्च ताप पर अधिक कणों के पास सक्रियण ऊर्जा से अधिक ऊर्जा होती है।
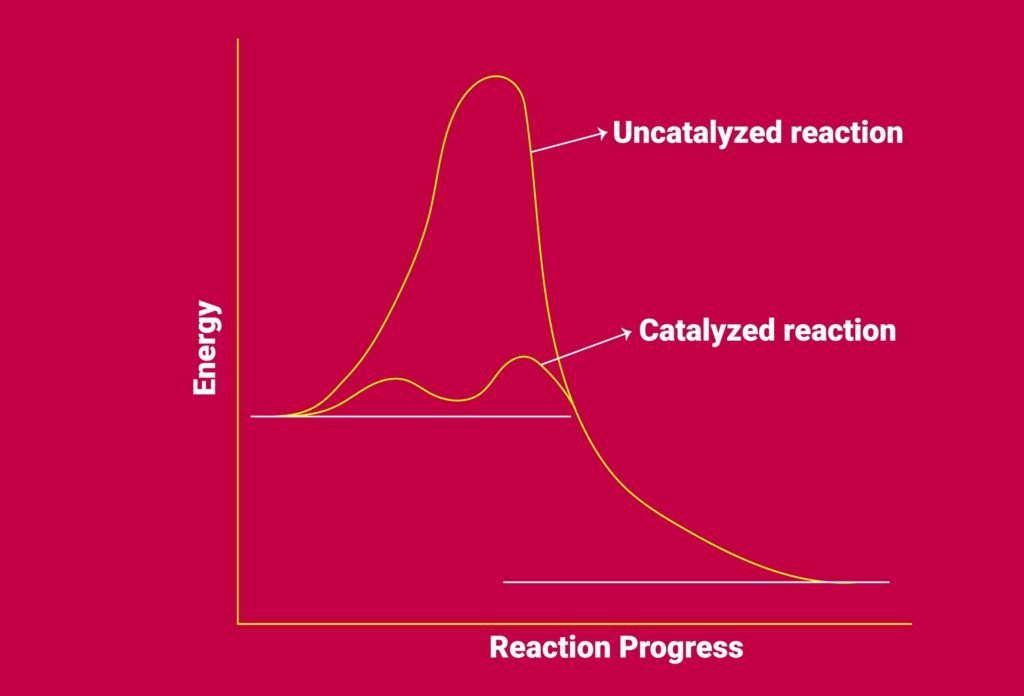
3️⃣ उत्प्रेरक:
उत्प्रेरक अभिक्रिया की गति को बढ़ाता या घटाता है, परन्तु स्वयं स्थायी रूप से नहीं बदलता। यह सक्रियण ऊर्जा घटाकर वैकल्पिक मार्ग प्रदान करता है।
4️⃣ अभिकारक की प्रकृति:
किसी तत्वीय या आयनिक यौगिक की संरचना, बन्धन, एवं अवस्था गति को प्रभावित करते हैं।
5️⃣ सतह क्षेत्रफल:
ठोस अभिकारकों के छोटे कणों का सतह क्षेत्र अधिक होता है, अतः गति बढ़ जाती है।
6️⃣ माध्यम एवं दाब:
गैसीय अभिक्रियाओं में दाब का प्रभाव एकाग्रता जैसा होता है; दाब बढ़ाने पर गति बढ़ती है।
🟡 गति समीकरण (Rate Law):
📘 गति समीकरण वह गणितीय समीकरण है जो अभिक्रिया की गति को अभिकारकों की एकाग्रता पर निर्भरता से जोड़ता है।
यदि अभिक्रिया है:
aA + bB → उत्पाद
तो गति समीकरण होगा:
Rate = k[A]^x [B]^y
जहाँ,
k = गति नियतांक (Rate constant)
x, y = क्रम (order)
🔵 गति का क्रम (Order of Reaction):
किसी अभिक्रिया का क्रम वह घातों का योग है जिनसे अभिकारकों की एकाग्रताएँ गति समीकरण में गुणित की जाती हैं।
Order = x + y
✔ यह प्रयोगात्मक रूप से निर्धारित किया जाता है, न कि सन्तुलित समीकरण से।
📌 क्रम के प्रकार:
शून्य क्रम अभिक्रिया: Rate ∝ [R]^0
प्रथम क्रम अभिक्रिया: Rate ∝ [R]^1
द्वितीय क्रम अभिक्रिया: Rate ∝ [R]^2
🟢 गति नियतांक (Rate Constant, k):
यह वह अनुपात नियतांक है जो गति समीकरण में प्रयुक्त होता है। किसी निश्चित ताप पर किसी निश्चित अभिक्रिया के लिए इसका मान नियत रहता है।
✳ इकाई:
यदि अभिक्रिया प्रथम क्रम की हो, तो k की इकाई s⁻¹
द्वितीय क्रम में L mol⁻¹ s⁻¹
शून्य क्रम में mol L⁻¹ s⁻¹
🟡 एकीकृत गति समीकरण (Integrated Rate Law):
🔹 शून्य क्रम अभिक्रिया:
Rate = k
[A]t = [A]₀ − kt
🔹 प्रथम क्रम अभिक्रिया:
Rate = k[A]
log([A]₀/[A]t) = (k/2.303) t
🔹 द्वितीय क्रम अभिक्रिया:
1/[A]t = 1/[A]₀ + kt
इन समीकरणों से हम किसी भी समय पर एकाग्रता, k अथवा आधा जीवन (t₁/₂) ज्ञात कर सकते हैं।
🔵 आधा जीवन (Half Life):
किसी अभिक्रिया का आधा जीवन वह समय है जिसमें किसी अभिकारक की एकाग्रता अपने प्रारम्भिक मान के आधे तक घट जाती है।
✳ प्रथम क्रम के लिए:
t₁/₂ = 0.693 / k
📌 यह प्रारम्भिक एकाग्रता पर निर्भर नहीं होता।
✳ शून्य क्रम के लिए:
t₁/₂ = [A]₀ / 2k
✳ द्वितीय क्रम के लिए:
t₁/₂ = 1 / (k[A]₀)
🟢 अभिक्रिया तंत्र (Reaction Mechanism):
किसी अभिक्रिया के घटने की सूक्ष्म क्रमिक प्रक्रियाओं की शृंखला को अभिक्रिया तंत्र कहते हैं।
प्रत्येक सूक्ष्म चरण को प्राथमिक चरण कहा जाता है। इन चरणों में सबसे धीमी अभिक्रिया को दर-निर्धारक चरण (Rate Determining Step) कहा जाता है।
📍 उदाहरण:
2NO + O₂ → 2NO₂
प्रक्रिया हो सकती है —
(i) NO + O₂ → NO₃ (धीमी)
(ii) NO + NO₃ → 2NO₂ (तेज़)
पहला चरण दर-निर्धारक है।
🟡 टक्कर सिद्धान्त (Collision Theory):
💡 यह सिद्धान्त बताता है कि अभिक्रिया केवल उन्हीं टक्करों में घटती है जो पर्याप्त ऊर्जा और सही दिशा (orientation) के साथ होती हैं।
📐 महत्वपूर्ण बिन्दु:
टक्कर की आवृत्ति बढ़ाने से गति बढ़ती है।
परन्तु सभी टक्कर प्रभावी नहीं होतीं।
✔ प्रभावी टक्कर: केवल वही टक्कर अभिक्रिया उत्पन्न करती है जिसमें सक्रियण ऊर्जा से अधिक ऊर्जा होती है और सही अभिविन्यास हो।
🔵 सक्रियण ऊर्जा (Activation Energy):
वह न्यूनतम ऊर्जा जो अभिकारकों को उत्पाद में परिवर्तित होने हेतु चाहिए।
📐 ऊर्जा-चित्र में यह अभिकारक एवं संक्रमण अवस्था (Activated Complex) के बीच ऊर्जा-अन्तर द्वारा निरूपित होती है।
सक्रियण ऊर्जा जितनी कम होगी, गति उतनी तेज़ होगी।
🟢 आरहीनियस समीकरण (Arrhenius Equation):
यह समीकरण गति नियतांक और तापमान के सम्बन्ध को बताता है।
📐 समीकरण:
k = A e^(−Ea / RT)
जहाँ,
k = गति नियतांक
A = आवृत्ति नियतांक
Ea = सक्रियण ऊर्जा
R = गैस नियतांक
T = परास ताप (केल्विन में)
📍 लघुगणक रूप:
log k = log A − (Ea / 2.303R) (1/T)
✔ इसका उपयोग सक्रियण ऊर्जा ज्ञात करने में किया जाता है।
🟡 ऊर्जा प्रोफ़ाइल चित्र:
📌 x-अक्ष पर अभिक्रिया प्रगति, y-अक्ष पर ऊर्जा।
📍 अभिकारक, सक्रियण ऊर्जा शिखर और उत्पाद दर्शाए जाते हैं।
📍 उत्प्रेरक वाले मार्ग में सक्रियण ऊर्जा कम दर्शाई जाती है।
🔵 अभिक्रियाओं के प्रकार गति के अनुसार:
1️⃣ तेज़ अभिक्रियाएँ: विस्फोट, आयनीकरण आदि (मापना कठिन)।
2️⃣ धीमी अभिक्रियाएँ: जंग लगना, किण्वन आदि।
3️⃣ मध्यम गति वाली: अधिकांश प्रयोगशाला अभिक्रियाएँ।
🟢 अभिक्रिया क्रम और आण्विकता में भेद:
आधार अभिक्रिया क्रम आण्विकता
परिभाषा गति समीकरण में घातों का योग टकराने वाले अणुओं की संख्या
मान भिन्नात्मक भी हो सकता है सदैव पूर्णांक
निर्धारण प्रयोगात्मक सैद्धान्तिक (तंत्र पर आधारित)
🟡 उत्प्रेरण (Catalysis):
📘 उत्प्रेरक अभिक्रिया की गति को प्रभावित करता है और अंत में अपरिवर्तित रहता है।
✳ प्रकार:
समरूपी उत्प्रेरण: अभिकारक व उत्प्रेरक एक ही अवस्था में।
विषमरूपी उत्प्रेरण: विभिन्न अवस्थाओं में।
स्व-उत्प्रेरण: उत्पाद ही उत्प्रेरक का कार्य करता है।
📌 उदाहरण: MnO₂, 2H₂O₂ → 2H₂O + O₂
🟢 तापमान का प्रभाव (van’t Hoff नियम):
तापमान में प्रत्येक 10 °C वृद्धि पर गति लगभग 2-3 गुना बढ़ जाती है।
🟣 रासायनिक बलगतिकी का महत्त्व:
📍 उद्योगों में दर-नियन्त्रण हेतु।
📍 औषध निर्माण, ईंधन दहन, खाद्य संरक्षण आदि में।
📍 पर्यावरणीय रासायनिक प्रक्रियाओं के अध्ययन में।
🔹 II. पाठ का सारांश
🔵 रासायनिक बलगतिकी वह शाखा है जो अभिक्रिया की गति, उसे प्रभावित करने वाले कारकों और तंत्र का अध्ययन करती है।
🟢 अभिक्रिया की गति अभिकारकों की एकाग्रता, तापमान, उत्प्रेरक, सतह क्षेत्रफल और माध्यम पर निर्भर करती है।
🟡 गति समीकरण Rate = k[A]^x [B]^y द्वारा अभिक्रिया की गति को मात्रात्मक रूप से व्यक्त किया जाता है, जहाँ k गति नियतांक है।
🔴 क्रम (Order) घातों का योग है जबकि आण्विकता अभिक्रिया में टकराने वाले अणुओं की संख्या।
🔵 शून्य, प्रथम और द्वितीय क्रम अभिक्रियाओं के लिए एकीकृत समीकरण क्रमशः [A]t = [A]₀ − kt, log([A]₀/[A]t) = (k/2.303)t तथा 1/[A]t = 1/[A]₀ + kt हैं।
🟢 प्रथम क्रम का आधा जीवन t₁/₂ = 0.693/k प्रारम्भिक एकाग्रता से स्वतंत्र होता है।
🟡 टक्कर सिद्धान्त के अनुसार केवल वे टक्करें प्रभावी होती हैं जिनके पास सक्रियण ऊर्जा से अधिक ऊर्जा होती है और सही अभिविन्यास होता है।
🔴 आरहीनियस समीकरण k = A e^(−Ea/RT) गति नियतांक और तापमान के बीच सम्बन्ध स्थापित करता है तथा Ea सक्रियण ऊर्जा को निरूपित करता है।
🔵 उत्प्रेरक सक्रियण ऊर्जा घटाकर अभिक्रिया के लिए वैकल्पिक मार्ग प्रदान करता है।
🟢 रासायनिक बलगतिकी के सिद्धान्तों का उपयोग औद्योगिक प्रक्रियाओं, औषध-निर्माण और पर्यावरणीय नियंत्रण में किया जाता है।
🔹 III. त्वरित पुनरावलोकन
🔵 अभिक्रिया की गति समय के साथ एकाग्रता में परिवर्तन की दर है।
🟢 गति समीकरण Rate = k[A]^x[B]^y से क्रम व गति ज्ञात होती है।
🟡 एकीकृत समीकरणों से आधा जीवन निकाला जाता है; प्रथम क्रम हेतु t₁/₂ = 0.693/k।
🔴 टक्कर सिद्धान्त और सक्रियण ऊर्जा अभिक्रिया की संभावना तय करते हैं।
🔵 आरहीनियस समीकरण गति नियतांक व तापमान का सम्बन्ध बताता है।
🟢 उत्प्रेरक सक्रियण ऊर्जा घटाकर गति बढ़ाता है; यह स्थायी रूप से परिवर्तित नहीं होता।
🌟 रासायनिक बलगतिकी उद्योग, औषधि और पर्यावरण प्रक्रियाओं में अत्यन्त उपयोगी है।
————————————————————————————————————————————————————————————————————————————
पाठ्यपुस्तक के प्रश्न
🔴 प्रश्न 3.1:
निम्न अभिक्रियाओं के वेग व्यंजनों से उनकी अभिक्रिया कोटि तथा वेग स्थिरांक की इकाइयाँ ज्ञात कीजिए —
(i) 3NO(g) → N₂O(g)
वेग = k[NO]²
(ii) H₂O₂(aq) + 3I⁻(aq) + 2H⁺ → 2H₂O(l) + I₃⁻
वेग = k[H₂O₂][I⁻]
(iii) CH₃CHO(g) → CH₄(g) + CO(g)
वेग = k[CH₃CHO]³ᐟ²
(iv) C₂H₅Cl(g) → C₂H₄(g) + HCl(g)
वेग = k[C₂H₅Cl]
🔵 उत्तर:
➡ (i) वेग व्यंजन = k[NO]² ⇒ कोटि = 2
➡ वेग स्थिरांक की इकाई = mol⁻¹ L s⁻¹
➡ (ii) वेग व्यंजन = k[H₂O₂][I⁻] ⇒ कोटि = 2
➡ वेग स्थिरांक की इकाई = mol⁻¹ L s⁻¹
➡ (iii) वेग व्यंजन = k[CH₃CHO]³ᐟ² ⇒ कोटि = 3/2
➡ वेग स्थिरांक की इकाई = mol⁻¹ᐟ² L¹ᐟ² s⁻¹
➡ (iv) वेग व्यंजन = k[C₂H₅Cl] ⇒ कोटि = 1
➡ वेग स्थिरांक की इकाई = s⁻¹
✔ Final: प्रत्येक अभिक्रिया की कोटि एवं इकाई ऊपर दी गई हैं।
🔴 प्रश्न 3.2:
अभिक्रिया 2A + B → A₂B के लिए वेग = k[A]²[B]² जहाँ k का मान 2.0 × 10⁻⁶ mol⁻² L² s⁻¹ है। प्रारंभिक वेग ज्ञात कीजिए, जब [A] = 0.1 mol L⁻¹ तथा [B] = 0.2 mol L⁻¹ हो। साथ ही अभिक्रिया वेग की गणना कीजिए जब [A] का मान 0.06 mol L⁻¹ हो जाए।
🔵 उत्तर:
➡ वेग व्यंजन: v = k[A]²[B]²
➡ प्रथम स्थिति:
k = 2.0 × 10⁻⁶ mol⁻² L² s⁻¹
[A] = 0.1 mol L⁻¹
[B] = 0.2 mol L⁻¹
➡ v₁ = 2.0 × 10⁻⁶ × (0.1)² × (0.2)²
➡ v₁ = 2.0 × 10⁻⁶ × 0.01 × 0.04
➡ v₁ = 8.0 × 10⁻¹⁰ mol L⁻¹ s⁻¹
➡ दूसरी स्थिति: [A] = 0.06 mol L⁻¹
v₂ = 2.0 × 10⁻⁶ × (0.06)² × (0.2)²
➡ v₂ = 2.0 × 10⁻⁶ × 0.0036 × 0.04
➡ v₂ = 2.88 × 10⁻¹⁰ mol L⁻¹ s⁻¹
✔ Final: v₁ = 8.0 × 10⁻¹⁰ mol L⁻¹ s⁻¹, v₂ = 2.88 × 10⁻¹⁰ mol L⁻¹ s⁻¹
🔴 प्रश्न 3.3:
संपूर्ण सतह पर NH₃ का अपघटन शून्य कोटि की अभिक्रिया है। N₂ एवं H₂ के उत्पादन का दर स्थिरांक 2.5 × 10⁻⁴ mol L⁻¹ s⁻¹ है। 10 मिनट बाद बने N₂ की मात्रा ज्ञात कीजिए।
🔵 उत्तर:
➡ शून्य कोटि अभिक्रिया में दर = k = (Δ[N₂])/Δt
➡ Δ[N₂] = k × t
➡ k = 2.5 × 10⁻⁴ mol L⁻¹ s⁻¹
t = 10 मिनट = 600 s
➡ Δ[N₂] = 2.5 × 10⁻⁴ × 600 = 0.15 mol L⁻¹
✔ Final: 10 मिनट बाद बने N₂ की मात्रा = 0.15 mol L⁻¹
🔴 प्रश्न 3.4:
डाइमेथाइल ईथर के अपघटन से CH₄, H₂ तथा CO बनते हैं। इस अभिक्रिया का दर नियम समीकरण k[CH₃OCH₃]³ᐟ² है। अभिक्रिया बंद पात्र में की जाती है, तो अभिक्रिया का क्रम एवं कोटि बताइए।
🔵 उत्तर:
➡ वेग व्यंजन: v = k[CH₃OCH₃]³ᐟ²
➡ कोटि = 3/2 (भिन्नात्मक कोटि)
➡ अभिक्रिया का क्रम = 3/2
✔ Final: अभिक्रिया की कोटि एवं क्रम = 3/2
🔴 प्रश्न 3.5:
किसी अभिक्रिया के लिए एक अभिकारक द्वितीय कोटि का है। अभिक्रिया का वेग अभिकारक की सांद्रता के वर्ग के समानुपाती है। यदि अभिकारक की सांद्रता
(i) दोगुनी की जाए
(ii) आधी की जाए
तो वेग पर क्या प्रभाव पड़ेगा?
🔵 उत्तर:
➡ वेग ∝ [A]²
(i) [A] दोगुनी → (2A)² = 4A² ⇒ वेग 4 गुना
(ii) [A] आधी → (A/2)² = A²/4 ⇒ वेग 1/4 गुना
✔ Final: दोगुनी करने पर वेग 4 गुना, आधी करने पर 1/4 गुना
🔴 प्रश्न 3.6:
एक रिएक्टर पर ताप का प्रभाव पड़ता है। ताप के इस प्रभाव को गणितीय रूप से कैसे व्यक्त किया जा सकता है?
🔵 उत्तर:
➡ ताप का प्रभाव Arrhenius समीकरण द्वारा व्यक्त किया जाता है:
k = A e⁻ᴱᴀ/ᴿᵀ
जहाँ
A = आवृत्ति गुणांक
Eₐ = सक्रियण ऊर्जा
R = गैस स्थिरांक
T = तापमान (K में)
✔ Final: ताप और दर स्थिरांक का संबंध Arrhenius समीकरण द्वारा दिया जाता है।
🔴 प्रश्न 3.7:
ताप का दर पर क्या प्रभाव पड़ता है? दर (वेग) के इस प्रभाव को मात्रात्मक रूप से कैसे प्रदर्शित किया जा सकता है?
🔵 उत्तर:
➡ चरण 1 (सिद्धान्त): ताप बढ़ाने पर कणों की गतिज ऊर्जा बढ़ती है, अधिक टक्करों में पर्याप्त ऊर्जा होती है, इसीलिए अभिक्रिया का दर प्रायः बढ़ता है।
➡ चरण 2 (Arrhenius समीकरण): दर स्थिरांक k और ताप T के बीच संबंध
k = A × e^(−Eₐ/RT)
जहाँ A = आवृत्ति गुणांक, Eₐ = सक्रियण ऊर्जा, R = गैस स्थिरांक, T = K में ताप।
➡ चरण 3 (मात्रात्मक व्याख्या): T बढ़ने पर (−Eₐ/RT) का परिमाण घटता है, e^(−Eₐ/RT) बड़ा होता है ⇒ k बढ़ता है ⇒ दर v = k × (सांद्रताओं का गुणनफल) बढ़ता है।
✔ Final: ताप का प्रभाव Arrhenius समीकरण k = A e^(−Eₐ/RT) से मात्रात्मक रूप में व्यक्त किया जाता है; ताप बढ़ाने पर k तथा दर बढ़ते हैं।
🔴 प्रश्न 3.8:
एक प्रथम कोटि की अभिक्रिया के लिए निम्न आँकड़े दिये गये हैं—
t/s : 0, 30, 60, 90
[A]/mol L⁻¹ : 0.55, 0.31, 0.17, 0.085
30 से 60 सेकण्ड के समय-अन्तराल में औसत वेग की गणना कीजिए।
🔵 उत्तर:
➡ चरण 1 (परिभाषा): औसत वेग = −Δ[A]/Δt = ([A]₍₃₀₎ − [A]₍₆₀₎)/(60 − 30).
➡ चरण 2 (मान लगाना): [A]₍₃₀₎ = 0.31 mol L⁻¹, [A]₍₆₀₎ = 0.17 mol L⁻¹.
➡ चरण 3 (गणना): Δ[A] = 0.31 − 0.17 = 0.14 mol L⁻¹.
➡ चरण 4 (औसत वेग): v̄ = 0.14 / 30 = 4.67 × 10⁻³ mol L⁻¹ s⁻¹.
✔ Final: औसत वेग (30–60 s) = 4.67 × 10⁻³ mol L⁻¹ s⁻¹.
🔴 प्रश्न 3.9:
एक अभिक्रिया A के प्रति प्रथम तथा B के प्रति द्वितीय कोटि की है।
(i) वेग समीकरण लिखिए।
(ii) B की सांद्रता दोगुनी करने पर वेग पर क्या प्रभाव पड़ेगा?
(iii) A तथा B दोनों की सांद्रता दोगुनी करने पर वेग पर क्या प्रभाव पड़ेगा?
🔵 उत्तर:
➡ चरण 1 (वेग समीकरण): v = k[A]¹[B]².
➡ चरण 2 (केवल B दोगुना): v’/v = (B’/B)² = (2B/B)² = 2² = 4 ⇒ वेग 4 गुना।
➡ चरण 3 (A और B दोनों दोगुने): v’’/v = (A’/A)¹ × (B’/B)² = 2 × 2² = 8 ⇒ वेग 8 गुना।
✔ Final: (i) v = k[A][B]²; (ii) B दोगुना ⇒ वेग 4 गुना; (iii) A व B दोनों दोगुने ⇒ वेग 8 गुना।
🔴 प्रश्न 3.10:
A और B के मध्य अभिक्रिया में A तथा B की भिन्न-भिन्न प्रारम्भिक सांद्रताओं के लिए प्रारम्भिक वेग (r₀) नीचे दिये गये हैं। A तथा B के प्रति अभिक्रिया की कोटि क्या है?
A/mol L⁻¹ : 0.20, 0.20, 0.40
B/mol L⁻¹ : 0.30, 0.10, 0.05
r₀/mol L⁻¹ s⁻¹ : 5.07 × 10⁻⁵, 5.07 × 10⁻⁵, 1.43 × 10⁻⁴
🔵 उत्तर:
➡ चरण 1 (B की कोटि): प्र.1 और प्र.2 में A समान (0.20) पर B 0.30 → 0.10 (1/3) हुआ, पर r₀ समान रहा ⇒ B की कोटि 0।
➡ चरण 2 (A की कोटि): अब B का प्रभाव शून्य मानकर प्र.1 (A = 0.20) तथा प्र.3 (A = 0.40) की तुलना— A दोगुना; r₀ 5.07×10⁻⁵ → 1.43×10⁻⁴ (≈ 2.82 गुना)।
➡ 2^m = 2.82 ⇒ m = log(2.82)/log(2) ≈ 1.5 = 3/2.
➡ वेग नियम: r = k[A]^{3/2}.
➡ k की इकाई: (mol L⁻¹ s⁻¹)/(mol^{3/2} L^{−3/2}) = L^{1/2} mol^{−1/2} s⁻¹.
➡ k का मान (प्र.1 से): k = r₀ / A^{3/2} = (5.07×10⁻⁵)/(0.20^{3/2}).
➡ 0.20^{3/2} = 0.20 × √0.20 = 0.20 × 0.4472 = 0.08944.
➡ k = (5.07×10⁻⁵)/(0.08944) = 5.67 × 10⁻⁴ L^{1/2} mol^{−1/2} s⁻¹ (लगभग)।
✔ Final: B की कोटि = 0, A की कोटि = 3/2; r = k[A]^{3/2}, k ≈ 5.67 × 10⁻⁴ L^{1/2} mol^{−1/2} s⁻¹.
🔴 प्रश्न 3.11:
अभिक्रिया 2A + B → C + D की बलगतिकी के अध्ययन पर निम्न आँकड़े प्राप्त हुए। अभिक्रिया के लिए वेग नियम तथा वेग स्थिरांक (k) ज्ञात कीजिए।
प्रयोग : I, II, III
[A]/mol L⁻¹ : 0.1, 0.3, 0.3
[B]/mol L⁻¹ : 0.1, 0.2, 0.4
D के निर्माण का प्रारम्भिक वेग / mol L⁻¹ min⁻¹ : 6.0 × 10⁻³, 7.2 × 10⁻², 2.88 × 10⁻¹
🔵 उत्तर:
➡ चरण 1 (B की कोटि): II → III : A समान (0.3), B दोगुना (0.2→0.4), वेग 7.2×10⁻² → 2.88×10⁻¹ (4 गुना) ⇒ 2^n = 4 ⇒ n = 2.
➡ चरण 2 (A की कोटि): I → II : A तीन गुना (0.1→0.3), B दोगुना (0.1→0.2), वेग 12 गुना (6.0×10⁻³ → 7.2×10⁻²) ⇒ 3^m × 2^n = 12.
➡ n = 2 रखने पर: 3^m × 4 = 12 ⇒ 3^m = 3 ⇒ m = 1.
➡ वेग नियम: r = k[A]^1[B]^2.
➡ k (प्रयोग I से): k = r/(A × B²) = (6.0×10⁻³)/(0.1 × 0.1²)
➡ 0.1 × 0.1² = 0.001 ⇒ k = 6.0×10⁻³ / 0.001 = 6.0.
➡ इकाई: (mol L⁻¹ min⁻¹)/(mol³ L⁻³) = L² mol⁻² min⁻¹.
✔ Final: r = k[A][B]², k = 6.0 L² mol⁻² min⁻¹ (लगभग)।
🔴 प्रश्न 3.12:
A तथा B के मध्य अभिक्रिया A के प्रति प्रथम तथा B के प्रति शून्य कोटि है या नहीं—यह जाँचने हेतु निम्न प्रारम्भिक आँकड़े दिये गये हैं। A तथा B के प्रति कोटि तथा वेग स्थिरांक ज्ञात कीजिए।
प्रयोग : I, II, III, IV
[A]/mol L⁻¹ : 0.1, 0.2, 0.4, —
[B]/mol L⁻¹ : 0.1, 0.2, 0.4, 0.2
प्रारम्भिक वेग / mol L⁻¹ min⁻¹ : 2.0 × 10⁻², 4.0 × 10⁻², 8.0 × 10⁻², 2.0 × 10⁻²
🔵 उत्तर:
➡ चरण 1 (रुझान): I → II → III में A दुगुना करने पर वेग दुगुना; B भी बदला पर वेग पर उसका प्रभाव नहीं दिख रहा।
➡ चरण 2 (B की जाँच): I (B = 0.1) और IV (B = 0.2) पर वेग समान (2.0×10⁻²) ⇒ B के प्रति कोटि 0।
➡ चरण 3 (A की कोटि): I → II में A दुगुना, वेग दुगुना ⇒ m = 1।
➡ वेग नियम: r = k[A].
➡ k का मान (I से): k = r/[A] = (2.0×10⁻²)/(0.1) = 0.2 min⁻¹.
✔ Final: A के प्रति कोटि = 1, B के प्रति = 0; r = k[A], k = 0.2 min⁻¹।
🔴 प्रश्न 3.13:
प्रथम कोटि की अभिक्रिया के लिए समाकल वेग–समीकरण और अर्द्ध–आयु (t₁/₂) का व्यंजक प्राप्त कीजिए।
🔵 उत्तर:
➡ चरण 1 (वेग–नियम): प्रथम कोटि में −d[A]/dt = k[A]
➡ चरण 2 (चर अलग करना): d[A]/[A] = −k dt
➡ चरण 3 (समाकलन): ∫{A₀}^{A} d[A]/[A] = −k ∫{0}^{t} dt
➡ चरण 4 (सरलीकरण): ln(A) − ln(A₀) = −k t ⇒ ln(A₀/A) = k t
➡ चरण 5 (दशमलव लघुगणक): 2.303 log(A₀/A) = k t
➡ चरण 6 (अर्द्ध–आयु की परिभाषा): t = t₁/₂ पर A = A₀/2
➡ चरण 7 (मान रखना): 2.303 log(A₀/(A₀/2)) = k t₁/₂
➡ चरण 8 (परिणाम): 2.303 log 2 = k t₁/₂ ⇒ t₁/₂ = (0.693)/k
✔ Final: समाकल समीकरण 2.303 log(A₀/A) = k t तथा अर्द्ध–आयु t₁/₂ = 0.693/k
🔴 प्रश्न 3.14:
एक प्रथम कोटि अभिक्रिया के लिए k = 1.155 × 10⁻³ s⁻¹ है। अर्द्ध–आयु t₁/₂ ज्ञात कीजिए तथा यह बताइए कि प्रारम्भिक सांद्रता का चौथाई होने में कितना समय लगेगा।
🔵 उत्तर:
➡ चरण 1 (अर्द्ध–आयु): t₁/₂ = 0.693/k = 0.693 / (1.155×10⁻³) s
➡ चरण 2 (गणना): t₁/₂ = 600 s = 10 मिनट
➡ चरण 3 (चौथाई होने का समय): प्रथम कोटि में A₀ → A₀/4 का समय t = 2 t₁/₂
➡ चरण 4 (मान): t = 2 × 10 मिनट = 20 मिनट
✔ Final: t₁/₂ = 10 मिनट तथा A का चौथाई होने का समय = 20 मिनट
🔴 प्रश्न 3.15:
द्वितीय कोटि अभिक्रिया (2A → उत्पाद) के लिए समाकल समीकरण तथा अर्द्ध–आयु t₁/₂ का व्यंजक निकलिए। यदि k = 0.02 L mol⁻¹ min⁻¹ तथा प्रारम्भिक सांद्रता A₀ = 0.10 mol L⁻¹ हो, तो t₁/₂ ज्ञात कीजिए।
🔵 उत्तर:
➡ चरण 1 (वेग–नियम): −d[A]/dt = k[A]²
➡ चरण 2 (चर अलग करना): d[A]/[A]² = −k dt
➡ चरण 3 (समाकलन): ∫{A₀}^{A} d[A]/[A]² = −k ∫{0}^{t} dt
➡ चरण 4 (सरलीकरण): (1/A) − (1/A₀) = k t
➡ चरण 5 (t₁/₂ की परिभाषा): t = t₁/₂ पर A = A₀/2
➡ चरण 6 (मान रखना): (1/(A₀/2)) − (1/A₀) = k t₁/₂
➡ चरण 7 (परिणाम): (2/A₀ − 1/A₀) = 1/A₀ = k t₁/₂ ⇒ t₁/₂ = 1/(k A₀)
➡ चरण 8 (संख्यात्मक मान): t₁/₂ = 1 / (0.02 × 0.10) min = 1 / 0.002 min = 500 min
✔ Final: समाकल समीकरण (1/A) − (1/A₀) = k t; अर्द्ध–आयु t₁/₂ = 1/(k A₀) = 500 मिनट
🔴 प्रश्न 3.16:
दो विभिन्न तापों पर दर–स्थिरांकों के मान से सक्रियण ऊर्जा Eₐ ज्ञात कीजिए। दिए हैं: k₁ = 2.5 × 10⁻³ s⁻¹ (T₁ = 300 K), k₂ = 7.5 × 10⁻³ s⁻¹ (T₂ = 320 K)। R = 8.314 J mol⁻¹ K⁻¹।
🔵 उत्तर:
➡ चरण 1 (Arrhenius रूप): ln(k₂/k₁) = (Eₐ/R) (1/T₁ − 1/T₂)
➡ चरण 2 (मान रखना): ln(7.5×10⁻³ / 2.5×10⁻³) = (Eₐ/8.314) (1/300 − 1/320)
➡ चरण 3 (सरलीकरण): ln(3) = (Eₐ/8.314) × (20 / (300×320))
➡ चरण 4 (गणना): ln(3) = 1.0986; (1/300 − 1/320) = 1/4800 = 0.00020833
➡ चरण 5 (Eₐ): Eₐ = 8.314 × 1.0986 / 0.00020833 J mol⁻¹
➡ चरण 6 (मान): Eₐ ≈ 9.132 / 0.00020833 = 4.383 × 10⁴ J mol⁻¹
➡ चरण 7 (इकाई रूपान्तरण): Eₐ ≈ 43.8 kJ mol⁻¹
✔ Final: सक्रियण ऊर्जा Eₐ ≈ 43.8 kJ mol⁻¹
🔴 प्रश्न 3.17:
टक्कर सिद्धान्त के आधार पर रासायनिक अभिक्रिया–दर की व्याख्या कीजिए तथा ताप के प्रभाव का कारण बताइए।
🔵 उत्तर:
➡ चरण 1 (मूल विचार): अभिक्रिया तभी होती है जब कणों में प्रभावी टक्कर हो — अर्थात् पर्याप्त ऊर्जा तथा उपयुक्त ज्यामिति (उन्मुखीकरण)।
➡ चरण 2 (ऊर्जा शर्त): केवल वे टक्करे प्रभावी हैं जिनकी ऊर्जा ≥ सक्रियण ऊर्जा (Eₐ) हो।
➡ चरण 3 (उन्मुखीकरण कारक): समुचित उन्मुखीकरण की प्रायिकता एक गुणांक से व्यक्त की जाती है (पूर्व–घात कारक)।
➡ चरण 4 (दर व्यंजक): दर ∝ टक्कर–आवृत्ति × अंश(ऊर्जा ≥ Eₐ) × उन्मुखीकरण–कारक
➡ चरण 5 (ताप का प्रभाव): ताप बढ़ाने पर Maxwell–Boltzmann वितरण में उच्च–ऊर्जा कणों का अंश बढ़ता है ⇒ Eₐ से ऊपर वाले टक्करों की संख्या बढ़ती है ⇒ दर बढ़ती है।
➡ चरण 6 (Arrhenius संगति): यही कारण k = A e^(−Eₐ/RT) में T बढ़ने पर k बढ़ने से मेल खाता है।
✔ Final: टक्कर सिद्धान्त के अनुसार प्रभावी टक्करों (पर्याप्त ऊर्जा + उचित उन्मुखीकरण) की संख्या बढ़ने से दर बढ़ती है; ताप बढ़ाने से उच्च–ऊर्जा टक्करों का अंश बढ़ता है, अतः दर बढ़ती है।
🔴 प्रश्न 3.18:
छद्म–प्रथम कोटि अभिक्रिया क्या होती है? उपयुक्त उदाहरण सहित वेग–समीकरण लिखिए।
🔵 उत्तर:
➡ चरण 1 (परिभाषा): जब बहुकोटि अभिक्रिया में एक अभिकारक की सांद्रता को बहुत अधिक (लगभग स्थिर) रखा जाता है, तो वेग केवल अन्य अभिकारक पर निर्भर दिखता है; ऐसी अभिक्रिया छद्म–प्रथम कोटि कहलाती है।
➡ चरण 2 (उदाहरण): एस्टर का जल–अपघटन (अत्यधिक जल की उपस्थिति में)
➡ चरण 3 (मूल वेग–नियम): v = k[एस्टर][जल]
➡ चरण 4 (जल अत्यधिक): [जल] ≈ स्थिर ⇒ k’ = k[जल]
➡ चरण 5 (छद्म–प्रथम रूप): v = k’[एस्टर] (प्रथम कोटि जैसा)
➡ चरण 6 (समाकल रूप): 2.303 log([एस्टर]₀/[एस्टर]) = k’ t
✔ Final: अत्यधिक जल या अन्य अभिकारक को स्थिर रखकर बहुकोटि अभिक्रिया का वेग प्रथम–कोटि जैसा हो जाता है; v = k’[एस्टर], जहाँ k’ = kजल
🔴 प्रश्न 3.19:
प्रथम कोटि की अभिक्रिया के लिए दर स्थिरांक की गणना कीजिए जब 25% अभिकारक 30 मिनट में अभिक्रिया कर चुका है।
🔵 उत्तर:
➡ चरण 1 (समाकल समीकरण): k = (2.303 / t) × log(A₀ / A)
➡ चरण 2 (दिये गये मान): A₀ = 100%, A = 75% (क्योंकि 25% अभिक्रिया कर चुका है)
t = 30 मिनट
➡ चरण 3 (मान रखना): k = (2.303 / 30) × log(100 / 75)
➡ चरण 4 (लघुगणक): log(100/75) = log(1.333) = 0.1249
➡ चरण 5 (गणना): k = (2.303 × 0.1249) / 30 = 0.2876 / 30 = 9.59 × 10⁻³ min⁻¹
✔ Final: दर स्थिरांक k = 9.59 × 10⁻³ min⁻¹
🔴 प्रश्न 3.20:
प्रथम कोटि की अभिक्रिया के लिए दर स्थिरांक 6.93 × 10⁻³ s⁻¹ है। अभिकारक का कितना भाग 200 s में अभिक्रिया कर चुका होगा?
🔵 उत्तर:
➡ चरण 1 (समाकल समीकरण): k = (2.303 / t) × log(A₀ / A)
➡ चरण 2 (मान रखना): 6.93×10⁻³ = (2.303 / 200) × log(A₀ / A)
➡ चरण 3 (सरलीकरण): log(A₀ / A) = (6.93×10⁻³ × 200) / 2.303
➡ log(A₀ / A) = 1.386 / 2.303 = 0.602
➡ चरण 4 (A₀ / A): = antilog(0.602) = 4
➡ चरण 5 (A): A = A₀ / 4 ⇒ अभिक्रिया हुआ भाग = (A₀ − A) / A₀ = 3/4 = 0.75
✔ Final: 75% अभिकारक 200 सेकण्ड में अभिक्रिया कर चुका होगा।
🔴 प्रश्न 3.21:
एक द्वितीय कोटि की अभिक्रिया (2A → उत्पाद) के लिए दर स्थिरांक 0.5 L mol⁻¹ min⁻¹ है। यदि A₀ = 1 mol L⁻¹ हो, तो 2 मिनट में शेष A की सांद्रता ज्ञात कीजिए।
🔵 उत्तर:
➡ चरण 1 (समाकल समीकरण): (1/A) − (1/A₀) = k t
➡ चरण 2 (मान रखना): (1/A) − (1/1) = 0.5 × 2 = 1
➡ चरण 3 (सरलीकरण): (1/A) = 2 ⇒ A = 1/2 = 0.5 mol L⁻¹
✔ Final: 2 मिनट बाद A की सांद्रता = 0.5 mol L⁻¹
🔴 प्रश्न 3.22:
द्वितीय कोटि अभिक्रिया के लिए अर्द्ध–आयु t₁/₂ और प्रारम्भिक सांद्रता A₀ के मध्य क्या संबंध होता है?
🔵 उत्तर:
➡ चरण 1 (समाकल समीकरण): (1/A) − (1/A₀) = k t
➡ चरण 2 (t = t₁/₂ पर A = A₀/2): (1/(A₀/2)) − (1/A₀) = k t₁/₂
➡ चरण 3 (सरलीकरण): (2/A₀ − 1/A₀) = 1/A₀ = k t₁/₂
➡ चरण 4 (परिणाम): t₁/₂ = 1 / (k A₀)
✔ Final: t₁/₂ ∝ 1/A₀ (प्रारम्भिक सांद्रता बढ़ने पर अर्द्ध–आयु घटती है)
🔴 प्रश्न 3.23:
प्रथम कोटि और द्वितीय कोटि अभिक्रियाओं में अर्द्ध–आयु (t₁/₂) का प्रारम्भिक सांद्रता पर क्या प्रभाव पड़ता है?
🔵 उत्तर:
➡ प्रथम कोटि: t₁/₂ = 0.693 / k → A₀ से स्वतंत्र
➡ द्वितीय कोटि: t₁/₂ = 1 / (k A₀) → A₀ के व्युत्क्रमानुपाती
✔ Final: प्रथम कोटि में t₁/₂ स्थिर रहती है; द्वितीय कोटि में A₀ बढ़ाने पर t₁/₂ घटती है।
🔴 प्रश्न 3.24:
एक अभिक्रिया का दर स्थिरांक 300 K पर 1.5 × 10⁻³ s⁻¹ और 330 K पर 3.0 × 10⁻³ s⁻¹ है। सक्रियण ऊर्जा Eₐ ज्ञात कीजिए। (R = 8.314 J mol⁻¹ K⁻¹)
🔵 उत्तर:
➡ चरण 1 (Arrhenius समीकरण): ln(k₂/k₁) = (Eₐ/R)(1/T₁ − 1/T₂)
➡ चरण 2 (मान रखना): ln(3.0×10⁻³ / 1.5×10⁻³) = (Eₐ/8.314)(1/300 − 1/330)
➡ चरण 3 (सरलीकरण): ln(2) = 0.693; (1/300 − 1/330) = 30 / 99000 = 3.03×10⁻⁴
➡ चरण 4 (Eₐ): Eₐ = (8.314 × 0.693) / 3.03×10⁻⁴
➡ चरण 5 (गणना): Eₐ = 5.76 / 3.03×10⁻⁴ = 1.90 × 10⁴ J mol⁻¹
➡ चरण 6 (इकाई): ≈ 19.0 kJ mol⁻¹
✔ Final: सक्रियण ऊर्जा Eₐ ≈ 19.0 kJ mol⁻¹
🔴 प्रश्न 3.25:
शून्य–कोटि अभिक्रिया के लिए समाकल वेग–समीकरण प्राप्त कीजिए तथा उसकी अर्द्ध–आयु t₁/₂ का व्यंजक निकालिए। यह भी बताइए कि t₁/₂ प्रारम्भिक सांद्रता पर कैसे निर्भर करता है।
🔵 उत्तर:
➡ चरण 1: शून्य–कोटि में −d[A]/dt = k (दर स्थिरांक k पर निर्भर, [A] पर नहीं)
➡ चरण 2: चर अलग करना → d[A] = −k dt
➡ चरण 3: समाकलन (t = 0 पर [A] = A₀, t पर [A] = A)
A − A₀ = −k t
➡ चरण 4: समाकल समीकरण
A = A₀ − k t
➡ चरण 5: अर्द्ध–आयु परिभाषा (t = t₁/₂ पर A = A₀/2)
A₀/2 = A₀ − k t₁/₂
➡ चरण 6: सरलीकरण
k t₁/₂ = A₀/2
➡ चरण 7: परिणाम
t₁/₂ = A₀ / (2k)
➡ चरण 8: निष्कर्ष (निर्भरता)
t₁/₂ ∝ A₀ (अर्थात् प्रारम्भिक सांद्रता बढ़ाने पर अर्द्ध–आयु बढ़ती है)
✔ Final: समाकल समीकरण A = A₀ − k t; अर्द्ध–आयु t₁/₂ = A₀/(2k), जो A₀ पर सीधी निर्भर है।
🔴 प्रश्न 3.26:
प्रथम–कोटि अभिक्रिया के लिए विभिन्न t पर प्राप्त [A] के आँकड़ों से k ज्ञात करने की दो रेखीय पद्धतियाँ बताइए। यह भी बताइए कि ग्राफ़ का ढाल क्या होगा।
🔵 उत्तर:
➡ चरण 1: समाकल रूप (प्राकृतिक लघुगणक)
ln(A₀/A) = k t
➡ चरण 2: रेखीय रूप–1
ln A = ln A₀ − k t
ग्राफ़: ln A बनाम t → सीधी रेखा
➡ चरण 3: ढाल (पद्धति–1)
ढाल = −k, अव intercept = ln A₀
➡ चरण 4: समाकल रूप (दशमलव)
2.303 log(A₀/A) = k t
➡ चरण 5: रेखीय रूप–2
log A = log A₀ − (k/2.303) t
➡ चरण 6: ढाल (पद्धति–2)
ढाल = −k/2.303, अव intercept = log A₀
✔ Final: ग्राफ़ ln A बनाम t का ढाल −k तथा log A बनाम t का ढाल −k/2.303 होता है; दोनों रेखीय पद्धतियों से k निकाला जा सकता है।
🔴 प्रश्न 3.27:
Arrhenius समीकरण से सक्रियण ऊर्जा Eₐ का निर्धारण कैसे किया जाता है? दो तापों T₁, T₂ पर दर–स्थिरांक k₁, k₂ दिए हों तो Eₐ का व्यंजक लिखिए।
🔵 उत्तर:
➡ चरण 1: Arrhenius समीकरण
k = A e^(−Eₐ/RT)
➡ चरण 2: दोनों तापों पर अनुपात लेना
k₂/k₁ = e^{−Eₐ/RT₂} / e^{−Eₐ/RT₁} = e^{Eₐ/R (1/T₁ − 1/T₂)}
➡ चरण 3: प्राकृतिक लघुगणक
ln(k₂/k₁) = (Eₐ/R) (1/T₁ − 1/T₂)
➡ चरण 4: Eₐ का व्यंजक
Eₐ = R × ln(k₂/k₁) ÷ (1/T₁ − 1/T₂)
➡ चरण 5: व्यावहारिक रूप (दशमलव लघुगणक)
2.303 log(k₂/k₁) = (Eₐ/R) (1/T₁ − 1/T₂)
✔ Final: Eₐ = R ln(k₂/k₁) / (1/T₁ − 1/T₂); अथवा 2.303 R log(k₂/k₁) / (1/T₁ − 1/T₂)।
🔴 प्रश्न 3.28:
उत्प्रेरक का अभिक्रिया–दर पर क्या प्रभाव होता है? सक्रियण ऊर्जा के सन्दर्भ में स्पष्ट कीजिए और ऊष्मागतिक फलनों के सन्दर्भ में भी टिप्पणी कीजिए।
🔵 उत्तर:
➡ चरण 1: उत्प्रेरक नई निम्न–ऊर्जा मार्ग देता है
Eₐ (उत्प्रेरित) < Eₐ (अनुत्प्रेरित)
➡ चरण 2: Arrhenius के अनुसार Eₐ घटने से e^(−Eₐ/RT) का मान बढ़ता है ⇒ k बढ़ता है ⇒ दर बढ़ती है
➡ चरण 3: अग्र–पश्च दोनों दरों पर प्रभाव
उत्प्रेरक आगे–पीछे दोनों अभिक्रियाओं को समान गुणक से तीव्र करता है ⇒ संतुलन–स्थिरांक नहीं बदलता
➡ चरण 4: ऊष्मागतिक फलन
ΔG°, ΔH°, ΔS° (संतुलन पर) अपरिवर्तित; उत्प्रेरक केवल गतिकीय मार्ग बदलता है
➡ चरण 5: चयनात्मकता
उचित उत्प्रेरक चुनकर इच्छित उत्पाद की प्राप्ति बढ़ाई जा सकती है (उन्मुखीकरण/आबंधन के कारण)
✔ Final: उत्प्रेरक सक्रियण ऊर्जा घटाकर दर बढ़ाता है; ΔG°, ΔH°, ΔS° तथा संतुलन–स्थिरांक अपरिवर्तित रहते हैं—परिवर्तन केवल गतिकीय होता है।
🔴 प्रश्न 3.29:
छद्म–प्रथम–कोटि अभिक्रिया के एक उपयुक्त उदाहरण का समाकल रूप लिखिए और यह बताइए कि प्रायोगिक आँकड़ों से k’ कैसे निकाला जाता है।
🔵 उत्तर:
➡ चरण 1: मूल बहुकोटि रूप (उदाहरण: एस्टर का जल–अपघटन)
v = k[एस्टर][जल]
➡ चरण 2: [जल] बहुत अधिक ⇒ लगभग स्थिर
k’ = kजल, अतः v = k’[एस्टर]
➡ चरण 3: प्रथम–कोटि समाकल रूप
2.303 log([एस्टर]₀/[एस्टर]) = k’ t
➡ चरण 4: प्रायोगिक विधि
विभिन्न t पर [एस्टर] नापें; log([एस्टर]) बनाम t का ग्राफ़ सीधी रेखा देता है
➡ चरण 5: ढाल से k’
ढाल = −k’/2.303; अतः k’ = −2.303 × (ढाल)
✔ Final: v = k’[एस्टर], 2.303 log([एस्टर]₀/[एस्टर]) = k’ t; ग्राफ़ log[एस्टर] बनाम t की ढाल से k’ निकाला जाता है।
🔴 प्रश्न 3.30:
दर–नियन्त्रक चरण (सबसे धीमा चरण) की अवधारणा बताइए। बहु–चरणीय अभिक्रिया में समग्र वेग–नियम कैसे तय होता है—उपयुक्त उदाहरण सहित समझाइए।
🔵 उत्तर:
➡ चरण 1: बहु–चरणीय अभिक्रिया में विभिन्न प्राथमिक चरण क्रम से होते हैं; जिनमें से एक चरण सबसे धीमा होता है—इसी को दर–नियन्त्रक चरण कहा जाता है
➡ चरण 2: समग्र वेग–नियम का निर्धारण
समग्र दर मुख्यतः उसी धीमे चरण की आणविकता/आबंधनों पर निर्भर दिखती है; तेज चरणों का योगदान तुलनात्मक रूप से तात्कालिक माना जाता है
➡ चरण 3: उदाहरण (परिकल्पित)
A + B ⇌ I (तेज़, साम्य)
I + C → उत्पाद (धीमा, दर–नियन्त्रक)
➡ चरण 4: वेग–नियम लिखना
दर ≈ k[I][C] (धीमे चरण से)
➡ चरण 5: [I] का उन्मूलन (तेज़ साम्य से)
K = [I]/([A][B]) ⇒ [I] = K [A][B]
➡ चरण 6: समग्र वेग–नियम
दर = k K [A][B][C] = k_obs [A][B][C]
✔ Final: समग्र वेग–नियम दर–नियन्त्रक (सबसे धीमे) चरण और तेज चरणों से प्राप्त मध्यवर्तियों के उन्मूलन पर निर्भर होता है; ऊपर के उदाहरण में दर ∝ [A][B][C]।
————————————————————————————————————————————————————————————————————————————
अन्य महत्वपूर्ण प्रश्न
(CBSE MODEL प्रश्न पत्र)
सिर्फ इसी पाठ से निर्मित CBSE MODEL प्रश्न पत्र।
✳ खण्ड – A (बहुविकल्पीय प्रश्न: 1 × 16 = 16 अंक)
प्रश्न 1. रासायनिक बलगतिकी का अध्ययन निम्न में से किससे सम्बन्धित है?
अभिक्रिया की ऊष्मा
अभिक्रिया की गति
संतुलन स्थिरांक
ताप प्रभाव
उत्तर: 2
प्रश्न 2. अभिक्रिया की औसत गति ज्ञात की जाती है —
अभिकारक या उत्पाद की सांद्रता के परिवर्तन से
केवल तापमान के परिवर्तन से
केवल आयतन से
दाब से
उत्तर: 1
प्रश्न 3. अभिक्रिया की तात्कालिक गति ज्ञात की जाती है —
ग्राफ द्वारा
ऊष्मा द्वारा
दाब से
उत्प्रेरक से
उत्तर: 1
प्रश्न 4. अभिक्रिया की गति का सूत्र है —
Rate = k[A][B]
Rate = k[A]ᵃ[B]ᵇ
Rate = [A]/[B]
Rate = kT
उत्तर: 2
प्रश्न 5. गति नियतांक (k) की इकाई निर्भर करती है —
तापमान पर
अभिक्रिया की कोटि पर
दाब पर
उत्प्रेरक पर
उत्तर: 2
प्रश्न 6. यदि किसी अभिक्रिया की गति = k[A]² है, तो यह किस कोटि की अभिक्रिया है?
प्रथम कोटि
द्वितीय कोटि
तृतीय कोटि
शून्य कोटि
उत्तर: 2
प्रश्न 7. प्रथम कोटि अभिक्रिया के लिए अर्ध-आयु (t₁/₂) = ?
0.693/k
1/k
k/0.693
2k
उत्तर: 1
प्रश्न 8. शून्य कोटि अभिक्रिया में गति नियतांक (k) की इकाई होती है —
mol·L⁻¹·s⁻¹
s⁻¹
L·mol⁻¹·s⁻¹
कोई नहीं
उत्तर: 1
प्रश्न 9. तापमान बढ़ाने से अभिक्रिया की गति बढ़ती है क्योंकि —
सक्रियण ऊर्जा घटती है
अणुओं की टक्करों की आवृत्ति बढ़ती है
दाब घटता है
उत्पाद की मात्रा घटती है
उत्तर: 2
प्रश्न 10. आरहेनियस समीकरण है —
k = A e^(-Ea/RT)
k = A + Ea/RT
k = Ea e^(-A/RT)
k = RT/Ea
उत्तर: 1
प्रश्न 11. सक्रियण ऊर्जा (Ea) का मात्रक है —
L·mol⁻¹
kJ·mol⁻¹
mol·L⁻¹·s⁻¹
s⁻¹
उत्तर: 2
प्रश्न 12. यदि Ea अधिक है, तो अभिक्रिया की गति —
अधिक होगी
कम होगी
समान रहेगी
प्रभावित नहीं होगी
उत्तर: 2
प्रश्न 13. उत्प्रेरक अभिक्रिया की गति को —
कम करता है
बढ़ाता है
स्थिर रखता है
रोक देता है
उत्तर: 2
प्रश्न 14. उत्प्रेरक अभिक्रिया की किस अवस्था को बदलता है?
ऊष्मीय अवस्था
सक्रियण ऊर्जा
अभिकारकों की सांद्रता
दाब
उत्तर: 2
Options (A/R प्रकार के प्रश्नों हेतु)
A और R दोनों सत्य हैं तथा R, A का सही व्याख्यान है।
A और R दोनों सत्य हैं परन्तु R, A का सही व्याख्यान नहीं है।
A सत्य है, R असत्य है।
A असत्य है, R सत्य है।
प्रश्न 15.
A: तापमान बढ़ाने से अभिक्रिया की गति बढ़ जाती है।
R: तापमान बढ़ाने पर सक्रियण ऊर्जा बढ़ जाती है।
उत्तर: 3
प्रश्न 16.
A: उत्प्रेरक, अभिक्रिया के संतुलन को बदल देता है।
R: उत्प्रेरक केवल गति को प्रभावित करता है, संतुलन स्थिति को नहीं।
उत्तर: 4
✳ खण्ड – B (अति लघु उत्तर प्रश्न: 2 × 5 = 10 अंक)
प्रश्न 17. अभिक्रिया की औसत गति को परिभाषित कीजिए।
🟦 परिभाषा — किसी निश्चित समयांतराल में अभिकारक की सांद्रता में हुए परिवर्तन को औसत गति कहते हैं।
🟩 सूत्र — Rate(avg) = -Δ[A]/Δt या Δ[B]/Δt
प्रश्न 18. शून्य कोटि और प्रथम कोटि अभिक्रिया में एक अन्तर लिखिए।
🔶 शून्य कोटि — गति अभिकारक की सांद्रता पर निर्भर नहीं करती।
🔷 प्रथम कोटि — गति ∝ [A]
प्रश्न 19. प्रथम कोटि अभिक्रिया का एक उदाहरण दीजिए।
🧪 रेडियोधर्मी क्षय (Radioactive decay) एक प्रथम कोटि अभिक्रिया है।
🟦 उदाहरण — N₂O₅ → 2NO₂ + ½O₂
प्रश्न 20. तापमान का अभिक्रिया की गति पर क्या प्रभाव होता है?
🟩 तापमान बढ़ाने पर गति बढ़ती है।
🟦 कारण — अणुओं की टक्कर की आवृत्ति और ऊर्जा बढ़ती है जिससे अधिक अणु सक्रियण ऊर्जा पार कर पाते हैं।
प्रश्न 21. उत्प्रेरक का कार्य सिद्धान्त क्या है?
🧪 उत्प्रेरक अभिक्रिया का वैकल्पिक मार्ग देता है जिसकी सक्रियण ऊर्जा कम होती है।
🎯 अतः अभिक्रिया तीव्र हो जाती है, परन्तु उत्प्रेरक का द्रव्यमान स्थिर रहता है।
✳ खण्ड – C (संक्षिप्त उत्तर प्रश्न: 3 × 7 = 21 अंक)
प्रश्न 22. प्रथम कोटि अभिक्रिया के गति समीकरण का व्युत्पादन कीजिए।
➤ प्रारम्भिक सांद्रता = a, समय t पर = (a – x)
➜ Rate = -d[A]/dt = k[A]
📌 समाकलन करने पर —
ln(a/(a – x)) = kt
✅ अतः k = (1/t) ln(a/(a – x))
प्रश्न 23. शून्य कोटि अभिक्रिया की अर्ध-आयु का सूत्र ज्ञात कीजिए।
➤ समीकरण: [A] = [A]₀ – kt
🧮 अर्ध-आयु पर [A] = [A]₀/2
🟦 अतः t₁/₂ = [A]₀ / (2k)
प्रश्न 24. द्वितीय कोटि अभिक्रिया की विशेषता लिखिए।
🟩 गति ∝ [A]² या [A][B]
🧪 गति नियतांक की इकाई — L·mol⁻¹·s⁻¹
🎯 ग्राफ: 1/[A] बनाम t एक सीधी रेखा देता है।
प्रश्न 25. सक्रियण ऊर्जा का अभिक्रिया पर प्रभाव स्पष्ट कीजिए।
🟦 सक्रियण ऊर्जा वह न्यूनतम ऊर्जा है जो अभिक्रिया आरम्भ हेतु आवश्यक होती है।
🧪 Ea अधिक → अभिक्रिया धीमी
🧪 Ea कम → अभिक्रिया तीव्र
प्रश्न 26. आरहेनियस समीकरण से k और T के बीच सम्बन्ध स्थापित कीजिए।
🧪 समीकरण — k = A e^(-Ea/RT)
➤ log k = log A – (Ea/2.303R)(1/T)
🎯 ग्राफ log k बनाम 1/T एक ऋणात्मक ढाल वाली सीधी रेखा देता है, जिससे Ea ज्ञात की जाती है।
प्रश्न 27. टक्कर सिद्धान्त के मुख्य बिंदु बताइए।
🟦 अभिक्रिया तभी होती है जब अणु पर्याप्त ऊर्जा और सही दिशा से टकराते हैं।
🧪 सभी टक्करे प्रभावी नहीं होतीं।
🎯 प्रभावी टक्करें उत्पाद निर्माण कर सकती हैं।
प्रश्न 28. उत्प्रेरक का एक उदाहरण दीजिए और उसका प्रभाव बताइए।
🧪 उदाहरण — MnO₂, H₂O₂ के अपघटन में।
🟩 MnO₂, सक्रियण ऊर्जा घटाकर गति बढ़ाता है।
🎯 उत्पाद — H₂O + O₂ तीव्रता से बनते हैं।
प्रश्न 29.
नीचे दिये गये अनुच्छेद को पढ़कर पूछे गये प्रश्नों के उत्तर दीजिए —
हाइड्रोजन पेरॉक्साइड (H₂O₂) का अपघटन, प्रथम कोटि अभिक्रिया का उदाहरण है। इसका अपघटन जल तथा ऑक्सीजन में होता है। MnO₂ उत्प्रेरक की उपस्थिति में यह अभिक्रिया तीव्र गति से होती है। तापमान बढ़ाने पर इसकी गति और अधिक बढ़ जाती है।
(क) यह अभिक्रिया किस कोटि की है?
🟦 उत्तर — प्रथम कोटि अभिक्रिया।
(ख) MnO₂ का क्या प्रभाव है?
🟩 MnO₂ सक्रियण ऊर्जा घटाकर अभिक्रिया की गति बढ़ाता है।
(ग) यदि तापमान बढ़ाया जाए तो गति पर क्या प्रभाव होगा?
🎯 तापमान बढ़ाने पर गति नियतांक k बढ़ जाता है, जिससे अभिक्रिया तीव्र हो जाती है।
(घ) सक्रियण ऊर्जा घटने का अभिक्रिया पर क्या प्रभाव पड़ता है?
🧪 सक्रियण ऊर्जा कम होने से अधिक अणु प्रभावी टक्करें करते हैं, अतः उत्पाद शीघ्र बनते हैं।
प्रश्न 30.
निम्न आँकड़ों का उपयोग कर सक्रियण ऊर्जा ज्ञात कीजिए —
तापमान (K) गति नियतांक (k) (s⁻¹)
300 2.0 × 10⁻³
310 4.0 × 10⁻³
दिया है — R = 8.314 J·mol⁻¹·K⁻¹
➤ आरहेनियस समीकरण — log(k₂/k₁) = (Ea / 2.303R) × (T₂ – T₁) / (T₁T₂)
➜ log(4.0×10⁻³ / 2.0×10⁻³) = (Ea / 2.303×8.314) × (10 / 300×310)
➜ log 2 = (Ea / 19.147) × (10 / 93000)
➜ 0.3010 = Ea × (10 / 1.78×10⁶)
✅ Ea = 0.3010 × (1.78×10⁶ / 10)
🎯 Ea ≈ 5.36×10⁴ J·mol⁻¹ = 53.6 kJ·mol⁻¹
✳ खण्ड – E (दीर्घ उत्तर प्रश्न: 5 × 3 = 15 अंक)
प्रश्न 31.
प्रथम कोटि अभिक्रिया के अर्ध-आयु सूत्र का व्युत्पादन कीजिए।
🟦 प्रारम्भिक सांद्रता = a, t समय पर = (a – x)
🧪 Rate = -d[A]/dt = k[A]
➤ समाकलन के बाद — ln(a/(a – x)) = kt
🧮 अर्ध-आयु पर x = a/2
🎯 k t₁/₂ = ln2 = 0.693
✅ t₁/₂ = 0.693 / k
या (OR)
आरहेनियस समीकरण से यह दिखाइए कि तापमान बढ़ाने पर अभिक्रिया की गति क्यों बढ़ती है।
🧪 समीकरण — k = A e^(-Ea/RT)
🎯 T बढ़ाने से (-Ea/RT) का मान घटता है ⇒ e^(-Ea/RT) बढ़ता है ⇒ k बढ़ता है।
इस प्रकार गति नियतांक बढ़ने से अभिक्रिया की गति बढ़ती है।
प्रश्न 32.
टक्कर सिद्धान्त का विस्तृत वर्णन कीजिए।
🟩 मुख्य बिंदु —
➤ अभिक्रिया तब होती है जब अणु पर्याप्त ऊर्जा और सही दिशा से टकराएँ।
➤ केवल प्रभावी टक्करें उत्पाद बनाती हैं।
➤ सक्रियण ऊर्जा (Ea) न्यूनतम आवश्यक ऊर्जा है।
🧪 अभिक्रिया की गति ∝ प्रभावी टक्करों की संख्या।
🎯 उत्प्रेरक, Ea घटाकर प्रभावी टक्करों की संख्या बढ़ा देता है।
या (OR)
अभिक्रिया की गति को प्रभावित करने वाले चार कारकों का वर्णन कीजिए।
🟦 (1) तापमान — बढ़ने पर गति बढ़ती है।
🟩 (2) अभिकारकों की सांद्रता — अधिक होने पर टक्करें बढ़ती हैं।
🟨 (3) उत्प्रेरक — सक्रियण ऊर्जा घटाता है।
🟪 (4) दाब — गैसीय अभिक्रियाओं में दाब बढ़ाने से गति बढ़ती है।
प्रश्न 33.
यदि किसी अभिक्रिया की गति नियतांक 300 K पर 2×10⁻³ s⁻¹ तथा 330 K पर 4×10⁻² s⁻¹ है, तो सक्रियण ऊर्जा ज्ञात कीजिए।
दिया है: R = 8.314 J·mol⁻¹·K⁻¹
➤ सूत्र: log(k₂/k₁) = (Ea / 2.303R) × (T₂ – T₁) / (T₁T₂)
➜ log(4×10⁻² / 2×10⁻³) = (Ea / 19.147) × (30 / 99000)
➜ log 20 = 1.3010 = Ea × (30 / 1.89×10⁶)
🧮 Ea = 1.3010 × (1.89×10⁶ / 30) = 8.20×10⁴ J·mol⁻¹
✅ Ea = 82.0 kJ·mol⁻¹
या (OR)
प्रथम कोटि अभिक्रिया का उदाहरण देकर उसका गणितीय विश्लेषण कीजिए।
🟦 उदाहरण — N₂O₅ → 2NO₂ + ½O₂
🧪 Rate = k[N₂O₅]
➜ k = (1/t) ln(a/(a – x))
🎯 ग्राफ ln(a/(a – x)) बनाम t एक सीधी रेखा देता है जिसकी ढाल = k
✅ यह प्रथम कोटि अभिक्रिया का प्रमुख लक्षण है।
————————————————————————————————————————————————————————————————————————————
Neet पिछले सालों के प्रश्न
🔵 प्रश्न 1: किसी अभिक्रिया की दर किस पर निर्भर करती है?
🔴 ① केवल तापमान पर
🟢 ② केवल अभिकारकों की सांद्रता पर
🟡 ③ अभिकारकों की सांद्रता एवं तापमान दोनों पर
🔵 ④ केवल दाब पर
🟢 उत्तर: ③ अभिकारकों की सांद्रता एवं तापमान दोनों पर
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: R-2
🔵 प्रश्न 2: दर नियतांक का आयाम प्रथम कोटि अभिक्रिया के लिए क्या होगा?
🔴 ① mol L⁻¹ s⁻¹
🟢 ② s⁻¹
🟡 ③ mol⁻¹ L s⁻¹
🔵 ④ L mol⁻¹ s⁻²
🟢 उत्तर: ② s⁻¹
📘 परीक्षा: AIPMT
📅 वर्ष: 2013 | सेट: M
🔵 प्रश्न 3: शून्य कोटि अभिक्रिया में दर नियतांक का आयाम क्या होगा?
🔴 ① mol L⁻¹ s⁻¹
🟢 ② s⁻¹
🟡 ③ mol⁻¹ L s⁻¹
🔵 ④ mol⁻² L² s⁻¹
🟢 उत्तर: ① mol L⁻¹ s⁻¹
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: S-1
🔵 प्रश्न 4: यदि किसी अभिक्रिया का अर्धायु 10 मिनट है, तो वह किस कोटि की होगी?
🔴 ① प्रथम कोटि
🟢 ② द्वितीय कोटि
🟡 ③ शून्य कोटि
🔵 ④ तृतीय कोटि
🟢 उत्तर: ① प्रथम कोटि
📘 परीक्षा: NEET
📅 वर्ष: 2015 | सेट: Q
🔵 प्रश्न 5: दर विधि दर = k[A]²[B] द्वारा दी गई है, तो अभिक्रिया का कुल कोटि क्या है?
🔴 ① 1
🟢 ② 2
🟡 ③ 3
🔵 ④ 4
🟢 उत्तर: ③ 3
📘 परीक्षा: AIPMT
📅 वर्ष: 2012 | सेट: P
🔵 प्रश्न 6: अर्धायु किस कोटि की अभिक्रिया में सांद्रता पर निर्भर नहीं करती?
🔴 ① शून्य कोटि
🟢 ② प्रथम कोटि
🟡 ③ द्वितीय कोटि
🔵 ④ तृतीय कोटि
🟢 उत्तर: ② प्रथम कोटि
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: Q-2
🔵 प्रश्न 7: दर नियतांक का मान बढ़ाने हेतु कौन-सा कारक उपयुक्त है?
🔴 ① तापमान घटाना
🟢 ② उत्प्रेरक जोड़ना
🟡 ③ दाब घटाना
🔵 ④ अभिकारक की सांद्रता घटाना
🟢 उत्तर: ② उत्प्रेरक जोड़ना
📘 परीक्षा: PMT
📅 वर्ष: 2011 | सेट: C
🔵 प्रश्न 8: आरेनियस समीकरण में k = A e^(-Ea/RT) में Ea क्या है?
🔴 ① दर नियतांक
🟢 ② सक्रियण ऊर्जा
🟡 ③ सार्वत्रिक स्थिरांक
🔵 ④ तापमान
🟢 उत्तर: ② सक्रियण ऊर्जा
📘 परीक्षा: NEET
📅 वर्ष: 2022 | सेट: Q-2
🔵 प्रश्न 9: यदि तापमान बढ़ाने से दर नियतांक दुगुना हो जाता है, तो दर स्थिरांक पर इसका प्रभाव क्या है?
🔴 ① घटता है
🟢 ② बढ़ता है
🟡 ③ अपरिवर्तित रहता है
🔵 ④ शून्य हो जाता है
🟢 उत्तर: ② बढ़ता है
📘 परीक्षा: AIPMT
📅 वर्ष: 2011 | सेट: N
🔵 प्रश्न 10: प्रथम कोटि अभिक्रिया का समय-नियम है —
🔴 ① k = (1/t) ln(a/a-x)
🟢 ② k = (2.303/t) log(a/(a-x))
🟡 ③ k = (1/t)(a/x)
🔵 ④ k = (x/t)
🟢 उत्तर: ② k = (2.303/t) log(a/(a-x))
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: R-3
🔵 प्रश्न 11: शून्य कोटि अभिक्रिया के लिए समय-नियम क्या है?
🔴 ① a – x = kt
🟢 ② x = kt
🟡 ③ a – x = a e^(-kt)
🔵 ④ x = a(1 – e^(-kt))
🟢 उत्तर: ② x = kt
📘 परीक्षा: PMT
📅 वर्ष: 2009 | सेट: B
🔵 प्रश्न 12: अभिक्रिया के दौरान दर में परिवर्तन का कारण क्या है?
🔴 ① अभिकारकों की सांद्रता में परिवर्तन
🟢 ② उत्प्रेरक की प्रकृति
🟡 ③ उत्पाद की स्थिरता
🔵 ④ विलायक का घनत्व
🟢 उत्तर: ① अभिकारकों की सांद्रता में परिवर्तन
📘 परीक्षा: NEET
📅 वर्ष: 2014 | सेट: Q-2
🔵 प्रश्न 13: तापमान में वृद्धि दर को क्यों बढ़ाती है?
🔴 ① Ea घट जाती है
🟢 ② अधिक अणु आवश्यक सक्रियण ऊर्जा प्राप्त कर लेते हैं
🟡 ③ टकराव घट जाते हैं
🔵 ④ उत्प्रेरक निष्क्रिय हो जाता है
🟢 उत्तर: ② अधिक अणु आवश्यक सक्रियण ऊर्जा प्राप्त कर लेते हैं
📘 परीक्षा: AIPMT
📅 वर्ष: 2010 | सेट: L
🔵 प्रश्न 14: यदि दर नियतांक 300 K पर 0.02 s⁻¹ है और 310 K पर 0.04 s⁻¹, तो तापीय गुणांक Q₁₀ = ?
🔴 ① 1
🟢 ② 2
🟡 ③ 4
🔵 ④ 10
🟢 उत्तर: ② 2
📘 परीक्षा: NEET
📅 वर्ष: 2020 | सेट: P-1
🔵 प्रश्न 15: निम्न में से कौन-सी अभिक्रिया तात्विक अभिक्रिया है?
🔴 ① H₂ + I₂ → 2HI
🟢 ② 2NO + O₂ → 2NO₂
🟡 ③ CH₃CHO → CH₄ + CO
🔵 ④ 2H₂O₂ → 2H₂O + O₂
🟢 उत्तर: ③ CH₃CHO → CH₄ + CO
📘 परीक्षा: AIPMT
📅 वर्ष: 2011 | सेट: Q
🔵 प्रश्न 16: यदि k = 0.693/t₁/₂, तो यह किस कोटि की अभिक्रिया है?
🔴 ① शून्य
🟢 ② प्रथम
🟡 ③ द्वितीय
🔵 ④ तृतीय
🟢 उत्तर: ② प्रथम
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: S
🔵 प्रश्न 17: आरेनियस समीकरण के अनुसार, यदि Ea अधिक हो तो अभिक्रिया —
🔴 ① तीव्र होती है
🟢 ② मंद होती है
🟡 ③ स्वतः हो जाती है
🔵 ④ उत्प्रेरित हो जाती है
🟢 उत्तर: ② मंद होती है
📘 परीक्षा: PMT
📅 वर्ष: 2010 | सेट: D
🔵 प्रश्न 18: दर नियतांक की इकाई mol⁻¹ L s⁻¹ किस कोटि की अभिक्रिया के लिए होती है?
🔴 ① प्रथम कोटि
🟢 ② द्वितीय कोटि
🟡 ③ शून्य कोटि
🔵 ④ तृतीय कोटि
🟢 उत्तर: ② द्वितीय कोटि
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: R-3
🔵 प्रश्न 19: यदि सक्रियण ऊर्जा 50 kJ/mol है, तो तापमान बढ़ाने से दर कितनी गुना बढ़ेगी (सामान्यतः)?
🔴 ① लगभग 2 गुना
🟢 ② लगभग 10 गुना
🟡 ③ अपरिवर्तित
🔵 ④ घटेगी
🟢 उत्तर: ① लगभग 2 गुना
📘 परीक्षा: AIPMT
📅 वर्ष: 2012 | सेट: P
🔵 प्रश्न 20: यदि दर नियतांक का मान तापमान पर निर्भर करता है, तो यह किस सिद्धांत से स्पष्ट होता है?
🔴 ① टकराव सिद्धांत
🟢 ② संक्रमण अवस्था सिद्धांत
🟡 ③ ऊर्जा संरक्षण सिद्धांत
🔵 ④ ले-शातेलियर सिद्धांत
🟢 उत्तर: ① टकराव सिद्धांत
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: Q
🔵 प्रश्न 21: अभिक्रिया की दर का आयाम क्या है?
🔴 ① mol L⁻¹ s⁻¹
🟢 ② s⁻¹
🟡 ③ mol⁻¹ L s⁻¹
🔵 ④ mol⁻² L² s⁻¹
🟢 उत्तर: ① mol L⁻¹ s⁻¹
📘 परीक्षा: PMT
📅 वर्ष: 2011 | सेट: C
🔵 प्रश्न 22: उत्प्रेरक अभिक्रिया की सक्रियण ऊर्जा को —
🔴 ① घटाता है
🟢 ② बढ़ाता है
🟡 ③ समान रखता है
🔵 ④ समाप्त कर देता है
🟢 उत्तर: ① घटाता है
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: Q
🔵 प्रश्न 23: दर नियतांक k का मान तापमान के साथ क्यों बढ़ता है?
🔴 ① A घटता है
🟢 ② Ea घटती है
🟡 ③ e^(-Ea/RT) बढ़ता है
🔵 ④ R घटता है
🟢 उत्तर: ③ e^(-Ea/RT) बढ़ता है
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: S
🔵 प्रश्न 24: यदि किसी अभिक्रिया में दर = k[A]⁰ है, तो यह क्या दर्शाता है?
🔴 ① दर केवल A पर निर्भर
🟢 ② दर A पर निर्भर नहीं
🟡 ③ दर B पर निर्भर
🔵 ④ दर तृतीय कोटि की है
🟢 उत्तर: ② दर A पर निर्भर नहीं
📘 परीक्षा: AIPMT
📅 वर्ष: 2010 | सेट: P
🔵 प्रश्न 25: यदि दो अभिक्रियाओं की Ea समान है, परन्तु एक का A अधिक है, तो कौन-सी अधिक तीव्र होगी?
🔴 ① A कम वाली
🟢 ② A अधिक वाली
🟡 ③ दोनों समान
🔵 ④ कोई नहीं
🟢 उत्तर: ② A अधिक वाली
📘 परीक्षा: NEET
📅 वर्ष: 2021 | सेट: S-3
🔵 प्रश्न 26: यदि किसी अभिक्रिया की दर दुगुनी हो जाती है जब तापमान में 10 °C की वृद्धि की जाती है, तो इसका तापीय गुणांक Q₁₀ होगा —
🔴 ① 1
🟢 ② 2
🟡 ③ 10
🔵 ④ 4
🟢 उत्तर: ② 2
📘 परीक्षा: NEET
📅 वर्ष: 2022 | सेट: Q-1
🔵 प्रश्न 27: प्रथम कोटि अभिक्रिया का अर्धायु किस पर निर्भर नहीं करता?
🔴 ① प्रारम्भिक सांद्रता पर
🟢 ② दर नियतांक पर
🟡 ③ तापमान पर
🔵 ④ अभिक्रिया की दिशा पर
🟢 उत्तर: ① प्रारम्भिक सांद्रता पर
📘 परीक्षा: AIPMT
📅 वर्ष: 2014 | सेट: M
🔵 प्रश्न 28: यदि दर नियतांक का मान बढ़ता है, तो अभिक्रिया की गति —
🔴 ① घटेगी
🟢 ② बढ़ेगी
🟡 ③ समान रहेगी
🔵 ④ शून्य हो जाएगी
🟢 उत्तर: ② बढ़ेगी
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: S-2
🔵 प्रश्न 29: अभिक्रिया दर समीकरण Rate = k[A]⁰[B]¹ में दर किस पर निर्भर है?
🔴 ① केवल A पर
🟢 ② केवल B पर
🟡 ③ A एवं B दोनों पर
🔵 ④ किसी पर नहीं
🟢 उत्तर: ② केवल B पर
📘 परीक्षा: AIPMT
📅 वर्ष: 2011 | सेट: Q
🔵 प्रश्न 30: आरेनियस समीकरण में A को क्या कहा जाता है?
🔴 ① दर नियतांक
🟢 ② आवृत्ति गुणांक
🟡 ③ सक्रियण ऊर्जा
🔵 ④ सार्वत्रिक स्थिरांक
🟢 उत्तर: ② आवृत्ति गुणांक
📘 परीक्षा: NEET
📅 वर्ष: 2021 | सेट: P
🔵 प्रश्न 31: किसी द्वितीय कोटि अभिक्रिया के लिए समय-नियम क्या है?
🔴 ① k = (1/t)(a/x)
🟢 ② 1/(a-x) = kt + 1/a
🟡 ③ k = (2.303/t) log(a/(a-x))
🔵 ④ x = kt
🟢 उत्तर: ② 1/(a-x) = kt + 1/a
📘 परीक्षा: NEET
📅 वर्ष: 2015 | सेट: S
🔵 प्रश्न 32: अभिक्रिया दर का तापमान पर निर्भरता सर्वप्रथम किसने दी थी?
🔴 ① आरेनियस
🟢 ② वान्ट हॉफ
🟡 ③ ली शातेलियर
🔵 ④ वैन डर वॉल्स
🟢 उत्तर: ① आरेनियस
📘 परीक्षा: AIPMT
📅 वर्ष: 2010 | सेट: L
🔵 प्रश्न 33: सक्रियण ऊर्जा का मान जितना अधिक होगा, दर नियतांक का मान —
🔴 ① अधिक होगा
🟢 ② कम होगा
🟡 ③ समान रहेगा
🔵 ④ कोई प्रभाव नहीं
🟢 उत्तर: ② कम होगा
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: R
🔵 प्रश्न 34: यदि दर = k[A][B], तो दर में कितनी वृद्धि होगी यदि A और B दोनों की सांद्रता दुगनी की जाए?
🔴 ① 2 गुना
🟢 ② 4 गुना
🟡 ③ 6 गुना
🔵 ④ 8 गुना
🟢 उत्तर: ② 4 गुना
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: P-1
🔵 प्रश्न 35: प्रथम कोटि अभिक्रिया में दर नियतांक का मान 1.386 × 10⁻³ s⁻¹ है, तो अर्धायु क्या होगी?
🔴 ① 1000 s
🟢 ② 500 s
🟡 ③ 100 s
🔵 ④ 200 s
🟢 उत्तर: ① 500 s (लगभग)
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: Q
🔵 प्रश्न 36: यदि दर = k[A]¹[B]², तो अभिक्रिया की कोटि क्या होगी?
🔴 ① 1
🟢 ② 2
🟡 ③ 3
🔵 ④ 4
🟢 उत्तर: ③ 3
📘 परीक्षा: AIPMT
📅 वर्ष: 2013 | सेट: M
🔵 प्रश्न 37: शून्य कोटि अभिक्रिया की दर —
🔴 ① अभिकारक की सांद्रता पर निर्भर
🟢 ② अभिकारक की सांद्रता पर निर्भर नहीं
🟡 ③ तापमान पर निर्भर नहीं
🔵 ④ दाब पर निर्भर
🟢 उत्तर: ② अभिकारक की सांद्रता पर निर्भर नहीं
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: P
🔵 प्रश्न 38: टकराव सिद्धांत के अनुसार दर किन पर निर्भर करती है?
🔴 ① टकराव की संख्या पर
🟢 ② प्रभावी टकरावों पर
🟡 ③ अणुओं के आकार पर
🔵 ④ अणुओं के भार पर
🟢 उत्तर: ② प्रभावी टकरावों पर
📘 परीक्षा: AIPMT
📅 वर्ष: 2011 | सेट: P
🔵 प्रश्न 39: यदि किसी अभिक्रिया का दर नियतांक 25°C पर 3 × 10⁻³ s⁻¹ है और 35°C पर 6 × 10⁻³ s⁻¹, तो Q₁₀ = ?
🔴 ① 1
🟢 ② 2
🟡 ③ 3
🔵 ④ 6
🟢 उत्तर: ② 2
📘 परीक्षा: NEET
📅 वर्ष: 2020 | सेट: R-2
🔵 प्रश्न 40: उत्प्रेरक किस प्रकार कार्य करता है?
🔴 ① Ea बढ़ाकर
🟢 ② Ea घटाकर
🟡 ③ A घटाकर
🔵 ④ दर घटाकर
🟢 उत्तर: ② Ea घटाकर
📘 परीक्षा: PMT
📅 वर्ष: 2012 | सेट: D
🔵 प्रश्न 41: प्रथम कोटि अभिक्रिया में, यदि 50% अभिकारक 10 मिनट में उपभुक्त हो जाते हैं, तो 75% उपभोग में कितना समय लगेगा?
🔴 ① 10 मिनट
🟢 ② 20 मिनट
🟡 ③ 30 मिनट
🔵 ④ 40 मिनट
🟢 उत्तर: ② 20 मिनट
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: Q
🔵 प्रश्न 42: प्रथम कोटि अभिक्रिया में, k = 2.303/t × log(a/(a-x)) किससे व्युत्पन्न होती है?
🔴 ① दर नियम से
🟢 ② समय नियम से
🟡 ③ टकराव सिद्धांत से
🔵 ④ उत्प्रेरक सिद्धांत से
🟢 उत्तर: ① दर नियम से
📘 परीक्षा: AIPMT
📅 वर्ष: 2010 | सेट: L
🔵 प्रश्न 43: यदि किसी अभिक्रिया में k का मान तापमान से स्वतंत्र है, तो वह अभिक्रिया —
🔴 ① शून्य कोटि
🟢 ② द्वितीय कोटि
🟡 ③ तात्विक
🔵 ④ अपघटन
🟢 उत्तर: ① शून्य कोटि
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: R
🔵 प्रश्न 44: अभिक्रिया की दर का आयाम क्या होता है?
🔴 ① mol L⁻¹ s⁻¹
🟢 ② mol s⁻¹
🟡 ③ L mol⁻¹ s⁻¹
🔵 ④ s⁻¹
🟢 उत्तर: ① mol L⁻¹ s⁻¹
📘 परीक्षा: AIPMT
📅 वर्ष: 2015 | सेट: Q
🔵 प्रश्न 45: टकराव सिद्धांत के अनुसार, अभिक्रिया तभी होगी जब —
🔴 ① टकराव बार-बार हों
🟢 ② टकराव प्रभावी हों
🟡 ③ टकराव धीमे हों
🔵 ④ टकराव निष्क्रिय हों
🟢 उत्तर: ② टकराव प्रभावी हों
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: P
🔵 प्रश्न 46: आरेनियस समीकरण में e^(-Ea/RT) का मान तापमान बढ़ाने पर —
🔴 ① घटता है
🟢 ② बढ़ता है
🟡 ③ समान रहता है
🔵 ④ शून्य हो जाता है
🟢 उत्तर: ② बढ़ता है
📘 परीक्षा: AIPMT
📅 वर्ष: 2011 | सेट: M
🔵 प्रश्न 47: यदि किसी अभिक्रिया की दर अभिकारक की सांद्रता से स्वतंत्र है, तो वह —
🔴 ① प्रथम कोटि
🟢 ② शून्य कोटि
🟡 ③ द्वितीय कोटि
🔵 ④ तृतीय कोटि
🟢 उत्तर: ② शून्य कोटि
📘 परीक्षा: NEET
📅 वर्ष: 2015 | सेट: R
🔵 प्रश्न 48: यदि दर नियतांक का मान logk बनाम 1/T ग्राफ में सीधी रेखा देता है, तो उसका ढाल क्या होगा?
🔴 ① Ea/R
🟢 ② -Ea/2.303R
🟡 ③ -2.303R/Ea
🔵 ④ R/Ea
🟢 उत्तर: ② -Ea/2.303R
📘 परीक्षा: NEET
📅 वर्ष: 2021 | सेट: Q-2
🔵 प्रश्न 49: यदि किसी अभिक्रिया की दर स्थिर है, तो उसकी कोटि क्या होगी?
🔴 ① शून्य
🟢 ② प्रथम
🟡 ③ द्वितीय
🔵 ④ तृतीय
🟢 उत्तर: ① शून्य
📘 परीक्षा: PMT
📅 वर्ष: 2008 | सेट: A
🔵 प्रश्न 50: यदि किसी अभिक्रिया का दर नियतांक तापमान बढ़ाने पर बढ़ता है, तो इसका कारण है —
🔴 ① अधिक टकराव ऊर्जा
🟢 ② कम सक्रियण ऊर्जा
🟡 ③ कम टकराव
🔵 ④ विलायक का प्रभाव
🟢 उत्तर: ① अधिक टकराव ऊर्जा
📘 परीक्षा: NEET
📅 वर्ष: 2022 | सेट: P
————————————————————————————————————————————————————————————————————————————
JEE MAINS पिछले सालों के प्रश्न
🔵 प्रश्न 1
किसी अभिक्रिया की दर स्थिरांक का मान तापमान बढ़ाने पर क्यों बढ़ता है?
🔴 ① सक्रियण ऊर्जा घट जाती है
🟢 ② अणुओं की गतिज ऊर्जा बढ़ जाती है
🟡 ③ अभिक्रिया का क्रम बढ़ जाता है
🔵 ④ टक्कर आवृत्ति घट जाती है
🟢 उत्तर: ② अणुओं की गतिज ऊर्जा बढ़ जाती है
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: प्रातःकाल
🔵 प्रश्न 2:
यदि किसी अभिक्रिया का दर नियम है: rate = k[A]²[B], तो अभिक्रिया का कुल क्रम क्या होगा?
🔴 ① 1
🟢 ② 2
🟡 ③ 3
🔵 ④ 0
🟢 उत्तर: ③ 3
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | शिफ़्ट: अपराह्न
🔵 प्रश्न 3:
किसी प्रथम क्रम अभिक्रिया में, यदि 75% पदार्थ 30 मिनट में विघटित हो जाता है, तो अर्ध-आयु (t₁/₂) होगी —
🔴 ① 15 मिनट
🟢 ② 10 मिनट
🟡 ③ 20 मिनट
🔵 ④ 30 मिनट
🟢 उत्तर: ② 10 मिनट
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: प्रातःकाल
🔵 प्रश्न 4:
Arrhenius समीकरण के अनुसार, दर स्थिरांक (k) और तापमान (T) में सम्बन्ध है —
🔴 ① k = A e^(-Eₐ/RT)
🟢 ② k = A e^(Eₐ/RT)
🟡 ③ k = Ae^(RT/Eₐ)
🔵 ④ k = e^(EₐA/RT)
🟢 उत्तर: ① k = A e^(-Eₐ/RT)
📘 परीक्षा: JEE Main
📅 वर्ष: 2015 | शिफ़्ट: अपराह्न
🔵 प्रश्न 5:
शून्य क्रम अभिक्रिया में, दर —
🔴 ① केवल एक अभिकारक पर निर्भर करती है
🟢 ② अभिकारकों की सांद्रता पर निर्भर नहीं करती
🟡 ③ उत्पाद की सांद्रता पर निर्भर करती
🔵 ④ समय के साथ घटती है
🟢 उत्तर: ② अभिकारकों की सांद्रता पर निर्भर नहीं करती
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: प्रातःकाल
🔵 प्रश्न 6:
किसी अभिक्रिया की दर स्थिरांक का विमीय सूत्र (dimensions) क्या होगा यदि उसका क्रम 2 है?
🔴 ① (mol⁻¹ L s⁻¹)
🟢 ② (mol⁻¹ L⁻¹ s⁻¹)
🟡 ③ (mol⁻² L² s⁻¹)
🔵 ④ (s⁻¹)
🟢 उत्तर: ② (mol⁻¹ L⁻¹ s⁻¹)
📘 परीक्षा: JEE Main
📅 वर्ष: 2022 | शिफ़्ट: अपराह्न
🔵 प्रश्न 7:
किसी प्रथम क्रम अभिक्रिया में दर स्थिरांक की इकाई क्या होती है?
🔴 ① L mol⁻¹ s⁻¹
🟢 ② s⁻¹
🟡 ③ mol L⁻¹ s⁻¹
🔵 ④ mol² L⁻² s⁻¹
🟢 उत्तर: ② s⁻¹
📘 परीक्षा: JEE Main
📅 वर्ष: 2014 | शिफ़्ट: प्रातःकाल
🔵 प्रश्न 8:
सक्रियण ऊर्जा कम होने पर अभिक्रिया की दर —
🔴 ① घटती है
🟢 ② बढ़ती है
🟡 ③ अपरिवर्तित रहती है
🔵 ④ पहले घटती फिर बढ़ती
🟢 उत्तर: ② बढ़ती है
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: अपराह्न
🔵 प्रश्न 9:
Rate constant का मान किस पर निर्भर नहीं करता है?
🔴 ① तापमान
🟢 ② दाब
🟡 ③ अभिकारकों की प्रकृति
🔵 ④ उत्प्रेरक की उपस्थिति
🟢 उत्तर: ② दाब
📘 परीक्षा: JEE Main
📅 वर्ष: 2013 | शिफ़्ट: प्रातःकाल
🔵 प्रश्न 10:
यदि किसी अभिक्रिया का दर नियम rate = k[A][B]¹/² है, तो यह अभिक्रिया —
🔴 ① शून्य क्रम की है
🟢 ② 1.5 क्रम की है
🟡 ③ द्वितीय क्रम की है
🔵 ④ तृतीय क्रम की है
🟢 उत्तर: ② 1.5 क्रम की है
📘 परीक्षा: JEE Main
📅 वर्ष: 2021 | शिफ़्ट: अपराह्न
🔵 प्रश्न 11
किसी प्रथम क्रम अभिक्रिया में दर स्थिरांक k = 0.693 s⁻¹ है। अर्ध-आयु (t₁/₂) का मान क्या होगा?
🔴 ① 1 s
🟢 ② 2 s
🟡 ③ 0.1 s
🔵 ④ 10 s
🟢 उत्तर: ① 1 s
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: अपराह्न
🔵 प्रश्न 12:
Arrhenius समीकरण में A का क्या अर्थ है?
🔴 ① सक्रियण ऊर्जा
🟢 ② आवृत्ति गुणक
🟡 ③ Boltzmann नियतांक
🔵 ④ गैस नियतांक
🟢 उत्तर: ② आवृत्ति गुणक
📘 परीक्षा: JEE Main
📅 वर्ष: 2014 | शिफ़्ट: अपराह्न
🔵 प्रश्न 13:
किसी अभिक्रिया की दर का मापन किन मात्राओं से किया जा सकता है?
🔴 ① द्रव्यमान परिवर्तन
🟢 ② आयतन परिवर्तन
🟡 ③ रंग परिवर्तन
🔵 ④ उपर्युक्त सभी
🟢 उत्तर: ④ उपर्युक्त सभी
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: प्रातःकाल
🔵 प्रश्न 14:
प्रथम क्रम अभिक्रिया में यदि प्रारंभिक सांद्रता 0.1 mol L⁻¹ है और 10 मिनट बाद 0.025 mol L⁻¹ बचती है, तो दर स्थिरांक (k) का मान होगा —
🔴 ① 0.0693 min⁻¹
🟢 ② 0.1386 min⁻¹
🟡 ③ 0.0346 min⁻¹
🔵 ④ 0.0462 min⁻¹
🟢 उत्तर: ② 0.1386 min⁻¹
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: प्रातःकाल
🔵 प्रश्न 15:
यदि तापमान 10°C बढ़ाने पर अभिक्रिया की दर लगभग दोगुनी हो जाती है, तो यह किस सिद्धान्त पर आधारित है?
🔴 ① टक्कर सिद्धान्त
🟢 ② सक्रियण ऊर्जा सिद्धान्त
🟡 ③ संक्रमण अवस्था सिद्धान्त
🔵 ④ प्रतिक्रिया क्रम सिद्धान्त
🟢 उत्तर: ① टक्कर सिद्धान्त
📘 परीक्षा: JEE Main
📅 वर्ष: 2015 | शिफ़्ट: प्रातःकाल
🔵 प्रश्न 16:
किसी अभिक्रिया में सक्रियण ऊर्जा (Eₐ) 60 kJ mol⁻¹ है। यदि तापमान 300 K से 310 K कर दिया जाए, तो दर स्थिरांक का अनुपात लगभग क्या होगा?
🔴 ① 2.0
🟢 ② 1.5
🟡 ③ 1.1
🔵 ④ 3.0
🟢 उत्तर: ② 1.5
📘 परीक्षा: JEE Main
📅 वर्ष: 2021 | शिफ़्ट: प्रातःकाल
🔵 प्रश्न 17:
किसी शून्य क्रम अभिक्रिया में यदि प्रारंभिक सांद्रता [A₀] है, तो t समय बाद [A] क्या होगी?
🔴 ① [A] = [A₀]e⁻ᵏᵗ
🟢 ② [A] = [A₀] – kt
🟡 ③ [A] = [A₀] + kt
🔵 ④ [A] = k[A₀]t
🟢 उत्तर: ② [A] = [A₀] – kt
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: अपराह्न
🔵 प्रश्न 18:
यदि किसी द्वितीय क्रम अभिक्रिया की प्रारंभिक सांद्रता दुगुनी की जाए, तो दर कितनी गुना बढ़ेगी?
🔴 ① 2 गुना
🟢 ② 4 गुना
🟡 ③ 8 गुना
🔵 ④ 16 गुना
🟢 उत्तर: ② 4 गुना
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | शिफ़्ट: प्रातःकाल
🔵 प्रश्न 19:
किसी अभिक्रिया के लिए ग्राफ 1/[A] बनाम समय सीधी रेखा देता है। अभिक्रिया का क्रम क्या है?
🔴 ① 0
🟢 ② 1
🟡 ③ 2
🔵 ④ 3
🟢 उत्तर: ③ 2
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: प्रातःकाल
🔵 प्रश्न 20:
यदि दर स्थिरांक की इकाई mol⁻¹ L s⁻¹ है, तो अभिक्रिया का क्रम क्या होगा?
🔴 ① 1
🟢 ② 2
🟡 ③ 3
🔵 ④ 0
🟢 उत्तर: ② 2
📘 परीक्षा: JEE Main
📅 वर्ष: 2013 | शिफ़्ट: अपराह्न
🔵 प्रश्न 21:
अभिक्रिया 2N₂O₅ → 4NO₂ + O₂ के लिए दर स्थिरांक का मान 2.3×10⁻⁵ s⁻¹ है। यदि N₂O₅ की प्रारंभिक सांद्रता 0.1 mol L⁻¹ है, तो 1000 s बाद शेष सांद्रता होगी —
🔴 ① 0.08 mol L⁻¹
🟢 ② 0.09 mol L⁻¹
🟡 ③ 0.07 mol L⁻¹
🔵 ④ 0.05 mol L⁻¹
🟢 उत्तर: ② 0.09 mol L⁻¹
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: अपराह्न
🔵 प्रश्न 22:
दर स्थिरांक (k) और सक्रियण ऊर्जा (Eₐ) के मध्य सम्बन्ध का निर्धारण किसने किया था?
🔴 ① हेस
🟢 ② Arrhenius
🟡 ③ वैन-हॉफ
🔵 ④ बोहर
🟢 उत्तर: ② Arrhenius
📘 परीक्षा: JEE Main
📅 वर्ष: 2014 | शिफ़्ट: प्रातःकाल
🔵 प्रश्न 23:
टक्कर सिद्धान्त के अनुसार, प्रभावी टक्करें किन टक्करों को कहा जाता है?
🔴 ① जिनमें कम ऊर्जा होती है
🟢 ② जिनमें ऊर्जा ≥ सक्रियण ऊर्जा हो
🟡 ③ सभी टक्करें
🔵 ④ कोई भी नहीं
🟢 उत्तर: ② जिनमें ऊर्जा ≥ सक्रियण ऊर्जा हो
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: अपराह्न
🔵 प्रश्न 24:
किसी अभिक्रिया की दर स्थिरांक को तापमान के साथ ग्राफिक रूप से कैसे दर्शाया जाता है?
🔴 ① log k बनाम 1/T का ग्राफ सीधी रेखा देता है
🟢 ② k बनाम T का ग्राफ परवलय होता है
🟡 ③ log T बनाम k का ग्राफ सीधा होता है
🔵 ④ कोई नहीं
🟢 उत्तर: ① log k बनाम 1/T का ग्राफ सीधी रेखा देता है
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: प्रातःकाल
🔵 प्रश्न 25:
किसी द्वितीय क्रम अभिक्रिया के लिए, समय t पर [A] = [A₀]/(1 + k[A₀]t) है। यह समीकरण किस नियम से व्युत्पन्न है?
🔴 ① दर नियम से
🟢 ② इंटीग्रेटेड दर समीकरण से
🟡 ③ टक्कर सिद्धान्त से
🔵 ④ तापीय प्रभाव नियम से
🟢 उत्तर: ② इंटीग्रेटेड दर समीकरण से
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: अपराह्न
🔵 प्रश्न 26
किसी प्रथम क्रम अभिक्रिया में यदि दर स्थिरांक 0.231 min⁻¹ है, तो अर्ध-आयु (t₁/₂) होगी —
🔴 ① 1.5 मिनट
🟢 ② 3 मिनट
🟡 ③ 10 मिनट
🔵 ④ 5 मिनट
🟢 उत्तर: ② 3 मिनट
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: अपराह्न
🔵 प्रश्न 27:
किसी अभिक्रिया के लिए तापमान बढ़ाने पर दर स्थिरांक 2 गुना हो जाता है। सक्रियण ऊर्जा का मान (kJ mol⁻¹) लगभग कितना होगा?
🔴 ① 10
🟢 ② 50
🟡 ③ 100
🔵 ④ 200
🟢 उत्तर: ② 50
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | शिफ़्ट: प्रातःकाल
🔵 प्रश्न 28:
यदि किसी अभिक्रिया की दर स्थिरांक की इकाई s⁻¹ है, तो यह अभिक्रिया —
🔴 ① प्रथम क्रम की है
🟢 ② शून्य क्रम की है
🟡 ③ द्वितीय क्रम की है
🔵 ④ तृतीय क्रम की है
🟢 उत्तर: ① प्रथम क्रम की है
📘 परीक्षा: JEE Main
📅 वर्ष: 2013 | शिफ़्ट: अपराह्न
🔵 प्रश्न 29:
किसी अभिक्रिया के लिए सक्रियण ऊर्जा और आवृत्ति गुणक स्थिर रहते हैं। यदि तापमान घटा दिया जाए, तो दर स्थिरांक —
🔴 ① घटेगा
🟢 ② बढ़ेगा
🟡 ③ समान रहेगा
🔵 ④ पहले घटेगा फिर बढ़ेगा
🟢 उत्तर: ① घटेगा
📘 परीक्षा: JEE Main
📅 वर्ष: 2015 | शिफ़्ट: प्रातःकाल
🔵 प्रश्न 30:
यदि दर स्थिरांक (k) = 2.0 × 10⁻² L mol⁻¹ s⁻¹ है, तो अभिक्रिया का क्रम क्या होगा?
🔴 ① 0
🟢 ② 2
🟡 ③ 1
🔵 ④ 3
🟢 उत्तर: ② 2
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: अपराह्न
🔵 प्रश्न 31:
किसी द्वितीय क्रम अभिक्रिया में दर स्थिरांक की इकाई क्या होती है?
🔴 ① mol L⁻¹ s⁻¹
🟢 ② L mol⁻¹ s⁻¹
🟡 ③ s⁻¹
🔵 ④ mol² L⁻² s⁻¹
🟢 उत्तर: ② L mol⁻¹ s⁻¹
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: प्रातःकाल
🔵 प्रश्न 32:
किसी अभिक्रिया के लिए तापमान बढ़ाने पर log k बनाम 1/T का ग्राफ कैसा होगा?
🔴 ① ऊपर की ओर झुका हुआ
🟢 ② नीचे की ओर झुका हुआ
🟡 ③ क्षैतिज
🔵 ④ ऊर्ध्वाधर
🟢 उत्तर: ② नीचे की ओर झुका हुआ
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: अपराह्न
🔵 प्रश्न 33:
किसी शून्य क्रम अभिक्रिया में दर स्थिरांक की इकाई क्या होगी?
🔴 ① mol L⁻¹ s⁻¹
🟢 ② s⁻¹
🟡 ③ mol² L⁻² s⁻¹
🔵 ④ L mol⁻¹ s⁻¹
🟢 उत्तर: ① mol L⁻¹ s⁻¹
📘 परीक्षा: JEE Main
📅 वर्ष: 2014 | शिफ़्ट: प्रातःकाल
🔵 प्रश्न 34:
यदि किसी अभिक्रिया का क्रम 1.5 है, तो दर स्थिरांक की इकाई क्या होगी?
🔴 ① mol⁻⁰․⁵ L⁰․⁵ s⁻¹
🟢 ② mol⁻⁰․⁵ L⁰․⁵ s⁻¹
🟡 ③ mol⁻¹․⁵ L¹․⁵ s⁻¹
🔵 ④ s⁻¹
🟢 उत्तर: ② mol⁻⁰․⁵ L⁰․⁵ s⁻¹
📘 परीक्षा: JEE Main
📅 वर्ष: 2021 | शिफ़्ट: प्रातःकाल
🔵 प्रश्न 35:
Arrhenius समीकरण का लघुगणकीय रूप क्या है?
🔴 ① log k = log A + Eₐ/(2.303RT)
🟢 ② log k = log A – Eₐ/(2.303RT)
🟡 ③ log A = log k – Eₐ/(2.303RT)
🔵 ④ log A = Eₐ/(RT)
🟢 उत्तर: ② log k = log A – Eₐ/(2.303RT)
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: प्रातःकाल
🔵 प्रश्न 36:
टक्कर सिद्धान्त में ‘A’ पद का भौतिक अर्थ क्या है?
🔴 ① सक्रियण ऊर्जा
🟢 ② टक्करों की संख्या प्रति सेकंड
🟡 ③ Boltzmann नियतांक
🔵 ④ ऊर्जा स्थिरांक
🟢 उत्तर: ② टक्करों की संख्या प्रति सेकंड
📘 परीक्षा: JEE Main
📅 वर्ष: 2015 | शिफ़्ट: अपराह्न
🔵 प्रश्न 37:
यदि किसी अभिक्रिया में दर स्थिरांक की इकाई mol⁻² L² s⁻¹ है, तो अभिक्रिया का क्रम क्या होगा?
🔴 ① 3
🟢 ② 2
🟡 ③ 1
🔵 ④ 0
🟢 उत्तर: ① 3
📘 परीक्षा: JEE Main
📅 वर्ष: 2013 | शिफ़्ट: प्रातःकाल
🔵 प्रश्न 38:
किसी अभिक्रिया के लिए सक्रियण ऊर्जा का मान 0 होने पर दर स्थिरांक —
🔴 ① स्थिर रहेगा
🟢 ② तापमान पर निर्भर नहीं करेगा
🟡 ③ शून्य होगा
🔵 ④ बढ़ेगा
🟢 उत्तर: ② तापमान पर निर्भर नहीं करेगा
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: अपराह्न
🔵 प्रश्न 39:
यदि किसी अभिक्रिया की दर स्थिरांक का मान 2.303 × 10⁻³ s⁻¹ है, तो उसकी अर्ध-आयु होगी —
🔴 ① 100 s
🟢 ② 300 s
🟡 ③ 1000 s
🔵 ④ 10 s
🟢 उत्तर: ① 100 s
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: प्रातःकाल
🔵 प्रश्न 40:
अभिक्रिया के क्रम का निर्धारण किस विधि से किया जा सकता है?
🔴 ① समाकलन विधि
🟢 ② प्रारंभिक दर विधि
🟡 ③ दोनों
🔵 ④ कोई नहीं
🟢 उत्तर: ③ दोनों
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: अपराह्न
🔵 प्रश्न 41:
किसी द्वितीय क्रम अभिक्रिया में यदि प्रारंभिक सांद्रता आधी कर दी जाए, तो दर —
🔴 ① आधी हो जाएगी
🟢 ② एक-चौथाई हो जाएगी
🟡 ③ दुगुनी हो जाएगी
🔵 ④ समान रहेगी
🟢 उत्तर: ② एक-चौथाई हो जाएगी
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | शिफ़्ट: अपराह्न
🔵 प्रश्न 42:
Arrhenius समीकरण में R का मान SI इकाई में क्या होता है?
🔴 ① 8.314 J mol⁻¹ K⁻¹
🟢 ② 1.987 cal mol⁻¹ K⁻¹
🟡 ③ दोनों
🔵 ④ कोई नहीं
🟢 उत्तर: ③ दोनों
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: प्रातःकाल
🔵 प्रश्न 43:
किसी अभिक्रिया में 50% पदार्थ के विघटन का समय अर्ध-आयु कहलाता है। यह किस प्रकार की अभिक्रिया के लिए स्थिर होता है?
🔴 ① प्रथम क्रम
🟢 ② द्वितीय क्रम
🟡 ③ शून्य क्रम
🔵 ④ तृतीय क्रम
🟢 उत्तर: ① प्रथम क्रम
📘 परीक्षा: JEE Main
📅 वर्ष: 2022 | शिफ़्ट: अपराह्न
🔵 प्रश्न 44:
किसी अभिक्रिया के लिए सक्रियण ऊर्जा Eₐ और आवृत्ति गुणक A ज्ञात होने पर दर स्थिरांक ज्ञात करने हेतु कौन-सा समीकरण प्रयुक्त होता है?
🔴 ① Arrhenius समीकरण
🟢 ② हेनरी का नियम
🟡 ③ वैन-हॉफ समीकरण
🔵 ④ गैस समीकरण
🟢 उत्तर: ① Arrhenius समीकरण
📘 परीक्षा: JEE Main
📅 वर्ष: 2014 | शिफ़्ट: प्रातःकाल
🔵 प्रश्न 45:
दर स्थिरांक का मान तापमान के साथ किस प्रकार बदलता है?
🔴 ① तापमान बढ़ाने पर घटता है
🟢 ② तापमान बढ़ाने पर बढ़ता है
🟡 ③ तापमान घटाने पर बढ़ता है
🔵 ④ तापमान पर निर्भर नहीं करता
🟢 उत्तर: ② तापमान बढ़ाने पर बढ़ता है
📘 परीक्षा: JEE Main
📅 वर्ष: 2023 | शिफ़्ट: प्रातःकाल
🔵 प्रश्न 46:
किसी अभिक्रिया के लिए सक्रियण ऊर्जा अधिक है। इसका अर्थ है कि —
🔴 ① अभिक्रिया शीघ्र होगी
🟢 ② अभिक्रिया मंद होगी
🟡 ③ अभिक्रिया स्वतः होगी
🔵 ④ अभिक्रिया असंभव है
🟢 उत्तर: ② अभिक्रिया मंद होगी
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: प्रातःकाल
🔵 प्रश्न 47:
टक्कर सिद्धान्त का संशोधित रूप किसने दिया?
🔴 ① Arrhenius
🟢 ② Hinshelwood
🟡 ③ Van’t Hoff
🔵 ④ Guldberg और Waage
🟢 उत्तर: ② Hinshelwood
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: अपराह्न
🔵 प्रश्न 48:
यदि किसी अभिक्रिया का क्रम और आणविकता समान है, तो यह अभिक्रिया —
🔴 ① सरल होगी
🟢 ② जटिल होगी
🟡 ③ श्रृंखलाबद्ध होगी
🔵 ④ बहुपद होगी
🟢 उत्तर: ① सरल होगी
📘 परीक्षा: JEE Main
📅 वर्ष: 2015 | शिफ़्ट: प्रातःकाल
🔵 प्रश्न 49:
किसी प्रथम क्रम अभिक्रिया के लिए प्रारंभिक दर = k[A]। यदि [A] = 2[A₀], तो दर —
🔴 ① आधी हो जाएगी
🟢 ② दुगुनी हो जाएगी
🟡 ③ चार गुना हो जाएगी
🔵 ④ समान रहेगी
🟢 उत्तर: ② दुगुनी हो जाएगी
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: अपराह्न
🔵 प्रश्न 50:
किसी अभिक्रिया के लिए Arrhenius ग्राफ की ढाल (slope) का मान क्या दर्शाता है?
🔴 ① सक्रियण ऊर्जा
🟢 ② –Eₐ/2.303R
🟡 ③ log A
🔵 ④ दर स्थिरांक
🟢 उत्तर: ② –Eₐ/2.303R
📘 परीक्षा: JEE Main
📅 वर्ष: 2024 | शिफ़्ट: प्रातःकाल
————————————————————————————————————————————————————————————————————————————
JEE ADVANCED पिछले सालों के प्रश्न
🔵 प्रश्न 1:
किसी अभिक्रिया की दर उस समय के व्युत्क्रम के समानुपाती होती है जो एक निश्चित अंश की अभिक्रिया पूरी होने में लगता है। यह किस क्रम की अभिक्रिया के लिए सत्य है?
🔴 ① शून्य क्रम
🟢 ② प्रथम क्रम
🟡 ③ द्वितीय क्रम
🔵 ④ तृतीय क्रम
🟢 उत्तर: ② प्रथम क्रम
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2014 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–खड़गपुर
🔵 प्रश्न 2:
यदि किसी अभिक्रिया की दर दोगुनी हो जाती है जब तापमान 300 K से 310 K किया जाता है, तो सक्रियण ऊर्जा (Ea) लगभग कितनी होगी? (R = 8.314 J mol⁻¹ K⁻¹)
🔴 ① 52 kJ mol⁻¹
🟢 ② 48 kJ mol⁻¹
🟡 ③ 54 kJ mol⁻¹
🔵 ④ 40 kJ mol⁻¹
🟢 उत्तर: ② 48 kJ mol⁻¹
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2012 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–दिल्ली
🔵 प्रश्न 3:
यदि किसी अभिक्रिया का दर नियतांक (k) 25 °C पर 3.46×10⁻³ s⁻¹ है, तो 35 °C पर दर नियतांक का मान लगभग कितना होगा यदि Ea = 50 kJ mol⁻¹ हो?
🔴 ① 7.5×10⁻³ s⁻¹
🟢 ② 6.8×10⁻³ s⁻¹
🟡 ③ 3.46×10⁻³ s⁻¹
🔵 ④ 1.2×10⁻² s⁻¹
🟢 उत्तर: ② 6.8×10⁻³ s⁻¹
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2015 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–बॉम्बे
🔵 प्रश्न 4:
किसी द्वितीय क्रम की अभिक्रिया में जब अभिकारक का आरंभिक सांद्रण दोगुना किया जाता है, तो अभिक्रिया की प्रारंभिक दर कितनी गुना बढ़ेगी?
🔴 ① 2 गुना
🟢 ② 4 गुना
🟡 ③ 8 गुना
🔵 ④ अपरिवर्तित
🟢 उत्तर: ② 4 गुना
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2013 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–मद्रास
🔵 प्रश्न 5:
प्रथम क्रम की अभिक्रिया के लिए अर्धायु का मान किस पर निर्भर करता है?
🔴 ① आरंभिक सांद्रण पर
🟢 ② दर नियतांक पर
🟡 ③ तापमान पर
🔵 ④ उत्प्रेरक पर
🟢 उत्तर: ② दर नियतांक पर
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2010 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–रूड़की
🔵 प्रश्न 6:
किसी अभिक्रिया में जब दर स्थिरांक की विमा mol⁻¹ L s⁻¹ होती है, तो अभिक्रिया क्रम क्या होगा?
🔴 ① शून्य
🟢 ② द्वितीय
🟡 ③ प्रथम
🔵 ④ तृतीय
🟢 उत्तर: ② द्वितीय
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2016 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–गुवाहाटी
🔵 प्रश्न 7:
Arrhenius समीकरण के अनुसार दर नियतांक और तापमान के बीच किस प्रकार का सम्बन्ध होता है?
🔴 ① प्रत्यक्ष आनुपातिक
🟢 ② लघुगणकीय
🟡 ③ व्युत्क्रमानुपाती
🔵 ④ कोई नहीं
🟢 उत्तर: ② लघुगणकीय
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2011 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–कानपुर
🔵 प्रश्न 8:
यदि किसी अभिक्रिया का दर नियतांक 1.5×10⁻⁴ mol L⁻¹ s⁻¹ है और अभिकारक की सांद्रता 0.01 mol L⁻¹ है, तो दर क्या होगी (प्रथम क्रम अभिक्रिया)?
🔴 ① 1.5×10⁻⁶ mol L⁻¹ s⁻¹
🟢 ② 1.5×10⁻⁶ mol L⁻¹ s⁻¹
🟡 ③ 1.5×10⁻⁵ mol L⁻¹ s⁻¹
🔵 ④ 1.5×10⁻⁴ mol L⁻¹ s⁻¹
🟢 उत्तर: ② 1.5×10⁻⁶ mol L⁻¹ s⁻¹
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2018 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–बॉम्बे
🔵 प्रश्न 9:
किसी रासायनिक अभिक्रिया में दर स्थिरांक का मान तापमान बढ़ाने पर बढ़ता है क्योंकि —
🔴 ① टक्कर आवृत्ति घटती है
🟢 ② अणुओं की गतिज ऊर्जा बढ़ती है
🟡 ③ सक्रियण ऊर्जा घट जाती है
🔵 ④ अभिकारक की सांद्रता घटती है
🟢 उत्तर: ② अणुओं की गतिज ऊर्जा बढ़ती है
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2011 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–दिल्ली
🔵 प्रश्न 10:
किसी द्वितीय क्रम की अभिक्रिया के लिए दर = k[A]² है। यदि A का प्रारंभिक सांद्रण 0.1 mol L⁻¹ है, तो दर नियतांक की विमा क्या होगी?
🔴 ① L mol⁻¹ s⁻¹
🟢 ② L mol⁻¹ s⁻¹
🟡 ③ mol L⁻¹ s⁻¹
🔵 ④ s⁻¹
🟢 उत्तर: ② L mol⁻¹ s⁻¹
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2017 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–मद्रास
🔵 प्रश्न 11:
यदि किसी अभिक्रिया के लिए Arrhenius समीकरण ln k = ln A – Ea/(R T) है, तो ln k बनाम 1/T ग्राफ की ढाल (slope) क्या होगी?
🔴 ① –Ea
🟢 ② –Ea/R
🟡 ③ Ea/R
🔵 ④ ln A
🟢 उत्तर: ② –Ea/R
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2014 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–खड़गपुर
🔵 प्रश्न 12:
किसी शून्य क्रम अभिक्रिया के लिए अभिकारक की सांद्रता समय के साथ किस प्रकार घटती है?
🔴 ① रैखिक रूप से
🟢 ② घातांक रूप में
🟡 ③ परवलयिक रूप में
🔵 ④ कोई नहीं
🟢 उत्तर: ① रैखिक रूप से
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2012 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–दिल्ली
🔵 प्रश्न 13:
यदि किसी अभिक्रिया का क्रम शून्य है, तो उसकी अर्धायु (t₁/₂) किसके समानुपाती होगी?
🔴 ① आरंभिक सांद्रण के
🟢 ② 1/आरंभिक सांद्रण के
🟡 ③ दर नियतांक के
🔵 ④ तापमान के
🟢 उत्तर: ① आरंभिक सांद्रण के
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2016 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–गुवाहाटी
🔵 प्रश्न 14:
किसी अभिक्रिया की सक्रियण ऊर्जा शून्य है। इसका अर्थ है कि —
🔴 ① अभिक्रिया स्वतः नहीं होगी
🟢 ② दर नियतांक तापमान पर निर्भर नहीं होगा
🟡 ③ दर नियतांक बढ़ेगा
🔵 ④ दर नियतांक घटेगा
🟢 उत्तर: ② दर नियतांक तापमान पर निर्भर नहीं होगा
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2018 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–बॉम्बे
🔵 प्रश्न 15:
किसी द्वितीय क्रम की अभिक्रिया के लिए 1/[A] बनाम समय का ग्राफ कैसा होगा?
🔴 ① वक्राकार
🟢 ② सीधी रेखा
🟡 ③ घातांक
🔵 ④ कोई नहीं
🟢 उत्तर: ② सीधी रेखा
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2011 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–कानपुर
🔵 प्रश्न 16:
किसी प्रथम क्रम अभिक्रिया की अर्धायु 69.3 सेकण्ड है। दर नियतांक का मान क्या होगा?
🔴 ① 0.01 s⁻¹
🟢 ② 0.693/69.3 s⁻¹
🟡 ③ 10 s⁻¹
🔵 ④ 0.693 s⁻¹
🟢 उत्तर: ② 0.693/69.3 s⁻¹
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2015 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–बॉम्बे
🔵 प्रश्न 17:
किसी अभिक्रिया में उत्प्रेरक का क्या प्रभाव होता है?
🔴 ① सक्रियण ऊर्जा बढ़ाता है
🟢 ② सक्रियण ऊर्जा घटाता है
🟡 ③ दर नियतांक घटाता है
🔵 ④ अभिक्रिया को रोक देता है
🟢 उत्तर: ② सक्रियण ऊर्जा घटाता है
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2013 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–मद्रास
🔵 प्रश्न 18
किसी अभिक्रिया की दर यदि [A] के वर्ग और [B] के प्रथम घात के समानुपाती है, तो कुल अभिक्रिया क्रम क्या होगा?
🔴 ① 2
🟢 ② 3
🟡 ③ 1
🔵 ④ 0
🟢 उत्तर: ② 3
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2010 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–रूड़की
🔵 प्रश्न 19:
किसी अभिक्रिया में जब दर नियतांक की विमा s⁻¹ है, तो यह किस क्रम की अभिक्रिया को सूचित करता है?
🔴 ① प्रथम क्रम
🟢 ② शून्य क्रम
🟡 ③ द्वितीय क्रम
🔵 ④ तृतीय क्रम
🟢 उत्तर: ① प्रथम क्रम
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2011 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–कानपुर
🔵 प्रश्न 20:
यदि किसी अभिक्रिया का दर नियतांक 10 गुना बढ़ जाता है जब तापमान 25 °C से 75 °C किया जाता है, तो तापीय गुणांक (Q₁₀) का मान क्या होगा?
🔴 ① 1.5
🟢 ② 2
🟡 ③ 10
🔵 ④ 5
🟢 उत्तर: ② 2
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2012 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–दिल्ली
🔵 प्रश्न 21:
प्रथम क्रम अभिक्रिया के लिए समय पर शेष सांद्रता [A] = [A₀]e⁻ᵏᵗ होती है। यदि [A₀]/[A] = 2 है, तो kt का मान क्या होगा?
🔴 ① ln 2
🟢 ② 0.693
🟡 ③ 1
🔵 ④ 2 ln 2
🟢 उत्तर: ② 0.693
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2015 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–बॉम्बे
🔵 प्रश्न 22:
Arrhenius समीकरण के अनुसार यदि A और Ea दोनों स्थिर हैं, तो दर नियतांक बढ़ाने का एकमात्र तरीका क्या है?
🔴 ① तापमान घटाना
🟢 ② तापमान बढ़ाना
🟡 ③ दाब बढ़ाना
🔵 ④ सांद्रता बढ़ाना
🟢 उत्तर: ② तापमान बढ़ाना
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2013 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–मद्रास
🔵 प्रश्न 23:
किसी अभिक्रिया में उत्प्रेरक —
🔴 ① अभिक्रिया की ऊष्मा परिवर्तन को बढ़ाता है
🟢 ② सक्रियण ऊर्जा घटाता है
🟡 ③ दर स्थिरांक घटाता है
🔵 ④ संतुलन स्थिति बदल देता है
🟢 उत्तर: ② सक्रियण ऊर्जा घटाता है
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2014 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–खड़गपुर
🔵 प्रश्न 24:
किसी अभिक्रिया की दर = k[A][B]¹/² है, तो यह अभिक्रिया किस क्रम की होगी?
🔴 ① 1
🟢 ② 1.5
🟡 ③ 2
🔵 ④ 0.5
🟢 उत्तर: ② 1.5
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2017 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–मद्रास
🔵 प्रश्न 25:
यदि किसी अभिक्रिया में तापमान दोगुना करने पर दर चार गुना हो जाती है, तो Q₁₀ का मान क्या है?
🔴 ① 2
🟢 ② 4
🟡 ③ 1
🔵 ④ 8
🟢 उत्तर: ② 4
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2016 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–गुवाहाटी
🔵 प्रश्न 26:
किसी शून्य क्रम अभिक्रिया में दर नियतांक की विमा क्या होती है?
🔴 ① mol L⁻¹ s⁻¹
🟢 ② L mol⁻¹ s⁻¹
🟡 ③ s⁻¹
🔵 ④ mol⁻² L² s⁻¹
🟢 उत्तर: ① mol L⁻¹ s⁻¹
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2011 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–कानपुर
🔵 प्रश्न 27:
किसी अभिक्रिया की दर का तापमान पर निर्भरता Arrhenius समीकरण द्वारा व्यक्त की जाती है। यदि Ea अधिक है तो —
🔴 ① तापमान परिवर्तन का प्रभाव कम होगा
🟢 ② तापमान परिवर्तन का प्रभाव अधिक होगा
🟡 ③ दर स्थिरांक नहीं बदलेगा
🔵 ④ कोई नहीं
🟢 उत्तर: ② तापमान परिवर्तन का प्रभाव अधिक होगा
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2015 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–बॉम्बे
🔵 प्रश्न 28:
यदि किसी अभिक्रिया का दर स्थिरांक 5×10⁻⁴ s⁻¹ है, तो उसका अर्धायु लगभग कितना होगा?
🔴 ① 693 s
🟢 ② 1386 s
🟡 ③ 346 s
🔵 ④ 500 s
🟢 उत्तर: ① 693 s
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2014 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–खड़गपुर
🔵 प्रश्न 29:
किसी द्वितीय क्रम अभिक्रिया के लिए यदि आरंभिक सांद्रता आधी कर दी जाती है, तो अर्धायु कितनी गुना बढ़ जाएगी?
🔴 ① 1
🟢 ② 2
🟡 ③ 4
🔵 ④ 0.5
🟢 उत्तर: ② 2
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2010 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–रूड़की
🔵 प्रश्न 30:
किसी अभिक्रिया का क्रम तापमान बदलने पर —
🔴 ① बदल जाता है
🟢 ② अपरिवर्तित रहता है
🟡 ③ दर स्थिरांक की तरह बदलता है
🔵 ④ दो गुना हो जाता है
🟢 उत्तर: ② अपरिवर्तित रहता है
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2018 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–बॉम्बे
🔵 प्रश्न 31:
Arrhenius समीकरण में A क्या सूचित करता है?
🔴 ① सक्रियण ऊर्जा
🟢 ② आवृत्ति गुणांक
🟡 ③ दर स्थिरांक
🔵 ④ दर
🟢 उत्तर: ② आवृत्ति गुणांक
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2016 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–गुवाहाटी
🔵 प्रश्न 32:
यदि किसी अभिक्रिया में सक्रियण ऊर्जा 60 kJ mol⁻¹ है और R = 8.314 J mol⁻¹ K⁻¹ है, तो 300 K पर Ea/R का मान क्या होगा?
🔴 ① 7200
🟢 ② 7209
🟡 ③ 6018
🔵 ④ 8020
🟢 उत्तर: ② 7209
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2015 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–बॉम्बे
🔵 प्रश्न 33:
यदि किसी अभिक्रिया में सक्रियण ऊर्जा अधिक है, तो उसका दर नियतांक —
🔴 ① अधिक होगा
🟢 ② कम होगा
🟡 ③ समान रहेगा
🔵 ④ शून्य होगा
🟢 उत्तर: ② कम होगा
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2013 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–मद्रास
🔵 प्रश्न 34:
यदि किसी अभिक्रिया की दर नियतांक Arrhenius समीकरण से प्राप्त होता है, तो इसका तापमान के प्रति आरेख (log k बनाम 1/T) —
🔴 ① धनात्मक ढाल वाली रेखा
🟢 ② ऋणात्मक ढाल वाली रेखा
🟡 ③ क्षैतिज रेखा
🔵 ④ कोई नहीं
🟢 उत्तर: ② ऋणात्मक ढाल वाली रेखा
📘 परीक्षा: संयुक्त प्रवेश परीक्षा (उन्नत)
📅 वर्ष: 2012 | पत्र: 1 | संस्थान: भारतीय प्रौद्योगिकी संस्थान–दिल्ली
————————————————————————————————————————————————————————————————————————————
मॉडल प्रश्न पत्र, अभ्यास
🔵 प्रश्न 1:
रासायनिक बलगतिकी का अध्ययन किससे सम्बन्धित है?
🔴 ① अभिक्रियाओं के ऊष्मीय प्रभावों से
🟢 ② अभिक्रियाओं की दरों और तंत्रों से
🟡 ③ ऊष्मागतिकी नियमों से
🔵 ④ इलेक्ट्रॉनिक विन्यास से
🟢 उत्तर: ② अभिक्रियाओं की दरों और तंत्रों से
🎯 कठिनाई: NEET
🔵 प्रश्न 2:
अभिक्रिया की दर को किस रूप में व्यक्त किया जाता है?
🔴 ① अभिकारकों की मात्रा में वृद्धि से
🟢 ② अभिकारकों की मात्रा में कमी या उत्पादों की वृद्धि प्रति समय से
🟡 ③ उत्पादों के ऊर्जा स्तर से
🔵 ④ तापमान के अनुपात से
🟢 उत्तर: ② अभिकारकों की मात्रा में कमी या उत्पादों की वृद्धि प्रति समय से
🎯 कठिनाई: NEET
🔵 प्रश्न 3:
दर नियतांक (rate constant) का मान किससे प्रभावित नहीं होता?
🔴 ① तापमान
🟢 ② दाब
🟡 ③ अभिकारक की सांद्रता
🔵 ④ उत्प्रेरक की उपस्थिति
🟢 उत्तर: ③ अभिकारक की सांद्रता
🎯 कठिनाई: NEET
🔵 प्रश्न 4:
प्रथम क्रम की अभिक्रिया में दर स्थिरांक की इकाई क्या होती है?
🔴 ① mol L⁻¹ s⁻¹
🟢 ② s⁻¹
🟡 ③ mol⁻¹ L s⁻¹
🔵 ④ कोई नहीं
🟢 उत्तर: ② s⁻¹
🎯 कठिनाई: NEET
🔵 प्रश्न 5:
शून्य क्रम अभिक्रिया में दर किस पर निर्भर करती है?
🔴 ① केवल तापमान पर
🟢 ② अभिकारक की सांद्रता पर नहीं
🟡 ③ उत्पाद की सांद्रता पर
🔵 ④ दाब पर
🟢 उत्तर: ② अभिकारक की सांद्रता पर नहीं
🎯 कठिनाई: NEET
🔵 प्रश्न 6:
सक्रियण ऊर्जा (Ea) क्या है?
🔴 ① अभिक्रिया का कुल ऊर्जा परिवर्तन
🟢 ② अभिक्रिया आरम्भ करने के लिए न्यूनतम आवश्यक ऊर्जा
🟡 ③ उत्पाद बनने पर मुक्त हुई ऊर्जा
🔵 ④ अभिकारक की औसत ऊर्जा
🟢 उत्तर: ② अभिक्रिया आरम्भ करने के लिए न्यूनतम आवश्यक ऊर्जा
🎯 कठिनाई: NEET
🔵 प्रश्न 7:
Arrhenius समीकरण k = A e^(-Ea/RT) में ‘A’ क्या प्रदर्शित करता है?
🔴 ① सक्रियण ऊर्जा
🟢 ② आवृत्ति गुणांक
🟡 ③ अभिकारक की ऊर्जा
🔵 ④ दर नियतांक
🟢 उत्तर: ② आवृत्ति गुणांक
🎯 कठिनाई: NEET
🔵 प्रश्न 8:
अभिक्रिया की दर किसके अनुपाती होती है?
🔴 ① तापमान के वर्ग के
🟢 ② अभिकारक की सांद्रता के कुछ घातांक के
🟡 ③ उत्पाद की मात्रा के
🔵 ④ आयतन के
🟢 उत्तर: ② अभिकारक की सांद्रता के कुछ घातांक के
🎯 कठिनाई: NEET
🔵 प्रश्न 9:
अभिक्रिया की औसत दर को किस प्रकार व्यक्त किया जाता है?
🔴 ① ΔC × Δt
🟢 ② ΔC / Δt
🟡 ③ Δt / ΔC
🔵 ④ C × t
🟢 उत्तर: ② ΔC / Δt
🎯 कठिनाई: NEET
🔵 प्रश्न 10:
प्रथम क्रम अभिक्रिया में अर्धायु (t₁/₂) किसके व्युत्क्रमानुपाती होती है?
🔴 ① प्रारम्भिक सांद्रता
🟢 ② दर नियतांक
🟡 ③ सक्रियण ऊर्जा
🔵 ④ तापमान
🟢 उत्तर: ② दर नियतांक
🎯 कठिनाई: NEET
🔵 प्रश्न 11:
तापमान बढ़ाने से अभिक्रिया दर क्यों बढ़ती है?
🔴 ① अभिकारक अणुओं की संख्या घटती है
🟢 ② अधिक अणु आवश्यक सक्रियण ऊर्जा प्राप्त कर लेते हैं
🟡 ③ उत्पाद स्थिर हो जाते हैं
🔵 ④ कोई परिवर्तन नहीं
🟢 उत्तर: ② अधिक अणु आवश्यक सक्रियण ऊर्जा प्राप्त कर लेते हैं
🎯 कठिनाई: NEET
🔵 प्रश्न 12:
दर समीकरण Rate = k[A]^m [B]^n में (m + n) क्या कहलाता है?
🔴 ① आंशिक क्रम
🟢 ② कुल क्रम
🟡 ③ दर नियतांक
🔵 ④ सक्रियण ऊर्जा
🟢 उत्तर: ② कुल क्रम
🎯 कठिनाई: NEET
🔵 प्रश्न 13:
किसी अभिक्रिया की दर का मापन किससे किया जा सकता है?
🔴 ① दाब के परिवर्तन से
🟢 ② सांद्रता के परिवर्तन से
🟡 ③ तापमान के परिवर्तन से
🔵 ④ सभी से
🟢 उत्तर: ④ सभी से
🎯 कठिनाई: NEET
🔵 प्रश्न 14:
Arrhenius समीकरण का लघुगणकीय रूप क्या है?
🔴 ① log k = Ea/RT + log A
🟢 ② log k = log A – Ea/(2.303RT)
🟡 ③ log k = log R – Ea/T
🔵 ④ log k = Ea – RT
🟢 उत्तर: ② log k = log A – Ea/(2.303RT)
🎯 कठिनाई: NEET
🔵 प्रश्न 15:
अभिक्रिया का क्रम क्या बताता है?
🔴 ① ऊष्मा परिवर्तन
🟢 ② दर पर सांद्रता का प्रभाव
🟡 ③ ऊर्जा वितरण
🔵 ④ अभिक्रिया का प्रकार
🟢 उत्तर: ② दर पर सांद्रता का प्रभाव
🎯 कठिनाई: NEET
🔵 प्रश्न 16:
किस अभिक्रिया में दर स्थिरांक का आयाम mol L⁻¹ s⁻¹ होता है?
🔴 ① शून्य क्रम
🟢 ② प्रथम क्रम
🟡 ③ द्वितीय क्रम
🔵 ④ तृतीय क्रम
🟢 उत्तर: ① शून्य क्रम
🎯 कठिनाई: NEET
🔵 प्रश्न 17:
यदि तापमान 10°C बढ़ाने से दर दुगुनी हो जाए, तो यह किस सिद्धांत से सम्बद्ध है?
🔴 ① सक्रियण ऊर्जा
🟢 ② तापमान गुणांक नियम
🟡 ③ ऊष्मा संतुलन
🔵 ④ ऑक्सीकरण सिद्धांत
🟢 उत्तर: ② तापमान गुणांक नियम
🎯 कठिनाई: NEET
🔵 प्रश्न 18:
सक्रियित संयोग सिद्धांत के अनुसार दर किस पर निर्भर करती है?
🔴 ① संयोग की संख्या पर
🟢 ② संयोग की प्रभावी टक्करों पर
🟡 ③ केवल तापमान पर
🔵 ④ ऊर्जा वितरण पर
🟢 उत्तर: ② संयोग की प्रभावी टक्करों पर
🎯 कठिनाई: NEET
🔵 प्रश्न 19:
सक्रियण ऊर्जा बढ़ाने पर अभिक्रिया दर पर क्या प्रभाव पड़ेगा?
🔴 ① बढ़ेगी
🟢 ② घटेगी
🟡 ③ अपरिवर्तित रहेगी
🔵 ④ पहले बढ़ेगी फिर घटेगी
🟢 उत्तर: ② घटेगी
🎯 कठिनाई: NEET
🔵 प्रश्न 20:
उत्प्रेरक सक्रियण ऊर्जा को कैसे प्रभावित करता है?
🔴 ① बढ़ा देता है
🟢 ② घटा देता है
🟡 ③ कोई प्रभाव नहीं
🔵 ④ कभी बढ़ाता कभी घटाता है
🟢 उत्तर: ② घटा देता है
🎯 कठिनाई: NEET
🔵 प्रश्न 21:
अर्धायु का प्रयोग किस लिए किया जाता है?
🔴 ① दर नियतांक ज्ञात करने हेतु
🟢 ② अभिक्रिया की गति ज्ञात करने हेतु
🟡 ③ उत्पाद की शुद्धता ज्ञात करने हेतु
🔵 ④ तापमान निर्धारण हेतु
🟢 उत्तर: ① दर नियतांक ज्ञात करने हेतु
🎯 कठिनाई: NEET
🔵 प्रश्न 22:
किस अभिक्रिया का क्रम भिन्न हो सकता है?
🔴 ① सरल अभिक्रिया
🟢 ② बहुचरणीय अभिक्रिया
🟡 ③ तात्कालिक अभिक्रिया
🔵 ④ प्रकाशीय अभिक्रिया
🟢 उत्तर: ② बहुचरणीय अभिक्रिया
🎯 कठिनाई: NEET
🔵 प्रश्न 23:
यदि Rate = k[A]^2[B], तो कुल क्रम क्या होगा?
🔴 ① 1
🟢 ② 2
🟡 ③ 3
🔵 ④ 0
🟢 उत्तर: ③ 3
🎯 कठिनाई: NEET
🔵 प्रश्न 24:
अभिक्रिया की तात्कालिक दर कैसे निकाली जाती है?
🔴 ① ΔC/Δt
🟢 ② dC/dt
🟡 ③ Δt/ΔC
🔵 ④ C×t
🟢 उत्तर: ② dC/dt
🎯 कठिनाई: NEET
🔵 प्रश्न 25:
Arrhenius समीकरण में Ea/RT का आयाम क्या होता है?
🔴 ① जूल प्रति मोल
🟢 ② विमारहित
🟡 ③ जूल
🔵 ④ कैलोरी
🟢 उत्तर: ② विमारहित
🎯 कठिनाई: NEE
🔵 प्रश्न 26:
यदि किसी प्रथम क्रम अभिक्रिया के लिए दर नियतांक (k) = 0.693 s⁻¹ है, तो अर्धायु (t₁/₂) का मान क्या होगा?
🔴 ① 0.693 s
🟢 ② 1.0 s
🟡 ③ 2.0 s
🔵 ④ 0.347 s
🟢 उत्तर: ① 0.693 s
🎯 कठिनाई: JEE Main
🔵 प्रश्न 27:
किसी द्वितीय क्रम अभिक्रिया में, प्रारम्भिक सांद्रता दुगुनी करने पर दर कितनी गुना बढ़ेगी?
🔴 ① 2 गुना
🟢 ② 4 गुना
🟡 ③ 8 गुना
🔵 ④ 1/2 गुना
🟢 उत्तर: ② 4 गुना
🎯 कठिनाई: JEE Main
🔵 प्रश्न 28:
प्रथम क्रम अभिक्रिया के लिए, दर नियतांक की गणना हेतु कौन-सा सूत्र प्रयुक्त होता है?
🔴 ① k = 2.303/t log(a−x)/a
🟢 ② k = (2.303/t) log(a/(a−x))
🟡 ③ k = a/t
🔵 ④ k = log(a+x)/t
🟢 उत्तर: ② k = (2.303/t) log(a/(a−x))
🎯 कठिनाई: JEE Main
🔵 प्रश्न 29:
यदि किसी अभिक्रिया की दर, तापमान बढ़ाने पर 3 गुना हो जाती है, तो यह दर्शाता है कि —
🔴 ① सक्रियण ऊर्जा बहुत अधिक है
🟢 ② अभिक्रिया ऊष्माशोषी है
🟡 ③ तापमान गुणांक लगभग 3 है
🔵 ④ अभिक्रिया का क्रम घट गया
🟢 उत्तर: ③ तापमान गुणांक लगभग 3 है
🎯 कठिनाई: JEE Main
🔵 प्रश्न 30:
शून्य क्रम अभिक्रिया में दर नियतांक की इकाई क्या होती है?
🔴 ① mol L⁻¹ s⁻¹
🟢 ② mol⁻¹ L s⁻¹
🟡 ③ s⁻¹
🔵 ④ mol² L⁻² s⁻¹
🟢 उत्तर: ① mol L⁻¹ s⁻¹
🎯 कठिनाई: JEE Main
🔵 प्रश्न 31:
यदि किसी अभिक्रिया की दर 25°C पर k₁ है और 35°C पर k₂ है, तो Arrhenius समीकरण के अनुसार —
🔴 ① log(k₂/k₁) = Ea/(2.303R)(1/T₂−1/T₁)
🟢 ② log(k₂/k₁) = Ea/(2.303R)(1/T₁−1/T₂)
🟡 ③ k₂/k₁ = RT/Ea
🔵 ④ log k = Ea/RT
🟢 उत्तर: ② log(k₂/k₁) = Ea/(2.303R)(1/T₁−1/T₂)
🎯 कठिनाई: JEE Main
🔵 प्रश्न 32:
प्रथम क्रम अभिक्रिया की दर किस पर निर्भर नहीं करती?
🔴 ① तापमान
🟢 ② प्रारम्भिक सांद्रता
🟡 ③ सक्रियण ऊर्जा
🔵 ④ उत्प्रेरक
🟢 उत्तर: ② प्रारम्भिक सांद्रता
🎯 कठिनाई: JEE Main
🔵 प्रश्न 33:
यदि किसी अभिक्रिया के लिए t₁/₂ = 10 मिनट है, तो 30 मिनट के बाद शेष अभिकारक का अंश क्या होगा?
🔴 ① 1/2
🟢 ② 1/8
🟡 ③ 1/4
🔵 ④ 3/4
🟢 उत्तर: ② 1/8
🎯 कठिनाई: JEE Main
🔵 प्रश्न 34:
किसी द्वितीय क्रम अभिक्रिया के लिए दर नियतांक ज्ञात करने का समीकरण क्या है?
🔴 ① k = 2.303/t log(a/(a−x))
🟢 ② k = 1/t (x/a(a−x))
🟡 ③ k = 1/t (1/a − 1/(a−x))
🔵 ④ k = a/x
🟢 उत्तर: ③ k = 1/t (1/a − 1/(a−x))
🎯 कठिनाई: JEE Main
🔵 प्रश्न 35:
अभिक्रिया की दर में कमी का मुख्य कारण क्या है?
🔴 ① अभिकारकों की सांद्रता घटती है
🟢 ② तापमान बढ़ता है
🟡 ③ उत्प्रेरक बढ़ता है
🔵 ④ सक्रियण ऊर्जा घटती है
🟢 उत्तर: ① अभिकारकों की सांद्रता घटती है
🎯 कठिनाई: JEE Main
🔵 प्रश्न 36:
एकल टक्कर सिद्धांत में अभिक्रिया दर का निर्धारण किस पर निर्भर करता है?
🔴 ① प्रभावी टक्करों की संख्या पर
🟢 ② अणुओं के आकार पर
🟡 ③ ऊर्जा वितरण पर
🔵 ④ उत्पाद की स्थिरता पर
🟢 उत्तर: ① प्रभावी टक्करों की संख्या पर
🎯 कठिनाई: JEE Main
🔵 प्रश्न 37:
यदि Arrhenius समीकरण के अनुसार log k बनाम 1/T का आलेख बनायें, तो ढाल क्या होगी?
🔴 ① Ea/2.303R
🟢 ② −Ea/2.303R
🟡 ③ 2.303R/Ea
🔵 ④ Ea/RT
🟢 उत्तर: ② −Ea/2.303R
🎯 कठिनाई: JEE Main
🔵 प्रश्न 38:
प्रथम क्रम अभिक्रिया में, किसी भी समय t पर अभिकारक का अंश शेष = 0.25 है। t₁/₂ = 20 सेकंड है। t का मान ज्ञात करें।
🔴 ① 40 सेकंड
🟢 ② 60 सेकंड
🟡 ③ 20 सेकंड
🔵 ④ 10 सेकंड
🟢 उत्तर: ② 60 सेकंड
🎯 कठिनाई: JEE Main
🔵 प्रश्न 39:
यदि अभिक्रिया का क्रम भिन्न (fractional) है, तो इसका कारण क्या है?
🔴 ① अभिक्रिया तात्कालिक है
🟢 ② अभिक्रिया जटिल या बहुचरणीय है
🟡 ③ उत्पाद अस्थिर है
🔵 ④ तापमान बहुत कम है
🟢 उत्तर: ② अभिक्रिया जटिल या बहुचरणीय है
🎯 कठिनाई: JEE Main
🔵 प्रश्न 40:
यदि किसी अभिक्रिया का क्रम 0 है, तो उसकी दर नियतांक की विमा क्या होगी?
🔴 ① mol⁻¹ L s⁻¹
🟢 ② mol L⁻¹ s⁻¹
🟡 ③ s⁻¹
🔵 ④ mol² L⁻² s⁻¹
🟢 उत्तर: ② mol L⁻¹ s⁻¹
🎯 कठिनाई: JEE Main
🚀 अब JEE Advanced स्तर के प्रश्न (41–50):
🔵 प्रश्न 41:
किसी द्वितीय क्रम अभिक्रिया के लिए 75% अभिकारक के अभिक्रिया करने में 50 सेकंड लगते हैं, तो 50% अभिकारक के अभिक्रिया करने का समय क्या होगा?
🔴 ① 16.7 s
🟢 ② 25 s
🟡 ③ 33.3 s
🔵 ④ 10 s
🟢 उत्तर: ① 16.7 s
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 42:
यदि log(k₂/k₁) बनाम (1/T₂−1/T₁) का आलेख सीधी रेखा देता है, तो यह किस सिद्धांत का समर्थन करता है?
🔴 ① टक्कर सिद्धांत
🟢 ② Arrhenius सिद्धांत
🟡 ③ सक्रियण ऊर्जा सिद्धांत
🔵 ④ समन्वय सिद्धांत
🟢 उत्तर: ② Arrhenius सिद्धांत
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 43:
किसी अभिक्रिया का क्रम शून्य है। यदि अभिकारक की प्रारम्भिक सांद्रता a है, तो समय t पर सांद्रता क्या होगी?
🔴 ① a e^(-kt)
🟢 ② a − kt
🟡 ③ a/(1 + kt)
🔵 ④ a + kt
🟢 उत्तर: ② a − kt
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 44:
एक अभिक्रिया दो समानांतर मार्गों से हो सकती है जिनके Ea1 < Ea2 हैं। तो तापमान बढ़ाने पर —
🔴 ① दूसरा मार्ग प्रमुख होगा
🟢 ② पहला मार्ग प्रमुख रहेगा
🟡 ③ दोनों समान रहेंगे
🔵 ④ निष्क्रिय हो जाएगा
🟢 उत्तर: ② पहला मार्ग प्रमुख रहेगा
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 45:
किसी बहुचरणीय अभिक्रिया में दर निर्धारक चरण कौन-सा होता है?
🔴 ① सर्वाधिक तीव्र चरण
🟢 ② सर्वाधिक मंद चरण
🟡 ③ मध्य चरण
🔵 ④ उत्प्रेरित चरण
🟢 उत्तर: ② सर्वाधिक मंद चरण
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 46:
यदि किसी अभिक्रिया का क्रम n है और इकाई s⁻¹ है, तो यह अभिक्रिया किस क्रम की होगी?
🔴 ① प्रथम
🟢 ② द्वितीय
🟡 ③ शून्य
🔵 ④ तृतीय
🟢 उत्तर: ① प्रथम
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 47:
अभिक्रिया 2N₂O₅ → 4NO₂ + O₂ की दर किसके अनुपाती होगी?
🔴 ① [N₂O₅]
🟢 ② [N₂O₅]¹
🟡 ③ [N₂O₅]²
🔵 ④ [O₂]
🟢 उत्तर: ② [N₂O₅]¹
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 48:
किसी अभिक्रिया की दर 3×10⁻³ mol L⁻¹ s⁻¹ है जब [A]=0.2 mol L⁻¹। यदि अभिक्रिया प्रथम क्रम की है, तो दर नियतांक ज्ञात करें।
🔴 ① 1.5×10⁻² s⁻¹
🟢 ② 0.015 s⁻¹
🟡 ③ 2×10⁻² s⁻¹
🔵 ④ 0.01 s⁻¹
🟢 उत्तर: ② 0.015 s⁻¹
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 49:
यदि दर समीकरण Rate = k[A]¹[B]⁰ है, तो क्रम क्या होगा और B की उपस्थिति का क्या प्रभाव होगा?
🔴 ① क्रम 1, B प्रभावहीन
🟢 ② क्रम 1, B उत्प्रेरक
🟡 ③ क्रम 2, B प्रभावकारी
🔵 ④ क्रम 0, B स्थिर
🟢 उत्तर: ① क्रम 1, B प्रभावहीन
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 50:
किसी अभिक्रिया के लिए log k बनाम 1/T का आलेख सीधी रेखा देता है। यदि ढाल −5000 है, तो सक्रियण ऊर्जा (Ea) का मान क्या होगा? (R = 8.314 J mol⁻¹ K⁻¹)
🔴 ① 4.157×10⁴ J mol⁻¹
🟢 ② 3.8×10⁴ J mol⁻¹
🟡 ③ 5×10³ J mol⁻¹
🔵 ④ 2×10⁵ J mol⁻¹
🟢 उत्तर: ① 4.157×10⁴ J mol⁻¹
🎯 कठिनाई: JEE Advanced
————————————————————————————————————————————————————————————————————————————
मस्तिष्क मानचित्र
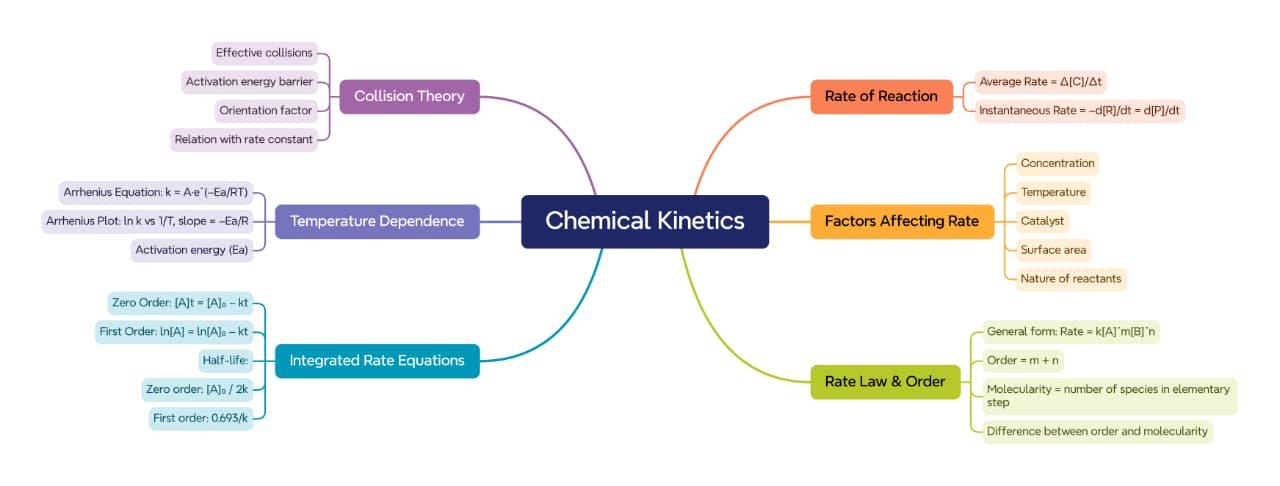
————————————————————————————————————————————————————————————————————————————
