Class 11 : Physics (In Hindi) – अध्याय 11: ऊष्मागतिकी
पाठ का विश्लेषण एवं विवेचन
🌿 परिचय : ऊष्मागतिकी का आधार
ऊष्मागतिकी भौतिकी की वह शाखा है जिसमें ऊष्मा (Heat), कार्य (Work) और ऊर्जा (Energy) के बीच सम्बन्धों का अध्ययन किया जाता है।
यह न केवल भौतिक प्रणालियों के व्यवहार को समझाती है बल्कि यह बताती है कि किस प्रकार ऊर्जा एक रूप से दूसरे रूप में परिवर्तित होती है।
💡 सार:
ऊष्मागतिकी ऊर्जा के रूपान्तरण और संरक्षण के सिद्धान्तों पर आधारित है।
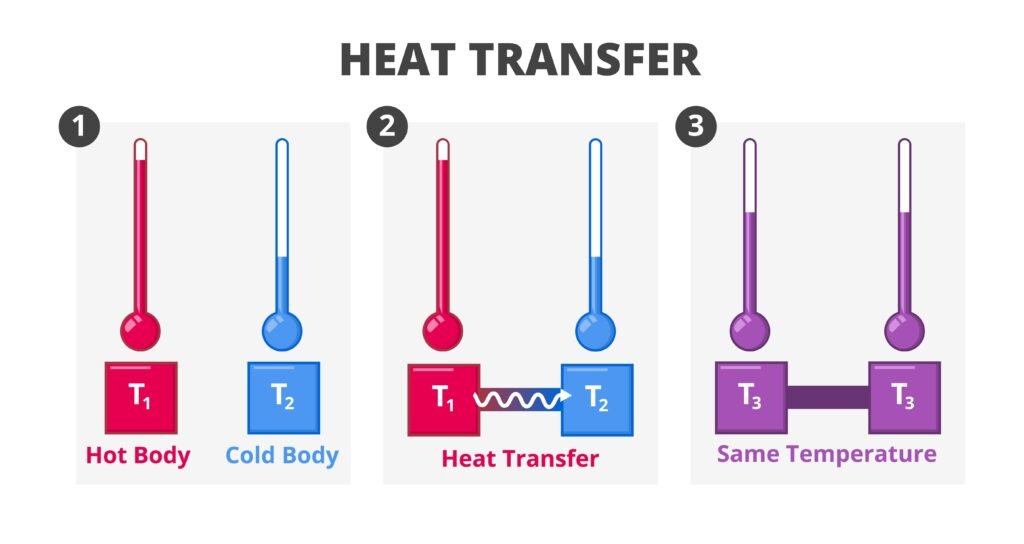
🟢 प्रणाली (System) और परिवेश (Surroundings)
🔹 प्रणाली (System): वह भाग जिसका अध्ययन किया जा रहा है।
🔹 परिवेश (Surroundings): प्रणाली के बाहर का भाग जो प्रणाली के साथ ऊर्जा या पदार्थ का आदान-प्रदान कर सकता है।
✏️ उदाहरण:
एक गैस से भरा पात्र — गैस है प्रणाली, और पात्र तथा वायु है परिवेश।
🔴 प्रणालियों के प्रकार
1️⃣ उदात्त प्रणाली (Open System):
ऊर्जा और पदार्थ दोनों का आदान-प्रदान कर सकती है।
➡️ उदाहरण: खुला पानी का पात्र।
2️⃣ बंद प्रणाली (Closed System):
केवल ऊर्जा का आदान-प्रदान करती है, पदार्थ का नहीं।
➡️ उदाहरण: बंद गैस पात्र।
3️⃣ नियत प्रणाली (Isolated System):
न तो ऊर्जा का और न पदार्थ का आदान-प्रदान करती है।
➡️ उदाहरण: थर्मस बोतल।
🟡 ऊष्मागतिक अवस्था (Thermodynamic State)
किसी गैस या प्रणाली की स्थिति को कुछ मानकों द्वारा वर्णित किया जाता है —
🔹 दाब (P),
🔹 आयतन (V),
🔹 तापमान (T)।
यदि ये तीनों ज्ञात हों, तो प्रणाली की स्थिति निश्चित मानी जाती है।
💡 स्थितिज समीकरण (Equation of State)
किसी गैस की ऊष्मागतिक अवस्था को जोड़ने वाला समीकरण —
P V = n R T
यह समीकरण आदर्श गैस का समीकरण कहलाता है।
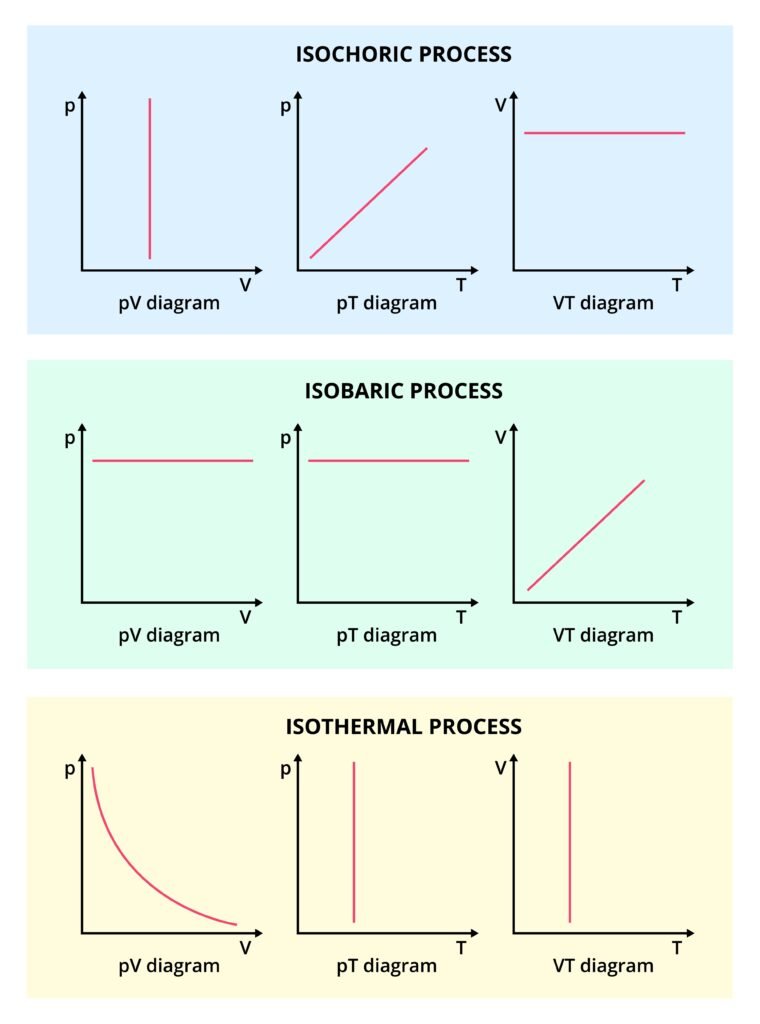
🧠 प्रक्रियाओं के प्रकार (Thermodynamic Processes)
🔵 (1) समतापी प्रक्रिया (Isothermal Process)
➡️ तापमान स्थिर रहता है (ΔT = 0)।
➡️ ऊष्मा का आदान-प्रदान गैस और परिवेश के बीच होता है।
समीकरण: P V = स्थिर।
🟢 (2) समदाब प्रक्रिया (Isobaric Process)
➡️ दाब स्थिर रहता है (ΔP = 0)।
समीकरण: V ∝ T
🟠 (3) समआयतनिकप्रक्रिया (Isochoric Process)
➡️ आयतन स्थिर रहता है (ΔV = 0)।
समीकरण: P ∝ T
🔴 (4) रुद्धोष्म प्रक्रिया (Adiabatic Process)
➡️ कोई ऊष्मा आदान-प्रदान नहीं होता (Q = 0)।
समीकरण: P V^γ = स्थिर, जहाँ γ = Cₚ / Cᵥ।
🌿 ऊष्मागतिकी का प्रथम नियम (First Law of Thermodynamics)
यह ऊर्जा संरक्षण का नियम है।
✏️ विधान:
ऊष्मा और कार्य परस्पर रूपान्तरित हो सकते हैं, परन्तु कुल ऊर्जा स्थिर रहती है।
समीकरण:
ΔQ = ΔU + ΔW
जहाँ —
🔹 ΔQ = प्रणाली को दी गई ऊष्मा
🔹 ΔU = आन्तरिक ऊर्जा में परिवर्तन
🔹 ΔW = प्रणाली द्वारा किया गया कार्य
💡 यदि गैस का प्रसार हो: ΔW = +P ΔV
💡 यदि गैस का संकुचन हो: ΔW = −P ΔV
🔵 आन्तरिक ऊर्जा (Internal Energy)
किसी प्रणाली के अणुओं की सूक्ष्म गति और पारस्परिक बलों से सम्बद्ध कुल ऊर्जा को आन्तरिक ऊर्जा कहते हैं।
यह तापमान, दाब और आयतन पर निर्भर करती है।
🟢 कार्य (Work) की परिभाषा
यदि गैस किसी बाहरी दाब के विरुद्ध ΔV आयतन का प्रसार करे, तो किया गया कार्य —
W = P ΔV
समतापी प्रक्रिया में —
W = n R T ln(V₂ / V₁)
🔴 ऊष्मा (Heat)
ऊष्मा ऊर्जा का वह रूप है जो तापमान के अन्तर के कारण एक प्रणाली से दूसरी में प्रवाहित होती है।
➡️ जब प्रणाली ऊष्मा प्राप्त करती है, Q धनात्मक होता है।
➡️ जब प्रणाली ऊष्मा खोती है, Q ऋणात्मक होता है।
💡 विशिष्ट ऊष्मा (Specific Heat)
किसी पदार्थ की इकाई द्रव्यमान का तापमान 1°C बढ़ाने के लिए आवश्यक ऊष्मा की मात्रा।
नियत आयतन पर विशिष्ट ऊष्मा: Cᵥ
नियत दाब पर विशिष्ट ऊष्मा: Cₚ
γ = Cₚ / Cᵥ
🌿 ऊष्मागतिकी का द्वितीय नियम (Second Law of Thermodynamics)
✴️ विभिन्न रूप में कथन:
1️⃣ क्लॉसियस कथन: ऊष्मा स्वतः ठण्डे पिण्ड से गरम पिण्ड में नहीं जा सकती।
2️⃣ केल्विन-प्लांक कथन: किसी एक ऊष्मा स्रोत से प्राप्त समस्त ऊष्मा को कार्य में परिवर्तित नहीं किया जा सकता।
💡 यह नियम बताता है कि ऊर्जा परिवर्तन में दिशा का निर्धारण होता है।
🧠 एंट्रॉपी (Entropy)
किसी प्रणाली की अव्यवस्था का माप एंट्रॉपी (S) कहलाती है।
समतापी प्रक्रिया के लिए —
ΔS = Q / T
➡️ यदि ΔS = 0 ⇒ प्रत्यावर्ती प्रक्रिया (Reversible Process)
➡️ यदि ΔS > 0 ⇒ अप्रत्यावर्ती प्रक्रिया (Irreversible Process)
⚡ अदियाबतिक प्रक्रिया में सम्बन्ध (Relation in Adiabatic Process)
P V^γ = स्थिर
T V^(γ−1) = स्थिर
T P^((1−γ)/γ) = स्थिर
💡 γ = Cₚ / Cᵥ का मान गैस के प्रकार पर निर्भर करता है।
🔵 ऊष्मा इंजन (Heat Engine)
ऊष्मा इंजन एक ऐसी युक्ति है जो ऊष्मा ऊर्जा को यांत्रिक कार्य में परिवर्तित करती है।
घटक:
1️⃣ ऊष्मा स्रोत (Source)
2️⃣ कार्यकारी पदार्थ (Working Substance)
3️⃣ ऊष्मा पात्र (Sink)
दक्षता (η):
η = W / Q₁ = 1 − (Q₂ / Q₁)
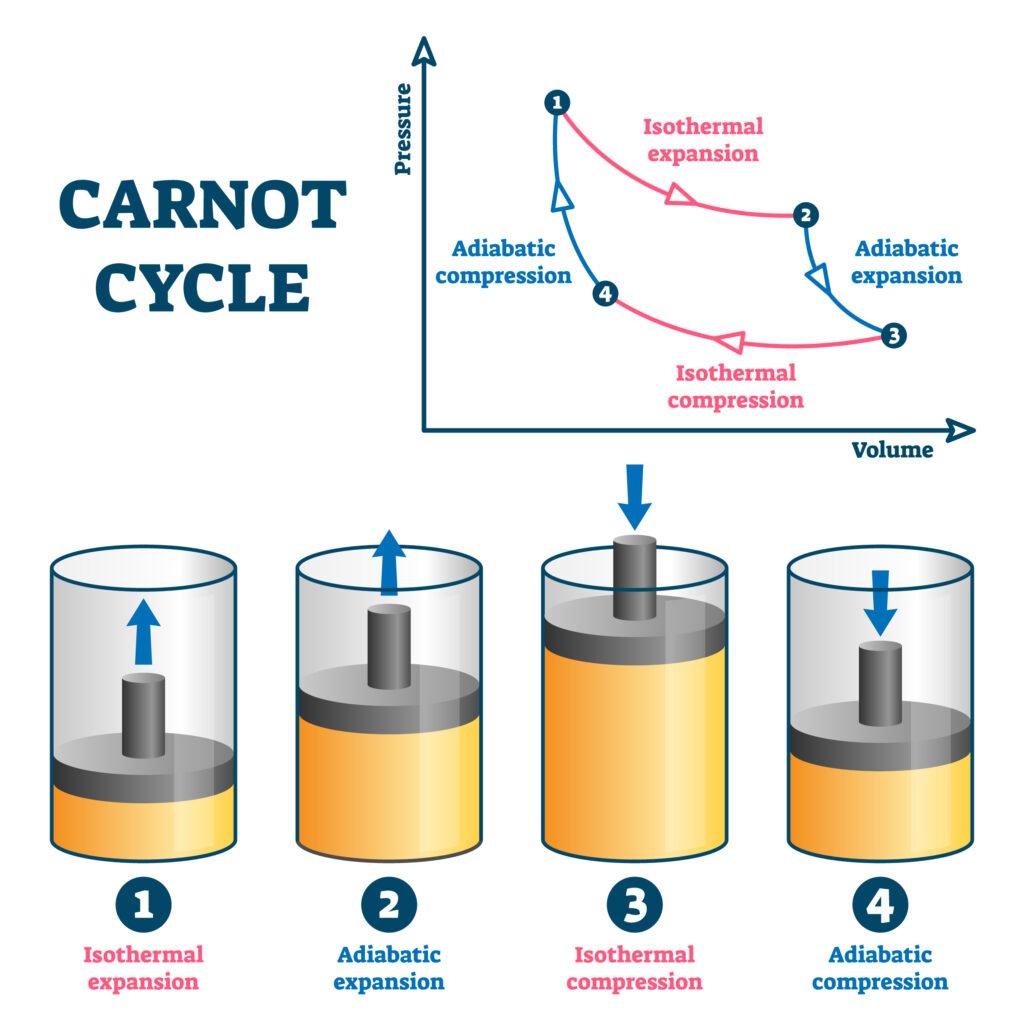
🟢 कार्नो इंजन (Carnot Engine)
सदी का सर्वाधिक दक्ष इंजन जिसका चक्र चार प्रत्यावर्ती प्रक्रियाओं पर आधारित होता है —
🔹 दो समतापी
🔹 दो अदियाबतिक
दक्षता:
η = 1 − (T₂ / T₁)
जहाँ T₁ = स्रोत का तापमान, T₂ = पात्र का तापमान।
🔴 एंट्रॉपी और अपरिवर्तनीयता
किसी वास्तविक इंजन में कुछ ऊर्जा हमेशा अपव्यय होती है, जिससे एंट्रॉपी बढ़ती है।
इसलिए वास्तविक प्रक्रिया सदैव अप्रत्यावर्ती (Irreversible) होती है।
🌿 ऊष्मागतिक संतुलन (Thermodynamic Equilibrium)
यदि प्रणाली में कोई परिवर्तन स्वतः नहीं हो रहा हो, तो वह ऊष्मागतिक संतुलन की अवस्था में होती है।
इसमें तीन संतुलन शामिल होते हैं —
🔹 तापीय संतुलन
🔹 यांत्रिक संतुलन
🔹 रासायनिक संतुलन
💡 ऊष्मागतिक पहचान (Thermodynamic Identity)
किसी सूक्ष्म परिवर्तन के लिए —
dQ = dU + P dV
यह ऊष्मागतिकी के प्रथम नियम का अवकल रूप है।
🟢 भाग 2 – सारांश (Summary ~300 शब्द)
🔸 ऊष्मागतिकी ऊर्जा और कार्य के बीच सम्बन्ध बताने वाला विज्ञान है।
🔸 प्रणाली तीन प्रकार की होती है — उदात्त, बंद, और नियत।
🔸 अवस्था चरों (P, V, T) द्वारा प्रणाली की स्थिति निर्धारित होती है।
🔸 आदर्श गैस का समीकरण: P V = n R T।
🔸 मुख्य प्रक्रियाएँ —
• समतापी (T स्थिर)
• समदाब (P स्थिर)
• समवॉलकीय (V स्थिर)
• अदियाबतिक (Q = 0)।
🔸 ऊष्मागतिकी का प्रथम नियम — ऊर्जा संरक्षण का नियम (ΔQ = ΔU + ΔW)।
🔸 द्वितीय नियम — ऊर्जा रूपान्तरण की दिशा बताता है।
🔸 एंट्रॉपी (S) — अव्यवस्था का माप।
🔸 कार्नो इंजन की दक्षता: η = 1 − (T₂ / T₁)।
🔸 वास्तविक इंजन सदैव अप्रत्यावर्ती होते हैं।
📝 Quick Recap (संक्षिप्त पुनरावृत्ति)
1️⃣ ऊष्मागतिकी ऊर्जा और कार्य के परस्पर रूपान्तरण का अध्ययन है।
2️⃣ ΔQ = ΔU + ΔW — ऊर्जा संरक्षण का गणितीय रूप।
3️⃣ कार्नो इंजन की अधिकतम दक्षता तापमानों पर निर्भर करती है।
4️⃣ एंट्रॉपी का वृद्धि सिद्धान्त प्रकृति की दिशा बताता है।
5️⃣ कोई भी ऊष्मा इंजन 100% दक्ष नहीं हो सकता।
————————————————————————————————————————————————————————————————————————————
पाठ्यपुस्त के प्रश्न
🔷 प्रश्न 11.1
कोई गीज़र 3.0 लीटर प्रति मिनट की दर से बहते हुए जल को 27°C से 77°C तक गर्म करता है। यदि गीज़र का प्रतिफलन (दक्षता) 95% है, तो ईंधन के दहन की दर क्या होगी?
मान लें कि ईंधन का ऊष्मा-मान 4.0×10⁴ J/g है।
उत्तर:
✏️ दिया गया:
जल की मात्रा प्रति मिनट = 3.0 लीटर = 3.0×10⁻³ m³
जल का घनत्व = 10³ kg/m³ ⇒ द्रव्यमान m = 3.0 kg
ΔT = 77 − 27 = 50°C
जल की विशिष्ट ऊष्मा = 4.2×10³ J/(kg·°C)
दक्षता (η) = 95% = 0.95
ईंधन की ऊष्मा क्षमता = 4.0×10⁴ J/g
🟢 चरण 1: जल को दी गई ऊष्मा
Q = m c ΔT
➡️ Q = 3.0 × 4.2×10³ × 50 = 6.3×10⁵ J
🟡 चरण 2: कुल ऊष्मा ईंधन द्वारा दी गई
η = उपयोगी ऊष्मा / कुल ऊष्मा
➡️ कुल ऊष्मा = Q / η = 6.3×10⁵ / 0.95 = 6.63×10⁵ J
🔵 चरण 3: ईंधन का द्रव्यमान
m_fuel = (कुल ऊष्मा) / (ईंधन की ऊष्मा क्षमता)
➡️ m_fuel = 6.63×10⁵ / 4.0×10⁴ = 16.6 g
🔴 चरण 4: समय = 1 मिनट ⇒ दहन की दर
Rate = 16.6 g/min
✔️ अतः ईंधन की दहन दर 16.6 ग्राम प्रति मिनट है।
🔷 प्रश्न 11.2
2.0×10⁻² kg नाइट्रोजन (स्थिर दाब पर) का तापमान 45°C बढ़ाने के लिए कितनी ऊष्मा दी जानी चाहिए?
(N₂ का आणविक द्रव्यमान = 28; R = 8.3 J·mol⁻¹·K⁻¹)
उत्तर:
✏️ दिया गया:
m = 2.0×10⁻² kg = 20 g
M = 28 g/mol
ΔT = 45°C = 45 K
R = 8.3 J·mol⁻¹·K⁻¹
🟢 चरण 1: मोलों की संख्या
n = m / M = 20 / 28 = 0.714 mol
🟡 चरण 2: नाइट्रोजन द्विपरमाणुक गैस ⇒ Cv = (5/2)R, Cp = (7/2)R
🔵 चरण 3: स्थिर दाब पर ऊष्मा
Q = n Cp ΔT
➡️ Q = 0.714 × (7/2) × 8.3 × 45
💡 Q = 0.714 × 3.5 × 8.3 × 45
= 0.714 × 1306.5
= 933 J
✔️ अतः दी गई ऊष्मा = 9.3×10² J (लगभग 933 J)
🔷 प्रश्न 11.3
कथन सही या गलत बताइए —
(a) स्थिर-दाब प्रक्रिया में, गैस को दी गई ऊष्मा उसका आंतरिक ऊर्जा परिवर्तन तथा बाह्य कार्य दोनों के योग के बराबर होती है।
(b) स्थिर-आयतन प्रक्रिया में कोई कार्य नहीं होता।
(c) समतापी प्रक्रिया में गैस की आंतरिक ऊर्जा में कोई परिवर्तन नहीं होता।
(d) ऊष्मा संचरण (हीट ट्रांसफर) का तात्पर्य ऊर्जा का तापांतर के कारण प्रवाह है।
उत्तर:
🟢 (a) ✔️ सही — क्योंकि Q = ΔU + W (ऊष्मागतिक प्रथम नियम)
🟡 (b) ✔️ सही — स्थिर आयतन पर ΔV = 0 ⇒ W = 0
🔵 (c) ✔️ सही — समतापी प्रक्रिया में ΔT = 0 ⇒ ΔU = 0
🔴 (d) ✔️ सही — तापांतर के कारण ऊर्जा का प्रवाह ही ऊष्मा कहलाता है।
🔷 प्रश्न 11.5
(शब्दशः पाठ धुंधला है; पर आशय स्पष्ट है) — एक ऊष्मा-इंजन एक चक्र में उच्च ताप-भंडार A से ऊष्मा ग्रहण करता है और निम्न ताप-भंडार B को 22.3 J ऊष्मा त्यागता है। यदि एक चक्र में किया गया उपयोगी कार्य = 9.35 cal है, तो एक चक्र में भंडार A से ग्रहण की गई ऊष्मा कितनी है?
(1 cal = 4.19 J)
उत्तर:
✏️ दिया गया:
🔵 त्यागी गई ऊष्मा (Q₂) = 22.3 J
🟢 किया गया कार्य (W) = 9.35 cal = 9.35 × 4.19 J = 39.1 J (लगभग)
💡 ऊष्मागतिक प्रथम नियम (एक चक्र):
🔸 Q₁ = W + Q₂ (यहाँ Q₁ = भंडार A से ग्रहण ऊष्मा)
➡️ Q₁ = 39.1 J + 22.3 J = 61.4 J
✔️ उत्तर: एक चक्र में भंडार A से ग्रहण ऊष्मा ≈ 61.4 J (या ≈ 14.7 cal, क्योंकि 61.4/4.19 ≈ 14.7).
💡 (वैकल्पिक) दक्षता η = W/Q₁ = 39.1 / 61.4 ≈ 0.64 (≈ 64%).
🔷 प्रश्न 11.6
(मानक मुक्त-प्रसार स्थिति) — एक कठोर, ऊष्मारुद्ध पात्र दो समान आयतन वाले भागों A व B में विभक्त है। A में आदर्श गैस है (ताप T, दाब P), B निर्वात है। नलिका तुरन्त खोली जाती है। बताइए:
(a) A व B में अंतिम दाब क्या होगा?
(b) अंतिम तापमान क्या होगा?
(c) गैस द्वारा किया गया कार्य कितना है?
(d) गैस की आंतरिक ऊर्जा में कुल परिवर्तन कितना है?
उत्तर:
✏️ स्थितियाँ: पात्र ऊष्मारुद्ध ⇒ Q = 0, दीवारें कठोर ⇒ बाह्य पर कोई पिस्टन-कार्य नहीं। प्रसार निर्वात में मुक्त-प्रसार है। आदर्श गैस।
(a) 🔵 अंतिम दाब: कुल आयतन दुगुना हो जाता है (V → 2V)। आदर्श गैस के लिए सम ताप स्थिति में P ∝ 1/V, अतः
➡️ अंतिम दाब P’ = P/2।
(b) 🟢 अंतिम तापमान: मुक्त-प्रसार में Q = 0, W = 0 ⇒ ΔU = 0। आदर्श गैस के लिए U = f(T) मात्र, अतः ΔU = 0 ⇒ T’ = T।
✔️ ताप अपरिवर्तित।
(c) 🟡 किया गया कार्य: निर्वात के विरुद्ध प्रसार में कोई प्रतिरोध नहीं ⇒ बाह्य कार्य W = 0।
(d) 🔴 आंतरिक ऊर्जा परिवर्तन: ΔU = Q − W = 0 − 0 = 0।
🔷 प्रश्न 11.7
एक हीटर किसी तंत्र को 100 W की दर से ऊष्मा देता है और तंत्र 75 J s⁻¹ की दर से कार्य करता है। तंत्र की आंतरिक ऊर्जा किस दर से बढ़ेगी?
उत्तर:
✏️ प्रथम नियम (दर के रूप में):
🔹 dQ/dt = dU/dt + dW/dt
दिया गया: dQ/dt = 100 J s⁻¹, dW/dt = 75 J s⁻¹
➡️ dU/dt = dQ/dt − dW/dt = 100 − 75 = 25 J s⁻¹
✔️ आंतरिक ऊर्जा की वृद्धि की दर = 25 J s⁻¹।
🔷 प्रश्न 11.8
चित्र में ऊष्मागतिकीय तंत्र को बिन्दु D (600 N/m², 2.0 m³) से बिन्दु E (300 N/m², 5.0 m³) तक ले जाने की प्रक्रिया दिखाई गई है।
रेखीय (सीधी) रेखा DE के साथ तंत्र को ले जाया गया है।
गणना कीजिए कि इस प्रक्रिया में गैस द्वारा किया गया कार्य कितना है।
उत्तर:
✏️ दिया गया:
🔹 प्रारंभिक बिंदु D : P₁ = 600 N/m², V₁ = 2.0 m³
🔹 अंतिम बिंदु E : P₂ = 300 N/m², V₂ = 5.0 m³
🔹 प्रक्रिया — सीधी रेखा (linear) ⇒ दाब आयतन के साथ समान रूप से घटता है।
🟢 चरण 1: दाब और आयतन के बीच संबंध
रेखीय परिवर्तन के लिए दाब P औसत के रूप में लिखा जा सकता है —
➡️ P_avg = (P₁ + P₂) / 2
P_avg = (600 + 300) / 2 = 450 N/m²
🟡 चरण 2: किया गया कार्य
कार्य (W) = औसत दाब × आयतन परिवर्तन
➡️ W = P_avg × (V₂ − V₁)
W = 450 × (5.0 − 2.0)
W = 450 × 3.0 = 1350 J
🔵 चरण 3: दिशा की जाँच
चूँकि तंत्र का आयतन बढ़ रहा है (2 m³ → 5 m³),
इसलिए गैस द्वारा बाह्य कार्य किया गया है।
✔️ अतः गैस द्वारा किया गया कार्य = 1.35×10³ J
💡 अतिरिक्त अवधारणा (Concept):
यदि वही प्रक्रिया विपरीत दिशा (E → D) में होती, तो
कार्य W = −1350 J होता (क्योंकि गैस पर कार्य किया जाता)।
✅ अंतिम उत्तर:
गैस द्वारा किया गया कार्य = 1350 J (E दिशा में आयतन वृद्धि के साथ)
————————————————————————————————————————————————————————————————————————————
अन्य महत्वपूर्ण प्रश्न
(CBSE MODEL प्रश्न पत्र)
सिर्फ इसी पाठ से निर्मित CBSE MODEL प्रश्न पत्र।
🔵 Section A – बहुविकल्पीय प्रश्न (Q1–Q18)
Question 1. ऊष्मागतिकी का अध्ययन किससे सम्बन्धित है?
🔵 (A) केवल ऊष्मा से
🟢 (B) केवल कार्य से
🟠 (C) ऊष्मा, कार्य और ऊर्जा के परस्पर सम्बन्ध से
🔴 (D) केवल ऊर्जा संरक्षण से
Answer: (C) ऊष्मा, कार्य और ऊर्जा के परस्पर सम्बन्ध से
Question 2. निम्नलिखित में से कौन-सी प्रणाली उदात्त प्रणाली (Open system) है?
🔵 (A) थर्मस बोतल
🟢 (B) बन्द गैस पात्र
🟠 (C) उबलता हुआ पानी
🔴 (D) सील किया हुआ सिलेंडर
Answer: (C) उबलता हुआ पानी
Question 3. समतापी प्रक्रिया में क्या स्थिर रहता है?
🔵 (A) तापमान
🟢 (B) दाब
🟠 (C) आयतन
🔴 (D) ऊर्जा
Answer: (A) तापमान
Question 4. समदाब प्रक्रिया में कार्य का सूत्र क्या है?
🔵 (A) W = nRΔT
🟢 (B) W = PΔV
🟠 (C) W = nRT ln(V₂/V₁)
🔴 (D) W = 0
Answer: (A) W = nRΔT
Question 5. अदियाबतिक प्रक्रिया के लिए कौन-सा सम्बन्ध सत्य है?
🔵 (A) PV = स्थिर
🟢 (B) PV^γ = स्थिर
🟠 (C) PT = स्थिर
🔴 (D) T/V = स्थिर
Answer: (B) PV^γ = स्थिर
Question 6. ऊष्मागतिकी का प्रथम नियम किस सिद्धान्त पर आधारित है?
🔵 (A) ऊर्जा संरक्षण
🟢 (B) संवेग संरक्षण
🟠 (C) द्रव्यमान संरक्षण
🔴 (D) बल संतुलन
Answer: (A) ऊर्जा संरक्षण
Question 7. ऊष्मागतिकी के प्रथम नियम का गणितीय रूप क्या है?
🔵 (A) ΔQ = ΔW − ΔU
🟢 (B) ΔQ = ΔU + ΔW
🟠 (C) ΔQ = ΔU − ΔW
🔴 (D) ΔW = ΔU + ΔQ
Answer: (B) ΔQ = ΔU + ΔW
Question 8. यदि गैस प्रसारित होती है तो कार्य W का चिन्ह क्या होगा?
🔵 (A) धनात्मक
🟢 (B) ऋणात्मक
🟠 (C) शून्य
🔴 (D) अनंत
Answer: (A) धनात्मक
Question 9. यदि गैस का आयतन नियत रहता है तो किया गया कार्य —
🔵 (A) अधिकतम
🟢 (B) शून्य
🟠 (C) न्यूनतम
🔴 (D) ऋणात्मक
Answer: (B) शून्य
Question 10. नियत आयतन पर विशिष्ट ऊष्मा का प्रतीक क्या है?
🔵 (A) Cₚ
🟢 (B) Cᵥ
🟠 (C) R
🔴 (D) γ
Answer: (B) Cᵥ
Question 11. नियत दाब पर विशिष्ट ऊष्मा का प्रतीक —
🔵 (A) Cᵥ
🟢 (B) Cₚ
🟠 (C) R
🔴 (D) γ
Answer: (B) Cₚ
Question 12. γ का परिभाषा क्या है?
🔵 (A) γ = Cᵥ / Cₚ
🟢 (B) γ = Cₚ / Cᵥ
🟠 (C) γ = R / Cₚ
🔴 (D) γ = Cᵥ / R
Answer: (B) γ = Cₚ / Cᵥ
Question 13. किसी आदर्श गैस के लिए, यदि आयतन दोगुना हो जाए, तो समतापी प्रक्रिया में किया गया कार्य —
🔵 (A) nRT ln2
🟢 (B) nRT
🟠 (C) nRT/2
🔴 (D) 2nRT
Answer: (A) nRT ln2
Question 14. किस प्रक्रिया में ऊष्मा का आदान-प्रदान नहीं होता?
🔵 (A) समदाब
🟢 (B) समतापी
🟠 (C) अदियाबतिक
🔴 (D) समवॉलकीय
Answer: (C) अदियाबतिक
Question 15. कार्नो इंजन की दक्षता का सूत्र —
🔵 (A) η = 1 − (Q₂ / Q₁)
🟢 (B) η = 1 − (T₂ / T₁)
🟠 (C) η = Q₁ / Q₂
🔴 (D) η = T₁ / T₂
Answer: (B) η = 1 − (T₂ / T₁)
Question 16. कार्नो इंजन की दक्षता पर कौन-सा कारक प्रभाव नहीं डालता?
🔵 (A) कार्यकारी पदार्थ
🟢 (B) स्रोत और पात्र का तापमान
🟠 (C) तापान्तर
🔴 (D) T₁ और T₂
Answer: (A) कार्यकारी पदार्थ
Question 17. क्लॉसियस कथन किस नियम से सम्बन्धित है?
🔵 (A) प्रथम नियम
🟢 (B) द्वितीय नियम
🟠 (C) तृतीय नियम
🔴 (D) शून्यवाँ नियम
Answer: (B) द्वितीय नियम
Question 18. एंट्रॉपी में परिवर्तन का सूत्र क्या है?
🔵 (A) ΔS = Q / T
🟢 (B) ΔS = T / Q
🟠 (C) ΔS = Q × T
🔴 (D) ΔS = T² / Q
Answer: (A) ΔS = Q / T
Question 19.
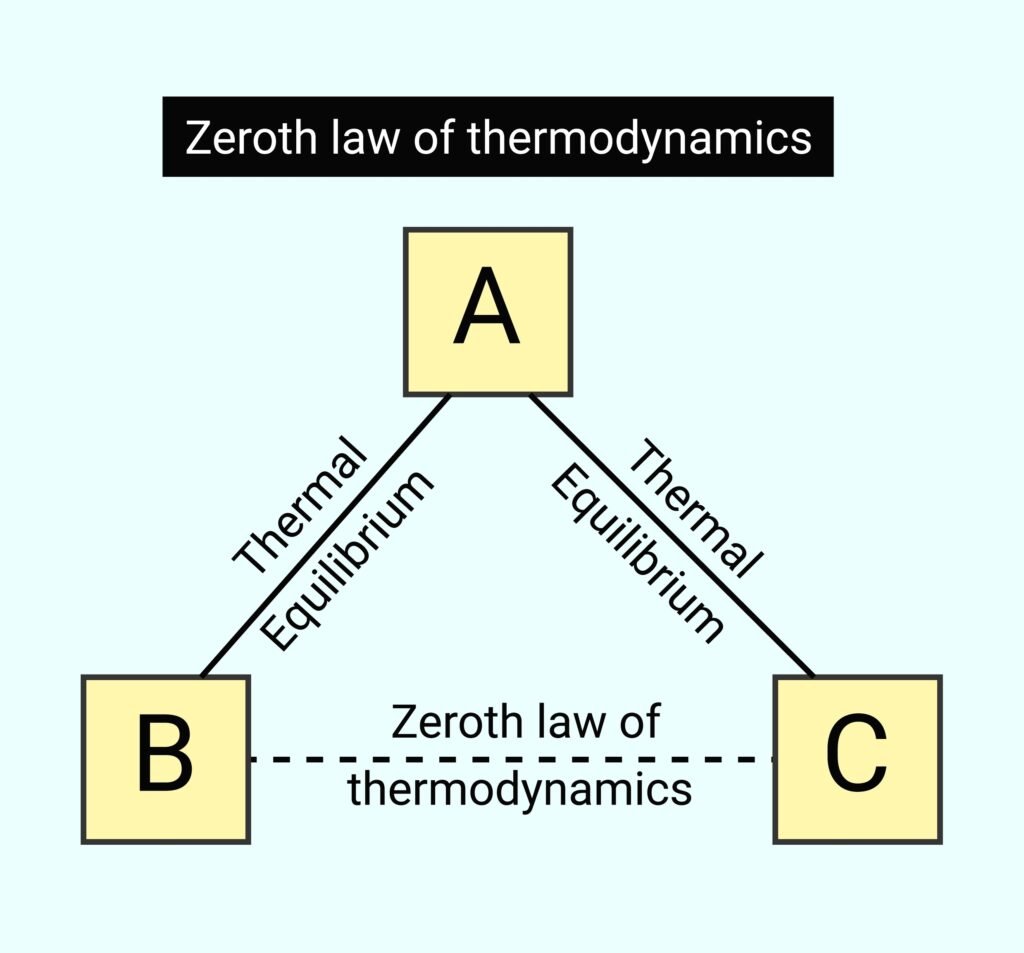
ऊष्मागतिकी के शून्यवाँ नियम (Zeroth Law) को स्पष्ट कीजिए।
Answer:
🔹 यह नियम तापीय संतुलन की अवधारणा को परिभाषित करता है।
✏️ विधान: यदि कोई दो प्रणालियाँ किसी तीसरी प्रणाली के साथ पृथक-पृथक तापीय संतुलन में हों, तो वे दोनों एक-दूसरे के साथ भी तापीय संतुलन में होंगी।
💡 महत्व:
➡️ यह तापमान को परिभाषित करने का आधार प्रदान करता है।
➡️ तापमापी का कार्य इसी नियम पर आधारित है।
Question 20.
ऊष्मागतिकी के प्रथम नियम का कथन कीजिए तथा इसका भौतिक अर्थ बताइए।
Answer:
✏️ विधान:
जब किसी प्रणाली में ऊष्मा ΔQ प्रविष्ट होती है, तो उसका एक भाग प्रणाली की आन्तरिक ऊर्जा ΔU को बढ़ाता है और शेष भाग ΔW प्रणाली द्वारा कार्य के रूप में परिवेश पर किया जाता है।
➡️ गणितीय रूप: ΔQ = ΔU + ΔW
💡 भौतिक अर्थ:
यह नियम ऊर्जा संरक्षण का नियम है — ऊष्मा और कार्य परस्पर रूपान्तरित हो सकते हैं, परन्तु कुल ऊर्जा स्थिर रहती है।
Question 21.
आदर्श गैस के लिए समतापी प्रक्रिया में किया गया कार्य व्युत्पन्न कीजिए।
Answer:
➡️ समतापी प्रक्रिया में तापमान स्थिर रहता है ⇒ ΔT = 0।
P V = n R T ⇒ P = n R T / V
अब किया गया कार्य —
W = ∫ P dV = ∫ (n R T / V) dV = n R T ln(V₂ / V₁)
✔️ निष्कर्ष:
समतापी प्रक्रिया में किया गया कार्य
W = n R T ln(V₂ / V₁)
Question 22.
अदियाबतिक प्रक्रिया में कार्य का व्यंजक लिखिए।
Answer:
अदियाबतिक प्रक्रिया के लिए Q = 0 होता है।
प्रथम नियम के अनुसार —
ΔQ = ΔU + ΔW ⇒ 0 = ΔU + ΔW ⇒ ΔW = −ΔU
आदर्श गैस के लिए ΔU = n Cᵥ (T₂ − T₁)
अतः किया गया कार्य —
W = n Cᵥ (T₁ − T₂)
✔️ निष्कर्ष:
अदियाबतिक प्रसार में (T₂ < T₁) ⇒ W धनात्मक,
अदियाबतिक संपीड़न में (T₂ > T₁) ⇒ W ऋणात्मक।
Question 23.
Cₚ और Cᵥ के बीच सम्बन्ध सिद्ध कीजिए।
Answer:
ऊष्मागतिकी के प्रथम नियम के अनुसार —
ΔQ = ΔU + P ΔV
आदर्श गैस के लिए P V = n R T ⇒ ΔV = (n R ΔT)/P
समदाब प्रक्रिया में:
ΔQ = n Cₚ ΔT = n Cᵥ ΔT + P ΔV
अब, P ΔV = n R ΔT
अतः
n Cₚ ΔT = n Cᵥ ΔT + n R ΔT
⇒ Cₚ − Cᵥ = R
✔️ यह आदर्श गैसों का मूल सम्बन्ध है।
Question 24.
ऊष्मागतिकी के द्वितीय नियम का क्लॉसियस और केल्विन-प्लांक रूप में कथन कीजिए।
Answer:
🔹 क्लॉसियस कथन:
ऊष्मा स्वतः ठण्डे पिण्ड से गरम पिण्ड में नहीं जा सकती।
🔹 केल्विन-प्लांक कथन:
कोई इंजन ऐसा नहीं बनाया जा सकता जो किसी एक स्रोत से ऊष्मा ग्रहण करके उसका सम्पूर्ण भाग कार्य में परिवर्तित कर दे।
✔️ दोनों कथन समान हैं और ऊर्जा परिवर्तन की दिशा को दर्शाते हैं।
Question 25.
कार्नो इंजन की दक्षता का सूत्र सिद्ध कीजिए।
Answer:
कार्नो इंजन दो समतापी और दो अदियाबतिक प्रक्रियाओं से कार्य करता है।
यदि स्रोत से ली गई ऊष्मा Q₁ और पात्र को दी गई ऊष्मा Q₂ हो, तो —
दक्षता (η) = W / Q₁ = 1 − (Q₂ / Q₁)
समतापी प्रक्रियाओं से:
Q₁ / Q₂ = T₁ / T₂
अतः
η = 1 − (T₂ / T₁)
✔️ यह अधिकतम सम्भव दक्षता का व्यंजक है।
Question 26.
एंट्रॉपी (Entropy) का भौतिक अर्थ क्या है?
Answer:
एंट्रॉपी किसी प्रणाली की अव्यवस्था की मात्रा का माप है।
यह बताती है कि किसी प्रक्रिया में ऊर्जा किस दिशा में प्रवाहित होगी।
समतापी प्रक्रिया के लिए —
ΔS = Q / T
➡️ यदि ΔS = 0 ⇒ प्रत्यावर्ती प्रक्रिया
➡️ यदि ΔS > 0 ⇒ अप्रत्यावर्ती प्रक्रिया
✔️ एंट्रॉपी सदैव बढ़ती है; यह प्रकृति की स्वाभाविक दिशा को निर्धारित करती है।
Question 27.
ऊष्मागतिक संतुलन की अवस्था समझाइए।
Answer:
जब प्रणाली में कोई स्वतः परिवर्तन नहीं हो रहा हो, तब वह ऊष्मागतिक संतुलन में होती है।
इसमें तीन प्रकार के संतुलन सम्मिलित होते हैं —
🔹 तापीय संतुलन
🔹 यांत्रिक संतुलन
🔹 रासायनिक संतुलन
✔️ यदि तीनों संतुलन एक साथ विद्यमान हों, तो प्रणाली पूर्ण ऊष्मागतिक संतुलन में कही जाती है।
(दीर्घ एवं केस आधारित प्रश्न)
Question 28.
ऊष्मागतिकी के प्रथम नियम (ΔQ = ΔU + ΔW) को एक गैस के समतापी प्रसार पर लागू करके समझाइए।
Answer:
🔹 समतापी प्रक्रिया में तापमान स्थिर रहता है अर्थात् ΔT = 0।
तापमान न बदलने से गैस की आन्तरिक ऊर्जा (ΔU) भी स्थिर रहती है, अतः ΔU = 0।
✏️ ऊष्मागतिकी का प्रथम नियम:
ΔQ = ΔU + ΔW
अब, ΔU = 0 ⇒ ΔQ = ΔW
➡️ इसका अर्थ है कि गैस द्वारा किया गया कार्य उसी ऊष्मा के बराबर होता है जो उसे दी जाती है।
💡 उदाहरण:
जब गैस को धीरे-धीरे गर्म किया जाता है तो वह फैलती है और बाह्य दाब के विरुद्ध कार्य करती है।
इस स्थिति में सारी ऊष्मा कार्य में परिवर्तित हो जाती है, आन्तरिक ऊर्जा नहीं बदलती।
✔️ निष्कर्ष:
समतापी प्रक्रिया में Q = W तथा ΔU = 0 होता है।
Question 29.
अदियाबतिक प्रक्रिया में दाब और आयतन के बीच सम्बन्ध सिद्ध कीजिए।
Answer:
अदियाबतिक प्रक्रिया में ऊष्मा का आदान-प्रदान नहीं होता, अतः Q = 0।
प्रथम नियम के अनुसार:
ΔQ = ΔU + ΔW ⇒ 0 = ΔU + ΔW ⇒ ΔU = −ΔW
आदर्श गैस के लिए —
ΔU = n Cᵥ (T₂ − T₁) और ΔW = ∫ P dV
अब, P V = n R T ⇒ T = (P V) / (n R)
इन दोनों को जोड़ने पर और ΔU = −ΔW रखने पर मिलता है:
P V^γ = स्थिर, जहाँ γ = Cₚ / Cᵥ
💡 निष्कर्ष:
अदियाबतिक प्रक्रिया में दाब और आयतन का गुणनफल किसी नियत घात (γ) के साथ स्थिर रहता है।
Question 30.
कार्नो इंजन की कार्य प्रणाली का वर्णन कीजिए और दक्षता का व्यंजक व्युत्पन्न कीजिए।
Answer:
🌿 कार्नो इंजन की चार अवस्थाएँ:
1️⃣ समतापी प्रसार (A → B): गैस T₁ ताप पर Q₁ ऊष्मा ग्रहण करती है।
2️⃣ अदियाबतिक प्रसार (B → C): गैस T₁ से T₂ ताप तक फैलती है।
3️⃣ समतापी संपीड़न (C → D): गैस T₂ ताप पर Q₂ ऊष्मा पात्र को देती है।
4️⃣ अदियाबतिक संपीड़न (D → A): गैस पुनः प्रारम्भिक अवस्था में लौटती है।
✏️ कुल कार्य:
W = Q₁ − Q₂
दक्षता (η):
η = W / Q₁ = 1 − (Q₂ / Q₁)
समतापी अवस्था में Q₁ / Q₂ = T₁ / T₂
अतः
η = 1 − (T₂ / T₁)
✔️ निष्कर्ष:
कार्नो इंजन की दक्षता केवल तापमानों पर निर्भर करती है, कार्यकारी पदार्थ पर नहीं।
Question 31.
एंट्रॉपी (Entropy) का सिद्धान्त समझाइए तथा अप्रत्यावर्ती प्रक्रियाओं में एंट्रॉपी का व्यवहार स्पष्ट कीजिए।
Answer:
🔹 एंट्रॉपी किसी प्रणाली की अव्यवस्था का माप है।
🔹 किसी समतापी प्रक्रिया के लिए — ΔS = Q / T
➡️ प्रत्यावर्ती प्रक्रिया में ΔS = 0
➡️ अप्रत्यावर्ती प्रक्रिया में ΔS > 0
💡 भौतिक अर्थ:
अप्रत्यावर्ती प्रक्रिया में ऊर्जा का अपव्यय होता है, जिससे प्रणाली की एंट्रॉपी बढ़ती है।
प्रकृति में सभी प्रक्रियाएँ ऐसी दिशा में चलती हैं जिससे कुल एंट्रॉपी बढ़े।
✔️ निष्कर्ष:
एंट्रॉपी वृद्धि का सिद्धान्त प्रकृति की दिशा को निर्धारित करता है — यह बताता है कि ऊष्मा स्वतः ठण्डे से गरम पिण्ड में नहीं जाएगी।
Question 32.
द्वितीय नियम के आधार पर यह सिद्ध कीजिए कि कोई भी इंजन 100% दक्ष नहीं हो सकता।
Answer:
द्वितीय नियम के अनुसार —
“कोई भी इंजन ऐसा नहीं बनाया जा सकता जो किसी एक ऊष्मा स्रोत से ऊष्मा ग्रहण करके उसे पूर्ण रूप से कार्य में बदल दे।”
✏️ कारण:
हर इंजन को कुछ ऊष्मा Q₂ को निम्न ताप पात्र में छोड़ना ही पड़ता है।
η = 1 − (Q₂ / Q₁)
यहाँ Q₂ > 0, अतः η सदैव 1 से कम होगी।
✔️ निष्कर्ष:
कोई भी वास्तविक इंजन 100% दक्ष नहीं हो सकता क्योंकि कुछ ऊष्मा अनिवार्य रूप से पात्र में चली जाती है।
Question 33.
केस आधारित प्रश्न — एक गैस से भरे बेलन में गतिशील पिस्टन लगा है। गैस को धीरे-धीरे गर्म किया जाता है जिससे वह समदाब प्रक्रिया में 2 L से 4 L तक फैलती है।
यदि दाब 2×10⁵ Pa है, तो गैस द्वारा किया गया कार्य ज्ञात कीजिए।
Answer:
✏️ दिए गए आँकड़े:
P = 2×10⁵ Pa
V₁ = 2 L = 2×10⁻³ m³
V₂ = 4 L = 4×10⁻³ m³
➡️ सूत्र:
W = P (V₂ − V₁)
= 2×10⁵ × (4×10⁻³ − 2×10⁻³)
= 2×10⁵ × 2×10⁻³
= 400 J
✔️ निष्कर्ष:
गैस द्वारा किया गया कार्य W = 400 J है।
Question 28.
ऊष्मागतिकी के प्रथम नियम (ΔQ = ΔU + ΔW) को समदाब प्रक्रिया (Isobaric Process) पर लागू करके समझाइए।
Answer:
🔹 समदाब प्रक्रिया में दाब (P) स्थिर रहता है।
🔹 गैस को दी गई ऊष्मा का एक भाग आन्तरिक ऊर्जा बढ़ाने में तथा शेष भाग बाह्य कार्य में प्रयुक्त होता है।
✏️ प्रथम नियम:
ΔQ = ΔU + ΔW
अब, ΔW = P ΔV
और ΔU = n Cᵥ ΔT
अतः
ΔQ = n Cᵥ ΔT + P ΔV
आदर्श गैस समीकरण से — P ΔV = n R ΔT
अतः
ΔQ = n (Cᵥ + R) ΔT
परंतु, Cₚ = Cᵥ + R
अतः
ΔQ = n Cₚ ΔT
💡 निष्कर्ष:
समदाब प्रक्रिया में प्रणाली को दी गई ऊष्मा प्रणाली की आन्तरिक ऊर्जा को बढ़ाती है और कार्य करने में भी प्रयुक्त होती है।
Question 29.
अदियाबतिक प्रक्रिया के लिए P, V और T के बीच सम्बन्ध सिद्ध कीजिए।
Answer:
अदियाबतिक प्रक्रिया में Q = 0 होता है।
ऊष्मागतिकी के प्रथम नियम के अनुसार:
ΔQ = ΔU + ΔW ⇒ 0 = ΔU + ΔW ⇒ ΔU = −ΔW
अब, ΔU = n Cᵥ (T₂ − T₁),
और कार्य W = ∫ P dV।
P V = n R T ⇒ T = P V / (n R)
गणना करने पर प्राप्त होता है —
P V^γ = स्थिर
जहाँ γ = Cₚ / Cᵥ
इसी से आगे —
T V^(γ−1) = स्थिर तथा T P^((1−γ)/γ) = स्थिर
✔️ निष्कर्ष:
अदियाबतिक प्रक्रिया में तीनों राशियों के बीच यह पारस्परिक सम्बन्ध सदैव सत्य रहता है।
Question 30.
कार्नो चक्र की व्याख्या कीजिए तथा इसकी दक्षता का व्यंजक सिद्ध कीजिए।
Answer:
कार्नो इंजन ऊष्मा को कार्य में परिवर्तित करने की आदर्श प्रणाली है।
यह चार प्रत्यावर्ती अवस्थाओं पर आधारित है —
🌿 (i) समतापी प्रसार (A → B): गैस स्रोत (T₁) से ऊष्मा Q₁ ग्रहण करती है।
🌿 (ii) अदियाबतिक प्रसार (B → C): गैस तापमान T₁ से T₂ तक फैलती है।
🌿 (iii) समतापी संपीड़न (C → D): गैस Q₂ ऊष्मा पात्र (T₂) को छोड़ती है।
🌿 (iv) अदियाबतिक संपीड़न (D → A): गैस पुनः प्रारम्भिक अवस्था में लौटती है।
✏️ दक्षता का व्यंजक:
η = (Q₁ − Q₂) / Q₁ = 1 − (Q₂ / Q₁)
समतापी प्रक्रियाओं में Q₁ / Q₂ = T₁ / T₂
अतः
η = 1 − (T₂ / T₁)
✔️ निष्कर्ष:
कार्नो इंजन की दक्षता केवल तापमानों पर निर्भर करती है, कार्यकारी पदार्थ पर नहीं।
Question 31.
एंट्रॉपी (Entropy) का नियम स्पष्ट कीजिए तथा इसका भौतिक अर्थ बताइए।
Answer:
🔹 एंट्रॉपी किसी प्रणाली की अव्यवस्था की मात्रा का माप है।
🔹 किसी समतापी प्रत्यावर्ती प्रक्रिया के लिए — ΔS = Q / T
➡️ यदि ΔS = 0 → प्रक्रिया प्रत्यावर्ती है।
➡️ यदि ΔS > 0 → प्रक्रिया अप्रत्यावर्ती है।
💡 भौतिक अर्थ:
प्रत्येक वास्तविक प्रक्रिया में कुछ ऊर्जा का अपव्यय होता है।
अतः प्रकृति में एंट्रॉपी सदैव बढ़ती है, जो प्रणाली की अव्यवस्था को दर्शाती है।
✔️ निष्कर्ष:
एंट्रॉपी वृद्धि का सिद्धान्त यह बताता है कि ऊर्जा का प्रवाह सदैव उच्च ताप से निम्न ताप की दिशा में होता है।
Question 32.
द्वितीय नियम के आधार पर सिद्ध कीजिए कि कोई भी इंजन 100% दक्ष नहीं हो सकता।
Answer:
🔹 द्वितीय नियम के केल्विन-प्लांक कथन के अनुसार —
“ऐसा कोई इंजन नहीं बनाया जा सकता जो किसी एक स्रोत से ऊष्मा ग्रहण करके उसकी सम्पूर्ण मात्रा को कार्य में परिवर्तित कर दे।”
✏️ गणितीय रूप:
η = 1 − (Q₂ / Q₁)
यहाँ Q₂ > 0 है, अतः (Q₂ / Q₁) धनात्मक होगा।
इसलिए η < 1
💡 निष्कर्ष:
प्रत्येक इंजन को कुछ ऊष्मा पात्र में छोड़नी ही पड़ती है, अतः कोई इंजन 100% दक्ष नहीं हो सकता।
Question 33.
केस आधारित प्रश्न —
एक गैस से भरे सिलेंडर में गतिशील पिस्टन लगा है। यदि गैस समवॉलकीय प्रक्रिया में 300 K से 600 K तक गरम की जाती है, दाब 2×10⁵ Pa है, तो गैस को दी गई ऊष्मा ज्ञात कीजिए।
(मान लें n = 1 mol, Cᵥ = 3R/2, R = 8.3 J/mol·K)
Answer:
✏️ दिए गए आँकड़े:
P = 2×10⁵ Pa
T₁ = 300 K, T₂ = 600 K
n = 1 mol, Cᵥ = 3R/2
➡️ सूत्र:
Q = n Cᵥ (T₂ − T₁)
= 1 × (3×8.3/2) × (600 − 300)
= (12.45) × 300
= 3735 J
💡 निष्कर्ष:
समवॉलकीय प्रक्रिया में गैस को दी गई ऊष्मा Q = 3.74 × 10³ J है।
————————————————————————————————————————————————————————————————————————————
Neet पिछले सालों के प्रश्न
🔴 प्रश्न 1:
ऊष्मागतिकी का प्रथम नियम क्या कहता है?
🟢 1️⃣ ऊर्जा न तो उत्पन्न की जा सकती है न नष्ट
🔵 2️⃣ ऊष्मा = कार्य + आंतरिक ऊर्जा परिवर्तन
🟡 3️⃣ दोनों सही हैं
🟣 4️⃣ कोई नहीं
✔️ उत्तर: दोनों सही हैं
📘 Exam: NEET 2024
🔴 प्रश्न 2:
ऊष्मागतिकी के प्रथम नियम को किस समीकरण से व्यक्त किया जाता है?
🟢 1️⃣ ΔQ = ΔU + W
🔵 2️⃣ ΔU = ΔQ + W
🟡 3️⃣ W = ΔQ + ΔU
🟣 4️⃣ ΔQ = W – ΔU
✔️ उत्तर: ΔQ = ΔU + W
📘 Exam: NEET 2023
🔴 प्रश्न 3:
समतापीय प्रक्रिया में ΔU = ?
🟢 1️⃣ 0
🔵 2️⃣ ΔQ
🟡 3️⃣ W
🟣 4️⃣ ΔQ – W
✔️ उत्तर: 0
📘 Exam: NEET 2022
🔴 प्रश्न 4:
नियत आयतन पर कार्य W = ?
🟢 1️⃣ 0
🔵 2️⃣ ΔQ
🟡 3️⃣ ΔU
🟣 4️⃣ ΔQ + ΔU
✔️ उत्तर: 0
📘 Exam: NEET 2021
🔴 प्रश्न 5:
नियत दाब पर विशिष्ट ऊष्मा Cₚ और नियत आयतन पर विशिष्ट ऊष्मा Cᵥ के बीच संबंध —
🟢 1️⃣ Cₚ = Cᵥ
🔵 2️⃣ Cₚ > Cᵥ
🟡 3️⃣ Cₚ < Cᵥ 🟣 4️⃣ Cₚ = 2Cᵥ ✔️ उत्तर: Cₚ > Cᵥ
📘 Exam: NEET 2020
🔴 प्रश्न 6:
एडियाबेटिक प्रक्रिया में ΔQ = ?
🟢 1️⃣ 0
🔵 2️⃣ ΔU
🟡 3️⃣ W
🟣 4️⃣ ΔU + W
✔️ उत्तर: 0
📘 Exam: NEET 2019
🔴 प्रश्न 7:
एडियाबेटिक प्रक्रिया में PV^γ = ?
🟢 1️⃣ स्थिर
🔵 2️⃣ 0
🟡 3️⃣ बढ़ता
🟣 4️⃣ घटता
✔️ उत्तर: स्थिर
📘 Exam: NEET 2018
🔴 प्रश्न 8:
एडियाबेटिक प्रक्रिया में T × V^(γ–1) = ?
🟢 1️⃣ स्थिर
🔵 2️⃣ 0
🟡 3️⃣ बढ़ता
🟣 4️⃣ घटता
✔️ उत्तर: स्थिर
📘 Exam: NEET 2017
🔴 प्रश्न 9:
एडियाबेटिक प्रक्रिया में T^γ × P^(1–γ) = ?
🟢 1️⃣ स्थिर
🔵 2️⃣ 0
🟡 3️⃣ बढ़ता
🟣 4️⃣ घटता
✔️ उत्तर: स्थिर
📘 Exam: NEET 2016
🔴 प्रश्न 10:
समतापीय प्रक्रिया में किया गया कार्य —
🟢 1️⃣ W = nRT ln(V₂/V₁)
🔵 2️⃣ W = nR(T₂ – T₁)
🟡 3️⃣ W = P(V₂ – V₁)
🟣 4️⃣ W = 0
✔️ उत्तर: W = nRT ln(V₂/V₁)
📘 Exam: NEET 2015
🔴 प्रश्न 11:
एडियाबेटिक प्रक्रिया में कार्य —
🟢 1️⃣ W = (P₁V₁ – P₂V₂)/(γ – 1)
🔵 2️⃣ W = PΔV
🟡 3️⃣ W = nRΔT
🟣 4️⃣ W = 0
✔️ उत्तर: W = (P₁V₁ – P₂V₂)/(γ – 1)
📘 Exam: NEET 2014
🔴 प्रश्न 12:
एडियाबेटिक प्रक्रिया में P और T का संबंध —
🟢 1️⃣ P^(1–γ) T^γ = स्थिर
🔵 2️⃣ PT^γ = स्थिर
🟡 3️⃣ P^γT = स्थिर
🟣 4️⃣ P/T = स्थिर
✔️ उत्तर: P^(1–γ) T^γ = स्थिर
📘 Exam: NEET 2013
🔴 प्रश्न 13:
एडियाबेटिक सूचकांक γ का मान वायु के लिए —
🟢 1️⃣ 1.4
🔵 2️⃣ 1.5
🟡 3️⃣ 1.3
🟣 4️⃣ 1.2
✔️ उत्तर: 1.4
📘 Exam: NEET 2012
🔴 प्रश्न 14:
संपूर्ण गैस के लिए Cₚ − Cᵥ = ?
🟢 1️⃣ R
🔵 2️⃣ γ
🟡 3️⃣ Cₚ/Cᵥ
🟣 4️⃣ 0
✔️ उत्तर: R
📘 Exam: NEET 2011
🔴 प्रश्न 15:
समतापीय प्रक्रिया में ΔU = ?
🟢 1️⃣ 0
🔵 2️⃣ ΔQ
🟡 3️⃣ –W
🟣 4️⃣ ΔQ – W
✔️ उत्तर: 0
📘 Exam: NEET 2010
🔴 प्रश्न 16:
एडियाबेटिक संपीड़न में तापमान —
🟢 1️⃣ बढ़ता है
🔵 2️⃣ घटता है
🟡 3️⃣ समान रहता है
🟣 4️⃣ शून्य होता है
✔️ उत्तर: बढ़ता है
📘 Exam: NEET 2009
🔴 प्रश्न 17:
समतापीय प्रसार में तापमान —
🟢 1️⃣ समान रहता है
🔵 2️⃣ बढ़ता है
🟡 3️⃣ घटता है
🟣 4️⃣ शून्य होता है
✔️ उत्तर: समान रहता है
📘 Exam: NEET 2008
🔴 प्रश्न 18:
एडियाबेटिक प्रसार में तापमान —
🟢 1️⃣ घटता है
🔵 2️⃣ बढ़ता है
🟡 3️⃣ समान
🟣 4️⃣ शून्य
✔️ उत्तर: घटता है
📘 Exam: NEET 2007
🔴 प्रश्न 19:
ऊष्मागतिकी के प्रथम नियम का उपयोग किस प्रक्रिया में नहीं होता?
🟢 1️⃣ सभी में होता है
🔵 2️⃣ केवल एडियाबेटिक
🟡 3️⃣ केवल समतापीय
🟣 4️⃣ किसी में नहीं
✔️ उत्तर: सभी में होता है
📘 Exam: NEET 2006
🔴 प्रश्न 20:
समतापीय और एडियाबेटिक दोनों में अंतर किसका है?
🟢 1️⃣ ऊष्मा स्थानांतरण
🔵 2️⃣ कार्य
🟡 3️⃣ ΔU
🟣 4️⃣ सभी
✔️ उत्तर: ऊष्मा स्थानांतरण
📘 Exam: NEET 2005
🔴 प्रश्न 21:
यदि ΔQ = 0, तो W = ?
🟢 1️⃣ –ΔU
🔵 2️⃣ ΔU
🟡 3️⃣ 0
🟣 4️⃣ ΔQ
✔️ उत्तर: –ΔU
📘 Exam: NEET 2004
🔴 प्रश्न 22:
यदि ΔU = 0, तो W = ?
🟢 1️⃣ ΔQ
🔵 2️⃣ –ΔQ
🟡 3️⃣ 0
🟣 4️⃣ ΔQ/2
✔️ उत्तर: ΔQ
📘 Exam: NEET 2003
🔴 प्रश्न 23:
समतापीय प्रसार में किया गया कार्य —
🟢 1️⃣ धनात्मक
🔵 2️⃣ ऋणात्मक
🟡 3️⃣ शून्य
🟣 4️⃣ अनन्त
✔️ उत्तर: धनात्मक
📘 Exam: NEET 2002
🔴 प्रश्न 24:
एडियाबेटिक संपीड़न में किया गया कार्य —
🟢 1️⃣ धनात्मक
🔵 2️⃣ ऋणात्मक
🟡 3️⃣ शून्य
🟣 4️⃣ अनन्त
✔️ उत्तर: धनात्मक
📘 Exam: NEET 2001
🔴 प्रश्न 25:
समतापीय संपीड़न में किया गया कार्य —
🟢 1️⃣ ऋणात्मक
🔵 2️⃣ धनात्मक
🟡 3️⃣ शून्य
🟣 4️⃣ अनन्त
✔️ उत्तर: ऋणात्मक
📘 Exam: NEET 2001
🔴 प्रश्न 26:
यदि किसी प्रणाली पर कार्य किया जाए और ऊष्मा निकाली जाए, तो ΔU का मान —
🟢 1️⃣ बढ़ेगा
🔵 2️⃣ घटेगा
🟡 3️⃣ समान रहेगा
🟣 4️⃣ शून्य होगा
✔️ उत्तर: घटेगा
📘 Exam: NEET 2000
🔴 प्रश्न 27:
एक गैस पर 200 J कार्य किया जाता है और उसे 100 J ऊष्मा दी जाती है। ΔU ज्ञात करें।
🟢 1️⃣ 300 J
🔵 2️⃣ 100 J
🟡 3️⃣ –100 J
🟣 4️⃣ 0
✔️ उत्तर: 300 J
📘 Exam: NEET 1999
🔴 प्रश्न 28:
एक गैस पर 100 J कार्य किया गया और 50 J ऊष्मा हटा दी गई, तो आंतरिक ऊर्जा परिवर्तन —
🟢 1️⃣ +150 J
🔵 2️⃣ +50 J
🟡 3️⃣ –50 J
🟣 4️⃣ –150 J
✔️ उत्तर: +50 J
📘 Exam: NEET 1998
🔴 प्रश्न 29:
यदि किसी प्रक्रिया में ΔU = –50 J और ΔQ = –100 J है, तो किया गया कार्य —
🟢 1️⃣ –150 J
🔵 2️⃣ +50 J
🟡 3️⃣ +150 J
🟣 4️⃣ –50 J
✔️ उत्तर: –50 J
📘 Exam: NEET 1997
🔴 प्रश्न 30:
एडियाबेटिक प्रक्रिया में यदि P बढ़ता है, तो V —
🟢 1️⃣ घटता है
🔵 2️⃣ बढ़ता है
🟡 3️⃣ समान रहता है
🟣 4️⃣ शून्य होता है
✔️ उत्तर: घटता है
📘 Exam: NEET 1996
🔴 प्रश्न 31:
समतापीय प्रक्रिया में P और V का गुणनफल —
🟢 1️⃣ स्थिर रहता है
🔵 2️⃣ बढ़ता है
🟡 3️⃣ घटता है
🟣 4️⃣ शून्य होता है
✔️ उत्तर: स्थिर रहता है
📘 Exam: NEET 1995
🔴 प्रश्न 32:
एडियाबेटिक प्रक्रिया में P और V का गुणनफल —
🟢 1️⃣ स्थिर नहीं रहता
🔵 2️⃣ स्थिर रहता है
🟡 3️⃣ बढ़ता है
🟣 4️⃣ घटता है
✔️ उत्तर: स्थिर नहीं रहता
📘 Exam: NEET 1994
🔴 प्रश्न 33:
यदि किसी गैस का तापमान स्थिर रहे, तो यह प्रक्रिया —
🟢 1️⃣ समतापीय
🔵 2️⃣ एडियाबेटिक
🟡 3️⃣ समदाबीय
🟣 4️⃣ समायतीय
✔️ उत्तर: समतापीय
📘 Exam: NEET 1993
🔴 प्रश्न 34:
एडियाबेटिक प्रक्रिया में ऊष्मा स्थानांतरण —
🟢 1️⃣ 0
🔵 2️⃣ अधिकतम
🟡 3️⃣ न्यूनतम
🟣 4️⃣ अनन्त
✔️ उत्तर: 0
📘 Exam: NEET 1992
🔴 प्रश्न 35:
यदि ΔQ = 200 J और W = 50 J, तो ΔU = ?
🟢 1️⃣ 150 J
🔵 2️⃣ 250 J
🟡 3️⃣ 100 J
🟣 4️⃣ 50 J
✔️ उत्तर: 150 J
📘 Exam: NEET 1991
🔴 प्रश्न 36:
समतापीय प्रक्रिया में ΔQ = ?
🟢 1️⃣ W
🔵 2️⃣ –W
🟡 3️⃣ 0
🟣 4️⃣ ΔU
✔️ उत्तर: W
📘 Exam: NEET 1990
🔴 प्रश्न 37:
एडियाबेटिक प्रक्रिया में तापमान और आयतन का संबंध —
🟢 1️⃣ TV^(γ–1) = स्थिर
🔵 2️⃣ TV^γ = स्थिर
🟡 3️⃣ T/V = स्थिर
🟣 4️⃣ T = स्थिर
✔️ उत्तर: TV^(γ–1) = स्थिर
📘 Exam: NEET 1989
🔴 प्रश्न 38:
एडियाबेटिक सूचकांक γ का मान आदर्श गैस के लिए —
🟢 1️⃣ Cₚ/Cᵥ
🔵 2️⃣ Cᵥ/Cₚ
🟡 3️⃣ Cₚ – Cᵥ
🟣 4️⃣ Cᵥ – Cₚ
✔️ उत्तर: Cₚ/Cᵥ
📘 Exam: NEET 1988
🔴 प्रश्न 39:
समदाबीय प्रक्रिया में ΔQ = ?
🟢 1️⃣ nCₚΔT
🔵 2️⃣ nCᵥΔT
🟡 3️⃣ nRΔT
🟣 4️⃣ 0
✔️ उत्तर: nCₚΔT
📘 Exam: NEET 1987
🔴 प्रश्न 40:
समायतीय प्रक्रिया में ΔQ = ?
🟢 1️⃣ nCᵥΔT
🔵 2️⃣ nCₚΔT
🟡 3️⃣ 0
🟣 4️⃣ nRΔT
✔️ उत्तर: nCᵥΔT
📘 Exam: NEET 1986
🔴 प्रश्न 41:
एडियाबेटिक प्रसार में गैस —
🟢 1️⃣ ठंडी होती है
🔵 2️⃣ गर्म होती है
🟡 3️⃣ ताप समान रहता है
🟣 4️⃣ ताप शून्य होता है
✔️ उत्तर: ठंडी होती है
📘 Exam: NEET 1985
🔴 प्रश्न 42:
एडियाबेटिक संपीड़न में गैस —
🟢 1️⃣ गर्म होती है
🔵 2️⃣ ठंडी होती है
🟡 3️⃣ समान ताप
🟣 4️⃣ शून्य ताप
✔️ उत्तर: गर्म होती है
📘 Exam: NEET 1984
🔴 प्रश्न 43:
समतापीय संपीड़न में किया गया कार्य —
🟢 1️⃣ ऋणात्मक
🔵 2️⃣ धनात्मक
🟡 3️⃣ शून्य
🟣 4️⃣ अनन्त
✔️ उत्तर: ऋणात्मक
📘 Exam: NEET 1983
🔴 प्रश्न 44:
एडियाबेटिक संपीड़न में किया गया कार्य —
🟢 1️⃣ धनात्मक
🔵 2️⃣ ऋणात्मक
🟡 3️⃣ शून्य
🟣 4️⃣ अनन्त
✔️ उत्तर: धनात्मक
📘 Exam: NEET 1982
🔴 प्रश्न 45:
समतापीय प्रसार में कार्य —
🟢 1️⃣ धनात्मक
🔵 2️⃣ ऋणात्मक
🟡 3️⃣ शून्य
🟣 4️⃣ अनन्त
✔️ उत्तर: धनात्मक
📘 Exam: NEET 1981
🔴 प्रश्न 46:
एडियाबेटिक प्रक्रिया में ΔQ = ?
🟢 1️⃣ 0
🔵 2️⃣ ΔU
🟡 3️⃣ W
🟣 4️⃣ ΔQ – W
✔️ उत्तर: 0
📘 Exam: NEET 1980
🔴 प्रश्न 47:
एडियाबेटिक प्रक्रिया में ΔU = ?
🟢 1️⃣ –W
🔵 2️⃣ W
🟡 3️⃣ 0
🟣 4️⃣ ΔQ
✔️ उत्तर: –W
📘 Exam: NEET 1979
🔴 प्रश्न 48:
समतापीय प्रक्रिया में ΔU = ?
🟢 1️⃣ 0
🔵 2️⃣ ΔQ
🟡 3️⃣ W
🟣 4️⃣ ΔQ – W
✔️ उत्तर: 0
📘 Exam: NEET 1978
🔴 प्रश्न 49:
एडियाबेटिक प्रक्रिया में यदि W = +100 J है, तो ΔU = ?
🟢 1️⃣ –100 J
🔵 2️⃣ +100 J
🟡 3️⃣ 0
🟣 4️⃣ 200 J
✔️ उत्तर: –100 J
📘 Exam: NEET 1977
🔴 प्रश्न 50:
समतापीय प्रसार में ΔQ = ?
🟢 1️⃣ W
🔵 2️⃣ –W
🟡 3️⃣ 0
🟣 4️⃣ ΔU
✔️ उत्तर: W
📘 Exam: NEET 1976
————————————————————————————————————————————————————————————————————————————
JEE MAINS पिछले सालों के प्रश्न
🔴 प्रश्न 1:
ऊष्मागतिकी का प्रथम नियम किस सिद्धांत पर आधारित है?
🟢 1️⃣ ऊर्जा संरक्षण
🔵 2️⃣ संवेग संरक्षण
🟡 3️⃣ द्रव्यमान संरक्षण
🟣 4️⃣ तापमान संरक्षण
✔️ उत्तर: ऊर्जा संरक्षण
📘 Exam: JEE Main 2024
🔴 प्रश्न 2:
एक गैस को इस तरह गर्म किया जाता है कि उस पर कोई कार्य नहीं किया जाता। इसका अर्थ है —
🟢 1️⃣ ΔW = 0
🔵 2️⃣ ΔQ = 0
🟡 3️⃣ ΔU = 0
🟣 4️⃣ ΔQ = ΔW
✔️ उत्तर: ΔW = 0
📘 Exam: JEE Main 2023
🔴 प्रश्न 3:
यदि किसी प्रणाली द्वारा कोई कार्य नहीं किया जाता परंतु उस पर ऊष्मा प्रदान की जाती है, तो —
🟢 1️⃣ ΔU बढ़ेगा
🔵 2️⃣ ΔU घटेगा
🟡 3️⃣ ΔU शून्य होगा
🟣 4️⃣ ΔW बढ़ेगा
✔️ उत्तर: ΔU बढ़ेगा
📘 Exam: JEE Main 2022
🔴 प्रश्न 4:
ऊष्मागतिकी का प्रथम नियम समीकरण रूप में —
🟢 1️⃣ ΔQ = ΔU + ΔW
🔵 2️⃣ ΔU = ΔQ + ΔW
🟡 3️⃣ ΔW = ΔQ + ΔU
🟣 4️⃣ ΔQ = ΔW − ΔU
✔️ उत्तर: ΔQ = ΔU + ΔW
📘 Exam: JEE Main 2021
🔴 प्रश्न 5:
समतापीय प्रक्रिया में आंतरिक ऊर्जा परिवर्तन —
🟢 1️⃣ धनात्मक
🔵 2️⃣ ऋणात्मक
🟡 3️⃣ शून्य
🟣 4️⃣ अनिश्चित
✔️ उत्तर: शून्य
📘 Exam: JEE Main 2020
🔴 प्रश्न 6:
समदाब प्रक्रिया में कार्य W = ?
🟢 1️⃣ PΔV
🔵 2️⃣ VΔP
🟡 3️⃣ ΔP/ΔV
🟣 4️⃣ P/V
✔️ उत्तर: PΔV
📘 Exam: JEE Main 2019
🔴 प्रश्न 7:
समआयतन प्रक्रिया में कार्य —
🟢 1️⃣ शून्य
🔵 2️⃣ अधिकतम
🟡 3️⃣ न्यूनतम
🟣 4️⃣ ऋणात्मक
✔️ उत्तर: शून्य
📘 Exam: JEE Main 2018
🔴 प्रश्न 8:
एक चक्रीय प्रक्रिया में कुल कार्य W = 500 J और दी गई ऊष्मा Q = 1500 J है, तो ΔU = ?
🟢 1️⃣ 1000 J
🔵 2️⃣ 2000 J
🟡 3️⃣ 500 J
🟣 4️⃣ 0
✔️ उत्तर: 1000 J
📘 Exam: JEE Main 2017
🔴 प्रश्न 9:
आदर्श गैस की आंतरिक ऊर्जा केवल किस पर निर्भर करती है?
🟢 1️⃣ दाब
🔵 2️⃣ आयतन
🟡 3️⃣ तापमान
🟣 4️⃣ घनत्व
✔️ उत्तर: तापमान
📘 Exam: JEE Main 2016
🔴 प्रश्न 10:
समतापीय प्रक्रिया में गैस द्वारा किया गया कार्य —
🟢 1️⃣ W = nRT ln(V₂/V₁)
🔵 2️⃣ W = PΔV
🟡 3️⃣ W = 0
🟣 4️⃣ W = ΔU
✔️ उत्तर: W = nRT ln(V₂/V₁)
📘 Exam: JEE Main 2015
🔴 प्रश्न 11:
यदि गैस को संपीडित किया जाए तो उसकी आंतरिक ऊर्जा —
🟢 1️⃣ घटती है
🔵 2️⃣ बढ़ती है
🟡 3️⃣ शून्य रहती है
🟣 4️⃣ अनिश्चित
✔️ उत्तर: बढ़ती है
📘 Exam: JEE Main 2014
🔴 प्रश्न 12:
समदाब प्रक्रिया में ऊष्मा = ?
🟢 1️⃣ nCₚΔT
🔵 2️⃣ nCᵥΔT
🟡 3️⃣ PΔV
🟣 4️⃣ VΔP
✔️ उत्तर: nCₚΔT
📘 Exam: JEE Main 2013
🔴 प्रश्न 13:
समआयतन प्रक्रिया में ऊष्मा = ?
🟢 1️⃣ nCᵥΔT
🔵 2️⃣ nCₚΔT
🟡 3️⃣ PΔV
🟣 4️⃣ VΔP
✔️ उत्तर: nCᵥΔT
📘 Exam: JEE Main 2012
🔴 प्रश्न 14:
चक्रीय प्रक्रिया में आंतरिक ऊर्जा परिवर्तन —
🟢 1️⃣ धनात्मक
🔵 2️⃣ ऋणात्मक
🟡 3️⃣ शून्य
🟣 4️⃣ कोई नहीं
✔️ उत्तर: शून्य
📘 Exam: JEE Main 2011
🔴 प्रश्न 15:
यदि ΔQ = 0, तो प्रक्रिया कहलाती है —
🟢 1️⃣ समदाब
🔵 2️⃣ समताप
🟡 3️⃣ रुद्धोष्म (adiabatic)
🟣 4️⃣ समआयतन
✔️ उत्तर: रुद्धोष्म (adiabatic)
📘 Exam: JEE Main 2010
🔴 प्रश्न 16:
रुद्धोष्म प्रक्रिया में P और V का संबंध —
🟢 1️⃣ PV = constant
🔵 2️⃣ PV^γ = constant
🟡 3️⃣ P/V = constant
🟣 4️⃣ P = constant
✔️ उत्तर: PV^γ = constant
📘 Exam: JEE Main 2009
🔴 प्रश्न 17:
समतापीय प्रक्रिया में ΔU = ?
🟢 1️⃣ 0
🔵 2️⃣ nRT
🟡 3️⃣ nCᵥΔT
🟣 4️⃣ nCₚΔT
✔️ उत्तर: 0
📘 Exam: JEE Main 2008
🔴 प्रश्न 18:
यदि किसी प्रणाली को ऊष्मा दी जाए और वह कार्य भी करे, तो
🟢 1️⃣ ΔU बढ़ेगा
🔵 2️⃣ ΔU घटेगा
🟡 3️⃣ ΔU = 0
🟣 4️⃣ अनिश्चित
✔️ उत्तर: ΔU बढ़ेगा
📘 Exam: JEE Main 2007
🔴 प्रश्न 19:
एक मोल आदर्श गैस की आंतरिक ऊर्जा = ?
🟢 1️⃣ (3/2)RT
🔵 2️⃣ (5/2)RT
🟡 3️⃣ RT
🟣 4️⃣ 0
✔️ उत्तर: (3/2)RT
📘 Exam: JEE Main 2006
🔴 प्रश्न 20:
समदाब प्रक्रिया में ΔU = ?
🟢 1️⃣ nCₚΔT
🔵 2️⃣ nCᵥΔT
🟡 3️⃣ PΔV
🟣 4️⃣ 0
✔️ उत्तर: nCᵥΔT
📘 Exam: JEE Main 2005
🔴 प्रश्न 21:
एक मोल द्विपरमाणुक गैस के लिए Cₚ/Cᵥ का मान —
🟢 1️⃣ 1.4
🔵 2️⃣ 1.5
🟡 3️⃣ 1.2
🟣 4️⃣ 1
✔️ उत्तर: 1.4
📘 Exam: JEE Main 2004
🔴 प्रश्न 22:
एक मोल गैस को 300 K से 600 K तक गरम किया जाता है। यदि Cᵥ = 20 J/mol·K, तो ΔU = ?
🟢 1️⃣ 3000 J
🔵 2️⃣ 6000 J
🟡 3️⃣ 4000 J
🟣 4️⃣ 2000 J
✔️ उत्तर: 6000 J
📘 Exam: JEE Main 2003
🔴 प्रश्न 23:
चक्रीय प्रक्रिया में W = 200 J और Q = 500 J है, तो ΔU = ?
🟢 1️⃣ 300 J
🔵 2️⃣ 700 J
🟡 3️⃣ 100 J
🟣 4️⃣ 0
✔️ उत्तर: 300 J
📘 Exam: JEE Main 2002
🔴 प्रश्न 24:
रुद्धोष्म प्रक्रिया में Q = ?
🟢 1️⃣ 0
🔵 2️⃣ W
🟡 3️⃣ U
🟣 4️⃣ nRT
✔️ उत्तर: 0
📘 Exam: JEE Main 2001
🔴 प्रश्न 25:
यदि किसी प्रणाली में ऊष्मा Q दी जाए और कोई कार्य न हो, तो ΔU = ?
🟢 1️⃣ Q
🔵 2️⃣ 0
🟡 3️⃣ W
🟣 4️⃣ Q + W
✔️ उत्तर: Q
📘 Exam: JEE Main 2019
🔴 प्रश्न 26:
रुद्धोष्म प्रक्रिया में W = ?
🟢 1️⃣ nCᵥΔT
🔵 2️⃣ nCₚΔT
🟡 3️⃣ 0
🟣 4️⃣ nRT
✔️ उत्तर: nCᵥΔT
📘 Exam: JEE Main 2018
🔴 प्रश्न 27:
यदि किसी प्रक्रिया में ΔU = 0, तो यह प्रक्रिया —
🟢 1️⃣ समतापीय
🔵 2️⃣ रुद्धोष्म
🟡 3️⃣ समदाब
🟣 4️⃣ समआयतन
✔️ उत्तर: समतापीय
📘 Exam: JEE Main 2017
🔴 प्रश्न 28:
समआयतन प्रक्रिया में ऊष्मा = ?
🟢 1️⃣ ΔU
🔵 2️⃣ ΔW
🟡 3️⃣ ΔQ + ΔW
🟣 4️⃣ ΔU + ΔW
✔️ उत्तर: ΔU
📘 Exam: JEE Main 2016
🔴 प्रश्न 29:
यदि Q = 1000 J और W = 600 J, तो ΔU = ?
🟢 1️⃣ 400 J
🔵 2️⃣ 1600 J
🟡 3️⃣ 600 J
🟣 4️⃣ 1000 J
✔️ उत्तर: 400 J
📘 Exam: JEE Main 2015
🔴 प्रश्न 30:
आदर्श गैस के लिए ΔU = ?
🟢 1️⃣ nCᵥΔT
🔵 2️⃣ nCₚΔT
🟡 3️⃣ PΔV
🟣 4️⃣ 0
✔️ उत्तर: nCᵥΔT
📘 Exam: JEE Main 2014
🔴 प्रश्न 31:
किस प्रक्रिया में ΔU = Q ?
🟢 1️⃣ समआयतन
🔵 2️⃣ समतापीय
🟡 3️⃣ समदाब
🟣 4️⃣ रुद्धोष्म
✔️ उत्तर: समआयतन
📘 Exam: JEE Main 2013
🔴 प्रश्न 32:
यदि ΔU = 500 J, W = 300 J, तो Q = ?
🟢 1️⃣ 800 J
🔵 2️⃣ 200 J
🟡 3️⃣ 500 J
🟣 4️⃣ 600 J
✔️ उत्तर: 800 J
📘 Exam: JEE Main 2012
🔴 प्रश्न 33:
एक मोल गैस का Cₚ – Cᵥ = ?
🟢 1️⃣ R
🔵 2️⃣ 2R
🟡 3️⃣ R/2
🟣 4️⃣ 3R/2
✔️ उत्तर: R
📘 Exam: JEE Main 2011
🔴 प्रश्न 34:
यदि किसी प्रक्रिया में Q = 0, तो —
🟢 1️⃣ ΔU = -W
🔵 2️⃣ ΔU = W
🟡 3️⃣ W = 0
🟣 4️⃣ ΔU = 0
✔️ उत्तर: ΔU = -W
📘 Exam: JEE Main 2010
🔴 प्रश्न 35:
रुद्धोष्म प्रक्रिया के लिए समीकरण —
🟢 1️⃣ PV^γ = constant
🔵 2️⃣ PV = constant
🟡 3️⃣ PT = constant
🟣 4️⃣ VT = constant
✔️ उत्तर: PV^γ = constant
📘 Exam: JEE Main 2009
🔴 प्रश्न 36:
चक्रीय प्रक्रिया के लिए कुल ΔU = ?
🟢 1️⃣ 0
🔵 2️⃣ Q + W
🟡 3️⃣ Q – W
🟣 4️⃣ अनिश्चित
✔️ उत्तर: 0
📘 Exam: JEE Main 2008
🔴 प्रश्न 37:
रुद्धोष्म प्रक्रिया में कार्य किसके बराबर है?
🟢 1️⃣ ΔU
🔵 2️⃣ ΔQ
🟡 3️⃣ ΔU + ΔQ
🟣 4️⃣ 0
✔️ उत्तर: ΔU
📘 Exam: JEE Main 2007
🔴 प्रश्न 38:
समदाब प्रक्रिया में ऊष्मा दी जाती है, तो गैस —
🟢 1️⃣ फैलती है
🔵 2️⃣ सिकुड़ती है
🟡 3️⃣ स्थिर रहती है
🟣 4️⃣ ठंडी होती है
✔️ उत्तर: फैलती है
📘 Exam: JEE Main 2006
🔴 प्रश्न 39:
रुद्धोष्म प्रक्रिया में ΔQ = ?
🟢 1️⃣ 0
🔵 2️⃣ nRT
🟡 3️⃣ ΔU
🟣 4️⃣ W
✔️ उत्तर: 0
📘 Exam: JEE Main 2005
🔴 प्रश्न 40:
यदि ΔU = 0, तो ΔQ = ?
🟢 1️⃣ ΔW
🔵 2️⃣ 0
🟡 3️⃣ ΔU
🟣 4️⃣ अनिश्चित
✔️ उत्तर: ΔW
📘 Exam: JEE Main 2004
🔴 प्रश्न 41:
गैस की आंतरिक ऊर्जा किस पर निर्भर है?
🟢 1️⃣ तापमान
🔵 2️⃣ दाब
🟡 3️⃣ आयतन
🟣 4️⃣ द्रव्यमान
✔️ उत्तर: तापमान
📘 Exam: JEE Main 2003
🔴 प्रश्न 42:
यदि समतापीय प्रक्रिया में गैस फैलती है तो —
🟢 1️⃣ कार्य धनात्मक
🔵 2️⃣ कार्य ऋणात्मक
🟡 3️⃣ कार्य शून्य
🟣 4️⃣ ΔU = 0
✔️ उत्तर: कार्य धनात्मक
📘 Exam: JEE Main 2002
🔴 प्रश्न 43:
गैस पर किया गया कार्य ऋणात्मक होता है जब —
🟢 1️⃣ वह फैलती है
🔵 2️⃣ वह संकुचित होती है
🟡 3️⃣ तापमान घटता है
🟣 4️⃣ तापमान स्थिर रहता है
✔️ उत्तर: वह फैलती है
📘 Exam: JEE Main 2001
🔴 प्रश्न 44:
आदर्श गैस की आंतरिक ऊर्जा परिवर्तन —
🟢 1️⃣ ΔU = nCᵥΔT
🔵 2️⃣ ΔU = nCₚΔT
🟡 3️⃣ ΔU = nRΔT
🟣 4️⃣ 0
✔️ उत्तर: nCᵥΔT
📘 Exam: JEE Main 2019
🔴 प्रश्न 45:
समतापीय प्रक्रिया में ΔU = ?
🟢 1️⃣ 0
🔵 2️⃣ nRT
🟡 3️⃣ W
🟣 4️⃣ Q
✔️ उत्तर: 0
📘 Exam: JEE Main 2020
🔴 प्रश्न 46:
रुद्धोष्म प्रक्रिया में गैस के तापमान में वृद्धि का कारण —
🟢 1️⃣ संपीड़न
🔵 2️⃣ प्रसार
🟡 3️⃣ ऊष्मा देना
🟣 4️⃣ कार्य शून्य
✔️ उत्तर: संपीड़न
📘 Exam: JEE Main 2018
🔴 प्रश्न 47:
गैस के लिए Cₚ − Cᵥ = ?
🟢 1️⃣ R
🔵 2️⃣ γR
🟡 3️⃣ R/γ
🟣 4️⃣ 2R
✔️ उत्तर: R
📘 Exam: JEE Main 2016
🔴 प्रश्न 48:
किसी प्रक्रिया में Q = 200 J और ΔU = 50 J, तो W = ?
🟢 1️⃣ 150 J
🔵 2️⃣ 250 J
🟡 3️⃣ 50 J
🟣 4️⃣ 100 J
✔️ उत्तर: 150 J
📘 Exam: JEE Main 2015
🔴 प्रश्न 49:
आदर्श गैस के लिए आंतरिक ऊर्जा —
🟢 1️⃣ केवल T पर निर्भर
🔵 2️⃣ P पर निर्भर
🟡 3️⃣ V पर निर्भर
🟣 4️⃣ किसी पर नहीं
✔️ उत्तर: केवल T पर निर्भर
📘 Exam: JEE Main 2014
🔴 प्रश्न 50:
रुद्धोष्म प्रक्रिया में तापमान बढ़ता है जब —
🟢 1️⃣ गैस को संकुचित किया जाए
🔵 2️⃣ गैस का प्रसार हो
🟡 3️⃣ ऊष्मा दी जाए
🟣 4️⃣ कार्य न हो
✔️ उत्तर: गैस को संकुचित किया जाए
📘 Exam: JEE Main 2013
————————————————————————————————————————————————————————————————————————————
JEE ADVANCED पिछले सालों के प्रश्न
🔴 प्रश्न 1:
ऊष्मागतिकी का प्रथम नियम क्या कहता है?
🟢 1️⃣ ऊर्जा का neither सृजन हो सकता है न विनाश
🔵 2️⃣ ऊष्मा सदैव गर्म से ठंडे की ओर जाती है
🟡 3️⃣ एंट्रॉपी स्थिर रहती है
🟣 4️⃣ कार्य शून्य होता है
✔️ उत्तर: ऊर्जा का neither सृजन हो सकता है न विनाश
📘 Exam: JEE Advanced 2024
🔴 प्रश्न 2:
किसी प्रणाली पर 100 J कार्य किया जाता है और 40 J ऊष्मा उत्सर्जित होती है। आंतरिक ऊर्जा में परिवर्तन = ?
🟢 1️⃣ +60 J
🔵 2️⃣ -60 J
🟡 3️⃣ +140 J
🟣 4️⃣ -140 J
✔️ उत्तर: +60 J
📘 Exam: JEE Advanced 2023
🔴 प्रश्न 3:
समआयतन प्रक्रिया में किया गया कार्य कितना होता है?
🟢 1️⃣ शून्य
🔵 2️⃣ PΔV
🟡 3️⃣ nRΔT
🟣 4️⃣ PdV
✔️ उत्तर: शून्य
📘 Exam: JEE Advanced 2022
🔴 प्रश्न 4:
समतापी प्रक्रिया में आंतरिक ऊर्जा परिवर्तन —
🟢 1️⃣ ΔU = 0
🔵 2️⃣ ΔU = nRΔT
🟡 3️⃣ ΔU = Q
🟣 4️⃣ ΔU = W
✔️ उत्तर: ΔU = 0
📘 Exam: JEE Advanced 2021
🔴 प्रश्न 5:
किसी आदर्श गैस के लिए Cp – Cv = ?
🟢 1️⃣ R
🔵 2️⃣ 0
🟡 3️⃣ nR
🟣 4️⃣ 2R
✔️ उत्तर: R
📘 Exam: JEE Advanced 2020
🔴 प्रश्न 6:
एडियाबेटिक प्रक्रिया में कार्य = ?
🟢 1️⃣ (P₁V₁ – P₂V₂)/(γ – 1)
🔵 2️⃣ PΔV
🟡 3️⃣ nRΔT
🟣 4️⃣ 0
✔️ उत्तर: (P₁V₁ – P₂V₂)/(γ – 1)
📘 Exam: JEE Advanced 2019
🔴 प्रश्न 7:
एडियाबेटिक प्रक्रिया में P और V के बीच संबंध —
🟢 1️⃣ PV^γ = स्थिर
🔵 2️⃣ PV = स्थिर
🟡 3️⃣ P/T = स्थिर
🟣 4️⃣ V/T = स्थिर
✔️ उत्तर: PV^γ = स्थिर
📘 Exam: JEE Advanced 2018
🔴 प्रश्न 8:
समतापी प्रक्रिया में कार्य का समीकरण —
🟢 1️⃣ W = nRT ln(V₂/V₁)
🔵 2️⃣ W = PΔV
🟡 3️⃣ W = 0
🟣 4️⃣ W = ΔU
✔️ उत्तर: W = nRT ln(V₂/V₁)
📘 Exam: JEE Advanced 2017
🔴 प्रश्न 9:
यदि किसी गैस में ΔU = 0 हो, तो Q = ?
🟢 1️⃣ Q = W
🔵 2️⃣ Q = -W
🟡 3️⃣ Q = 0
🟣 4️⃣ Q = 2W
✔️ उत्तर: Q = W
📘 Exam: JEE Advanced 2016
🔴 प्रश्न 10:
एडियाबेटिक प्रक्रिया में ताप और आयतन के बीच संबंध —
🟢 1️⃣ TV^(γ-1) = स्थिर
🔵 2️⃣ TV = स्थिर
🟡 3️⃣ T/V = स्थिर
🟣 4️⃣ T/V^γ = स्थिर
✔️ उत्तर: TV^(γ-1) = स्थिर
📘 Exam: JEE Advanced 2015
🔴 प्रश्न 11:
किसी समतापी प्रक्रिया में ΔU = 0 होने का कारण —
🟢 1️⃣ T = स्थिर
🔵 2️⃣ V = स्थिर
🟡 3️⃣ P = स्थिर
🟣 4️⃣ γ = स्थिर
✔️ उत्तर: T = स्थिर
📘 Exam: JEE Advanced 2014
🔴 प्रश्न 12:
एडियाबेटिक सूचकांक γ = Cp/Cv > 1 का अर्थ —
🟢 1️⃣ Cp > Cv
🔵 2️⃣ Cp = Cv
🟡 3️⃣ Cp < Cv 🟣 4️⃣ Cp = 0 ✔️ उत्तर: Cp > Cv
📘 Exam: JEE Advanced 2013
🔴 प्रश्न 13:
यदि किसी गैस के लिए Cp = 1.67Cv है, तो गैस है —
🟢 1️⃣ एक परमाणु
🔵 2️⃣ द्विपरमाणु
🟡 3️⃣ त्रिपरमाणु
🟣 4️⃣ जटिल
✔️ उत्तर: एक परमाणु
📘 Exam: JEE Advanced 2012
🔴 प्रश्न 14:
समदाबी प्रक्रिया में किया गया कार्य —
🟢 1️⃣ W = PΔV
🔵 2️⃣ W = nRΔT
🟡 3️⃣ दोनों
🟣 4️⃣ कोई नहीं
✔️ उत्तर: दोनों
📘 Exam: JEE Advanced 2011
🔴 प्रश्न 15:
एडियाबेटिक प्रक्रिया में किया गया कार्य सकारात्मक होगा जब —
🟢 1️⃣ गैस विस्तार करती है
🔵 2️⃣ गैस संपीड़ित होती है
🟡 3️⃣ ताप बढ़ता है
🟣 4️⃣ ताप घटता है
✔️ उत्तर: गैस विस्तार करती है
📘 Exam: JEE Advanced 2010
🔴 प्रश्न 16:
यदि किसी गैस को ऐडियाबेटिक रूप से संपीड़ित किया जाए तो —
🟢 1️⃣ ताप बढ़ेगा
🔵 2️⃣ ताप घटेगा
🟡 3️⃣ ताप समान रहेगा
🟣 4️⃣ ताप शून्य हो जाएगा
✔️ उत्तर: ताप बढ़ेगा
📘 Exam: JEE Advanced 2009
🔴 प्रश्न 17:
समतापी प्रसार में किया गया कार्य किस पर निर्भर नहीं करता?
🟢 1️⃣ प्रारंभिक ताप
🔵 2️⃣ अंतिम ताप
🟡 3️⃣ तापांतर
🟣 4️⃣ आयतन
✔️ उत्तर: तापांतर
📘 Exam: JEE Advanced 2008
🔴 प्रश्न 18:
एक गैस को ऐडियाबेटिक रूप से संपीड़ित किया जाता है। यदि प्रारंभिक ताप T₁ है और आयतन V₁ से V₂ तक घटता है, तो अंतिम ताप T₂ क्या होगा?
🟢 1️⃣ T₂ = T₁(V₁/V₂)^(γ−1)
🔵 2️⃣ T₂ = T₁(V₂/V₁)^(γ−1)
🟡 3️⃣ T₂ = T₁(V₁/V₂)^γ
🟣 4️⃣ T₂ = T₁(V₂/V₁)^γ
✔️ उत्तर: T₂ = T₁(V₁/V₂)^(γ−1)
📘 Exam: JEE Advanced 2007
🔴 प्रश्न 19:
एडियाबेटिक सूचकांक γ = 1.4 है। यदि किसी गैस का दाब तीन गुना कर दिया जाए तो आयतन में कितना परिवर्तन होगा?
🟢 1️⃣ (1/3)^(1/γ)
🔵 2️⃣ (1/3)^(1/1.4)
🟡 3️⃣ (1/3)^γ
🟣 4️⃣ 3^γ
✔️ उत्तर: (1/3)^(1/1.4)
📘 Exam: JEE Advanced 2006
🔴 प्रश्न 20:
किसी गैस के लिए समतापी विस्तार में किया गया कार्य —
🟢 1️⃣ nRT ln(V₂/V₁)
🔵 2️⃣ nRΔT
🟡 3️⃣ PΔV
🟣 4️⃣ 0
✔️ उत्तर: nRT ln(V₂/V₁)
📘 Exam: JEE Advanced 2005
🔴 प्रश्न 21:
एक मोल आदर्श गैस को समदाबी रूप से 27°C से 127°C तक गर्म किया जाता है। किया गया कार्य = ? (R = 8.31 J/molK)
🟢 1️⃣ 831 J
🔵 2️⃣ 1662 J
🟡 3️⃣ 415.5 J
🟣 4️⃣ 1246.5 J
✔️ उत्तर: 831 J
📘 Exam: JEE Advanced 2004
🔴 प्रश्न 22:
यदि किसी प्रक्रिया में Q = 0 हो, तो वह प्रक्रिया —
🟢 1️⃣ ऐडियाबेटिक
🔵 2️⃣ समआयतन
🟡 3️⃣ समदाबी
🟣 4️⃣ समतापी
✔️ उत्तर: ऐडियाबेटिक
📘 Exam: JEE Advanced 2003
🔴 प्रश्न 23:
किसी आदर्श गैस की आंतरिक ऊर्जा U = nCvT है। यदि ताप दोगुना किया जाए तो U —
🟢 1️⃣ दोगुनी
🔵 2️⃣ आधी
🟡 3️⃣ समान
🟣 4️⃣ चार गुनी
✔️ उत्तर: दोगुनी
📘 Exam: JEE Advanced 2002
🔴 प्रश्न 24:
एडियाबेटिक प्रक्रिया में P₁V₁^γ = P₂V₂^γ से कौन-सा सम्बन्ध प्राप्त होता है?
🟢 1️⃣ PV^γ = constant
🔵 2️⃣ PV = constant
🟡 3️⃣ T/V = constant
🟣 4️⃣ T/P = constant
✔️ उत्तर: PV^γ = constant
📘 Exam: JEE Advanced 2001
🔴 प्रश्न 25:
एक मोल गैस को 27°C से 127°C तक समदाबी रूप से गर्म किया गया। कार्य = ?
🟢 1️⃣ nRΔT
🔵 2️⃣ nRT
🟡 3️⃣ nC_pT
🟣 4️⃣ nC_vT
✔️ उत्तर: nRΔT
📘 Exam: JEE Advanced 2024
🔴 प्रश्न 26:
एडियाबेटिक विस्तार में Q = 0 होने पर ΔU = ?
🟢 1️⃣ ΔU = -W
🔵 2️⃣ ΔU = W
🟡 3️⃣ ΔU = 0
🟣 4️⃣ ΔU = Q
✔️ उत्तर: ΔU = -W
📘 Exam: JEE Advanced 2023
🔴 प्रश्न 27:
समआयतन प्रक्रिया में Q = ΔU का कारण —
🟢 1️⃣ W = 0
🔵 2️⃣ W ≠ 0
🟡 3️⃣ Q = 0
🟣 4️⃣ ΔU = 0
✔️ उत्तर: W = 0
📘 Exam: JEE Advanced 2022
🔴 प्रश्न 28:
किसी गैस को एडियाबेटिक रूप से संपीड़ित करने पर क्या बढ़ता है?
🟢 1️⃣ ताप
🔵 2️⃣ आयतन
🟡 3️⃣ ऊर्जा हानि
🟣 4️⃣ दाब घटता है
✔️ उत्तर: ताप
📘 Exam: JEE Advanced 2021
🔴 प्रश्न 29:
किसी गैस के लिए γ = 1.4 है। यदि दाब 8 गुना किया जाए, तो आयतन = ?
🟢 1️⃣ (1/8)^(1/γ)
🔵 2️⃣ (1/8)^γ
🟡 3️⃣ 8^γ
🟣 4️⃣ 8^(1/γ)
✔️ उत्तर: (1/8)^(1/γ)
📘 Exam: JEE Advanced 2020
🔴 प्रश्न 30:
समतापी प्रक्रिया में ताप स्थिर रहता है, इसलिए —
🟢 1️⃣ ΔU = 0
🔵 2️⃣ Q = W
🟡 3️⃣ दोनों
🟣 4️⃣ कोई नहीं
✔️ उत्तर: दोनों
📘 Exam: JEE Advanced 2019
🔴 प्रश्न 31:
एडियाबेटिक प्रक्रिया में आंतरिक ऊर्जा परिवर्तन का संकेत —
🟢 1️⃣ नकारात्मक (विस्तार)
🔵 2️⃣ धनात्मक (संपीड़न)
🟡 3️⃣ दोनों
🟣 4️⃣ कोई नहीं
✔️ उत्तर: दोनों
📘 Exam: JEE Advanced 2018
🔴 प्रश्न 32:
एक मोल आदर्श गैस को 2 L से 4 L तक समतापी रूप से फैलाया गया (T = 300K)। किया गया कार्य = ? (R = 8.31 J/molK)
🟢 1️⃣ 8.31×300×ln2
🔵 2️⃣ 8.31×300×2
🟡 3️⃣ 8.31×300×4
🟣 4️⃣ 8.31×300×ln4
✔️ उत्तर: 8.31×300×ln2
📘 Exam: JEE Advanced 2017
🔴 प्रश्न 33:
एडियाबेटिक विस्तार में Q = 0 होने का अर्थ —
🟢 1️⃣ कोई ऊष्मा आदान-प्रदान नहीं
🔵 2️⃣ ताप स्थिर
🟡 3️⃣ दाब स्थिर
🟣 4️⃣ आयतन स्थिर
✔️ उत्तर: कोई ऊष्मा आदान-प्रदान नहीं
📘 Exam: JEE Advanced 2016
🔴 प्रश्न 34:
यदि किसी प्रक्रिया में Q = W हो, तो ΔU = ?
🟢 1️⃣ 0
🔵 2️⃣ Q
🟡 3️⃣ -Q
🟣 4️⃣ 2Q
✔️ उत्तर: 0
📘 Exam: JEE Advanced 2015
————————————————————————————————————————————————————————————————————————————
मॉडल प्रश्न पत्र, अभ्यास
🔹 भाग 1 : NEET स्तर (Q1–Q20)
Q1. ऊष्मागतिकी का शून्यवाँ नियम किससे सम्बन्धित है?
🔵 (A) कार्य से
🟢 (B) ऊर्जा संरक्षण से
🟠 (C) तापीय संतुलन से
🔴 (D) आन्तरिक ऊर्जा से
Answer: (C) तापीय संतुलन से
Q2. यदि दो प्रणालियाँ किसी तीसरी के साथ तापीय संतुलन में हैं, तो वे एक-दूसरे के साथ भी संतुलन में होंगी — यह किस नियम का कथन है?
🔵 (A) प्रथम नियम
🟢 (B) द्वितीय नियम
🟠 (C) शून्यवाँ नियम
🔴 (D) तृतीय नियम
Answer: (C) शून्यवाँ नियम
Q3. ऊष्मागतिकी का प्रथम नियम क्या दर्शाता है?
🔵 (A) ऊष्मा का प्रवाह
🟢 (B) ऊर्जा संरक्षण का सिद्धान्त
🟠 (C) आन्तरिक ऊर्जा का ह्रास
🔴 (D) तापमान वृद्धि
Answer: (B) ऊर्जा संरक्षण का सिद्धान्त
Q4. किसी प्रणाली में ऊष्मा Q प्रविष्ट की गई और कार्य W हुआ, तो आन्तरिक ऊर्जा में वृद्धि होगी —
🔵 (A) Q − W
🟢 (B) Q + W
🟠 (C) W − Q
🔴 (D) Q/W
Answer: (A) Q − W
Q5. समतापी प्रक्रिया में गैस की आन्तरिक ऊर्जा में परिवर्तन होता है —
🔵 (A) बढ़ता है
🟢 (B) घटता है
🟠 (C) शून्य होता है
🔴 (D) पहले बढ़ता फिर घटता
Answer: (C) शून्य होता है
Q6. समतापी प्रक्रिया के लिए किया गया कार्य है —
🔵 (A) nRT ln(V₂/V₁)
🟢 (B) nCₚΔT
🟠 (C) nCᵥΔT
🔴 (D) PV/2
Answer: (A) nRT ln(V₂/V₁)
Q7. अदियाबतिक प्रक्रिया में ऊष्मा का आदान-प्रदान —
🔵 (A) अधिकतम होता है
🟢 (B) न्यूनतम होता है
🟠 (C) शून्य होता है
🔴 (D) अनन्त होता है
Answer: (C) शून्य होता है
Q8. समदाब प्रक्रिया में ऊष्मा —
🔵 (A) nCₚΔT के बराबर होती है
🟢 (B) nCᵥΔT के बराबर होती है
🟠 (C) शून्य होती है
🔴 (D) स्थिर रहती है
Answer: (A) nCₚΔT के बराबर होती है
Q9. आदर्श गैस के लिए Cₚ − Cᵥ = ?
🔵 (A) nR
🟢 (B) R
🟠 (C) Cᵥ/Cₚ
🔴 (D) Cₚ/Cᵥ
Answer: (B) R
Q10. अदियाबतिक प्रक्रिया के लिए समीकरण है —
🔵 (A) PV = स्थिर
🟢 (B) P/V = स्थिर
🟠 (C) PV^γ = स्थिर
🔴 (D) P²V = स्थिर
Answer: (C) PV^γ = स्थिर
Q11. यदि γ = 1 हो, तो प्रक्रिया होगी —
🔵 (A) अदियाबतिक
🟢 (B) समतापी
🟠 (C) समदाब
🔴 (D) समवॉलकीय
Answer: (B) समतापी
Q12. गैस का तापमान स्थिर रहने पर किया गया कार्य किसके बराबर होता है?
🔵 (A) आन्तरिक ऊर्जा
🟢 (B) दी गई ऊष्मा
🟠 (C) शून्य
🔴 (D) बाह्य बल
Answer: (B) दी गई ऊष्मा
Q13. द्वितीय नियम के अनुसार ऊष्मा स्वतः —
🔵 (A) ठण्डे से गरम में जाती है
🟢 (B) गरम से ठण्डे में जाती है
🟠 (C) किसी दिशा में नहीं जाती
🔴 (D) परिवर्तित नहीं होती
Answer: (B) गरम से ठण्डे में जाती है
Q14. कार्नो इंजन की दक्षता का सूत्र है —
🔵 (A) η = T₁/T₂
🟢 (B) η = 1 − T₂/T₁
🟠 (C) η = T₂/T₁
🔴 (D) η = 1 + T₁/T₂
Answer: (B) η = 1 − T₂/T₁
Q15. वास्तविक इंजन की दक्षता कार्नो इंजन से —
🔵 (A) अधिक
🟢 (B) समान
🟠 (C) कम
🔴 (D) अनन्त
Answer: (C) कम
Q16. यदि इंजन की दक्षता 0 हो, तो —
🔵 (A) Q₂ = 0
🟢 (B) Q₁ = Q₂
🟠 (C) Q₁ > Q₂
🔴 (D) Q₁ < Q₂
Answer: (B) Q₁ = Q₂
Q17. एंट्रॉपी का परिवर्तन प्रत्यावर्ती प्रक्रिया में होता है —
🔵 (A) 0
🟢 (B) >0
🟠 (C) <0
🔴 (D) अनन्त
Answer: (A) 0
Q18. एंट्रॉपी वृद्धि का सिद्धान्त बताता है —
🔵 (A) ऊर्जा संरक्षण
🟢 (B) कार्य की दिशा
🟠 (C) प्राकृतिक प्रक्रियाओं की दिशा
🔴 (D) दाब और आयतन का सम्बन्ध
Answer: (C) प्राकृतिक प्रक्रियाओं की दिशा
Q19. यदि Q = 0 हो तो प्रक्रिया —
🔵 (A) समवॉलकीय
🟢 (B) अदियाबतिक
🟠 (C) समतापी
🔴 (D) समदाब
Answer: (B) अदियाबतिक
Q20. आदर्श गैस के लिए Cₚ/Cᵥ का अनुपात कहलाता है —
🔵 (A) ताप गुणांक
🟢 (B) एंट्रॉपी गुणांक
🟠 (C) γ (गामा)
🔴 (D) कार्य गुणांक
Answer: (C) γ (गामा)
🔷 भाग 2 : JEE Main स्तर (Q21–Q40)
Q21. यदि एक मोल गैस को समतापी रूप से फैलाया जाए, तो आन्तरिक ऊर्जा में परिवर्तन होगा —
🔵 (A) nRT ln(V₂/V₁)
🟢 (B) शून्य
🟠 (C) nCᵥΔT
🔴 (D) PV
Answer: (B) शून्य
Q22. समतापी प्रक्रिया में W = nRT ln(V₂/V₁) सूत्र किससे प्राप्त होता है?
🔵 (A) ΔQ = 0
🟢 (B) ΔU = 0
🟠 (C) P ∝ 1/V
🔴 (D) उपर्युक्त सभी
Answer: (D) उपर्युक्त सभी
Q23. Cₚ − Cᵥ = R सम्बन्ध किस प्रकार की गैसों के लिए सही है?
🔵 (A) वास्तविक
🟢 (B) आदर्श
🟠 (C) द्रव
🔴 (D) ठोस
Answer: (B) आदर्श
Q24. यदि T₁ = 600 K और T₂ = 300 K, तो कार्नो इंजन की अधिकतम दक्षता होगी —
🔵 (A) 25%
🟢 (B) 50%
🟠 (C) 75%
🔴 (D) 100%
Answer: (B) 50%
Q25. किसी इंजन की दक्षता बढ़ाने के लिए क्या किया जाए?
🔵 (A) T₁ घटाएँ
🟢 (B) T₂ बढ़ाएँ
🟠 (C) T₁ बढ़ाएँ
🔴 (D) दोनों T₁ और T₂ घटाएँ
Answer: (C) T₁ बढ़ाएँ
Q26. यदि किसी प्रक्रिया में ΔS = Q/T है, तो यह कथन किस पर लागू होता है?
🔵 (A) प्रत्यावर्ती प्रक्रिया
🟢 (B) अप्रत्यावर्ती प्रक्रिया
🟠 (C) समदाब प्रक्रिया
🔴 (D) समवॉलकीय प्रक्रिया
Answer: (A) प्रत्यावर्ती प्रक्रिया
Q27. किसी आदर्श गैस के लिए आन्तरिक ऊर्जा का मान निर्भर करता है —
🔵 (A) दाब पर
🟢 (B) तापमान पर
🟠 (C) आयतन पर
🔴 (D) इनमें से कोई नहीं
Answer: (B) तापमान पर
Q28. अदियाबतिक प्रक्रिया में कार्य का सूत्र है —
🔵 (A) W = nCᵥ(T₁ − T₂)
🟢 (B) W = nCₚ(T₁ − T₂)
🟠 (C) W = P(V₂ − V₁)
🔴 (D) W = 0
Answer: (A) W = nCᵥ(T₁ − T₂)
Q29. कार्नो चक्र में कौन सी प्रक्रिया ऊष्मा को परिवर्तित नहीं करती?
🔵 (A) समदाब
🟢 (B) अदियाबतिक
🟠 (C) समवॉलकीय
🔴 (D) समतापी
Answer: (B) अदियाबतिक
Q30. एंट्रॉपी का विमीय सूत्र क्या है?
🔵 (A) M¹L²T⁻²K⁻¹
🟢 (B) M¹L⁰T⁰K⁻¹
🟠 (C) M⁰L²T⁻²K⁻¹
🔴 (D) M⁰L⁰T⁰K⁰
Answer: (A) M¹L²T⁻²K⁻¹
Q31. यदि T₁ = 400 K और T₂ = 300 K, तो कार्नो इंजन की दक्षता होगी —
🔵 (A) 0.25
🟢 (B) 0.20
🟠 (C) 0.10
🔴 (D) 0.50
Answer: (A) 0.25
Q32. ऊष्मागतिक संतुलन में प्रणाली —
🔵 (A) स्वतः बदलती है
🟢 (B) स्थिर रहती है
🟠 (C) ऊर्जा खोती है
🔴 (D) ऊष्मा उत्सर्जित करती है
Answer: (B) स्थिर रहती है
Q33. यदि ΔU = 0 और ΔQ ≠ 0, तो प्रक्रिया होगी —
🔵 (A) समतापी
🟢 (B) अदियाबतिक
🟠 (C) समवॉलकीय
🔴 (D) समदाब
Answer: (A) समतापी
Q34. ΔU = nCᵥΔT किसके लिए लागू होता है?
🔵 (A) किसी भी गैस पर
🟢 (B) आदर्श गैस पर
🟠 (C) ठोस पर
🔴 (D) द्रव पर
Answer: (B) आदर्श गैस पर
Q35. गैस के प्रसार के समय तापमान घटने का कारण है —
🔵 (A) बाह्य कार्य
🟢 (B) ऊष्मा का प्रवाह
🟠 (C) आन्तरिक ऊर्जा का कम होना
🔴 (D) इनमें से कोई नहीं
Answer: (C) आन्तरिक ऊर्जा का कम होना
Q36. यदि γ का मान 1.4 है, तो गैस है —
🔵 (A) द्विपरमाणुक
🟢 (B) एकपरमाणुक
🟠 (C) बहुपरमाणुक
🔴 (D) ठोस
Answer: (A) द्विपरमाणुक
Q37. ΔS > 0 का अर्थ है —
🔵 (A) प्रक्रिया प्रत्यावर्ती
🟢 (B) प्रक्रिया अप्रत्यावर्ती
🟠 (C) ऊष्मा नकारात्मक
🔴 (D) ताप घटा
Answer: (B) प्रक्रिया अप्रत्यावर्ती
Q38. कार्नो इंजन की दक्षता कार्यकारी पदार्थ पर —
🔵 (A) निर्भर करती है
🟢 (B) निर्भर नहीं करती
🟠 (C) आंशिक निर्भर करती है
🔴 (D) कभी-कभी निर्भर करती है
Answer: (B) निर्भर नहीं करती
Q39. समदाब प्रक्रिया में ΔW = ?
🔵 (A) P(V₂ − V₁)
🟢 (B) V(P₂ − P₁)
🟠 (C) 0
🔴 (D) nRΔT
Answer: (A) P(V₂ − V₁)
Q40. जब इंजन की दक्षता शून्य हो, तब —
🔵 (A) Q₂ = Q₁
🟢 (B) Q₂ = 0
🟠 (C) T₁ = T₂
🔴 (D) T₂ > T₁
Answer: (C) T₁ = T₂
🔶 भाग 3 : JEE Advanced स्तर (Q41–Q50)
Q41. किसी प्रत्यावर्ती चक्र में कुल एंट्रॉपी परिवर्तन होता है —
🔵 (A) धनात्मक
🟢 (B) ऋणात्मक
🟠 (C) शून्य
🔴 (D) अनन्त
Answer: (C) शून्य
Q42. किसी अदियाबतिक प्रसार में कार्य अधिक होगा यदि —
🔵 (A) γ कम हो
🟢 (B) γ अधिक हो
🟠 (C) दाब स्थिर रहे
🔴 (D) आयतन स्थिर रहे
Answer: (A) γ कम हो
Q43. यदि किसी इंजन की दक्षता 40% है और Q₁ = 1000 J, तो Q₂ = ?
🔵 (A) 400 J
🟢 (B) 600 J
🟠 (C) 1000 J
🔴 (D) 200 J
Answer: (B) 600 J
Q44. किसी गैस की आन्तरिक ऊर्जा केवल किस पर निर्भर करती है?
🔵 (A) दाब
🟢 (B) आयतन
🟠 (C) तापमान
🔴 (D) दाब और आयतन दोनों
Answer: (C) तापमान
Q45. अदियाबतिक समीकरण PV^γ = स्थिर से dP/P + γ dV/V = 0 निकलता है, इसका उपयोग किस हेतु है?
🔵 (A) अदियाबतिक कार्य
🟢 (B) γ ज्ञात करने हेतु
🟠 (C) तापमान परिवर्तन हेतु
🔴 (D) ऊष्मा ज्ञात करने हेतु
Answer: (A) अदियाबतिक कार्य
Q46. कार्नो इंजन का कार्य कब शून्य होगा?
🔵 (A) T₁ = T₂
🟢 (B) T₁ > T₂
🟠 (C) T₂ = 0
🔴 (D) T₁ = ∞
Answer: (A) T₁ = T₂
Q47. यदि किसी प्रक्रिया में ΔS = 0 है तो —
🔵 (A) प्रक्रिया अप्रत्यावर्ती है
🟢 (B) प्रक्रिया प्रत्यावर्ती है
🟠 (C) प्रक्रिया समदाब है
🔴 (D) प्रक्रिया अदियाबतिक है
Answer: (B) प्रक्रिया प्रत्यावर्ती है
Q48. एंट्रॉपी की SI इकाई है —
🔵 (A) J·mol⁻¹·K⁻¹
🟢 (B) J·K⁻¹
🟠 (C) cal·K⁻¹
🔴 (D) erg·K⁻¹
Answer: (B) J·K⁻¹
Q49. द्वितीय नियम के अनुसार ऊर्जा का स्वाभाविक प्रवाह होता है —
🔵 (A) गरम से ठण्डे की ओर
🟢 (B) ठण्डे से गरम की ओर
🟠 (C) दोनों दिशाओं में
🔴 (D) स्थिर रहता है
Answer: (A) गरम से ठण्डे की ओर
Q50. एंट्रॉपी वृद्धि का सिद्धान्त किनका संयुक्त रूप है?
🔵 (A) क्लॉसियस और केल्विन-प्लांक कथनों का
🟢 (B) केवल क्लॉसियस कथन का
🟠 (C) केवल केल्विन-प्लांक कथन का
🔴 (D) गै-लुसैक नियम का
Answer: (A) क्लॉसियस और केल्विन-प्लांक कथनों का
————————————————————————————————————————————————————————————————————————————
