Class 10 : Science (In Hindi) – Lesson 2. अम्ल, क्षारक एवं लवण
पाठ का विश्लेषण एवं विवेचन
🔵 व्याख्या (Explanation)
🧠 परिचय (Introduction)
हमारे आस-पास के अनेक पदार्थ जैसे – नींबू, सिरका, दूध, साबुन, बेकिंग सोडा, नमक आदि रासायनिक रूप से अम्ल, क्षारक या लवण होते हैं। इनका स्वाद, स्पर्श, तथा रासायनिक गुण भिन्न होते हैं। अम्ल खट्टे, क्षारक फिसलनयुक्त और लवण सामान्यतः तटस्थ होते हैं। इस अध्याय में हम अम्ल, क्षारक एवं लवण के गुण, उनकी अभिक्रियाएँ तथा दैनिक जीवन में उनके उपयोगों का अध्ययन करेंगे।
🟢 1️⃣ अम्ल (Acids)
💡 परिभाषा:
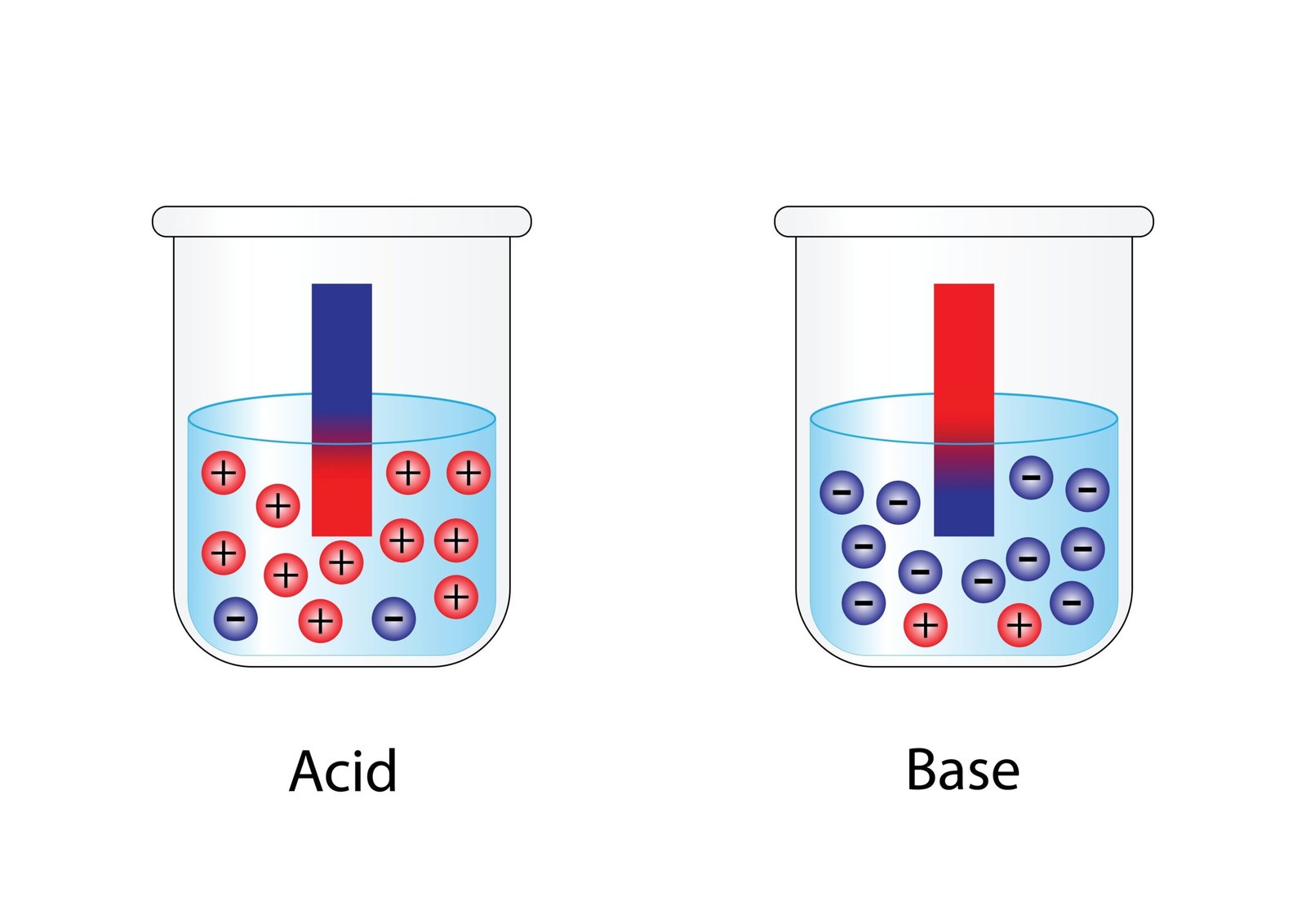
वे पदार्थ जो जल में घुलकर हाइड्रोजन आयन (H⁺) उत्पन्न करते हैं, अम्ल कहलाते हैं।
🔵 उदाहरण:
➡️ HCl (हाइड्रोक्लोरिक अम्ल), H₂SO₄ (सल्फ्यूरिक अम्ल), HNO₃ (नाइट्रिक अम्ल), CH₃COOH (एसिटिक अम्ल)।
✏️ अम्लों के प्रकार:
🟢 (i) खनिज अम्ल – जैसे HCl, H₂SO₄, HNO₃
🟡 (ii) कार्बनिक अम्ल – जैसे साइट्रिक अम्ल, टार्टरिक अम्ल, एसिटिक अम्ल
🔴 अम्लों के गुण:
खट्टे स्वाद वाले होते हैं
नीले लिटमस को लाल करते हैं
धातुओं से क्रिया कर हाइड्रोजन गैस बनाते हैं
💡 उदाहरण: Zn + 2HCl → ZnCl₂ + H₂↑
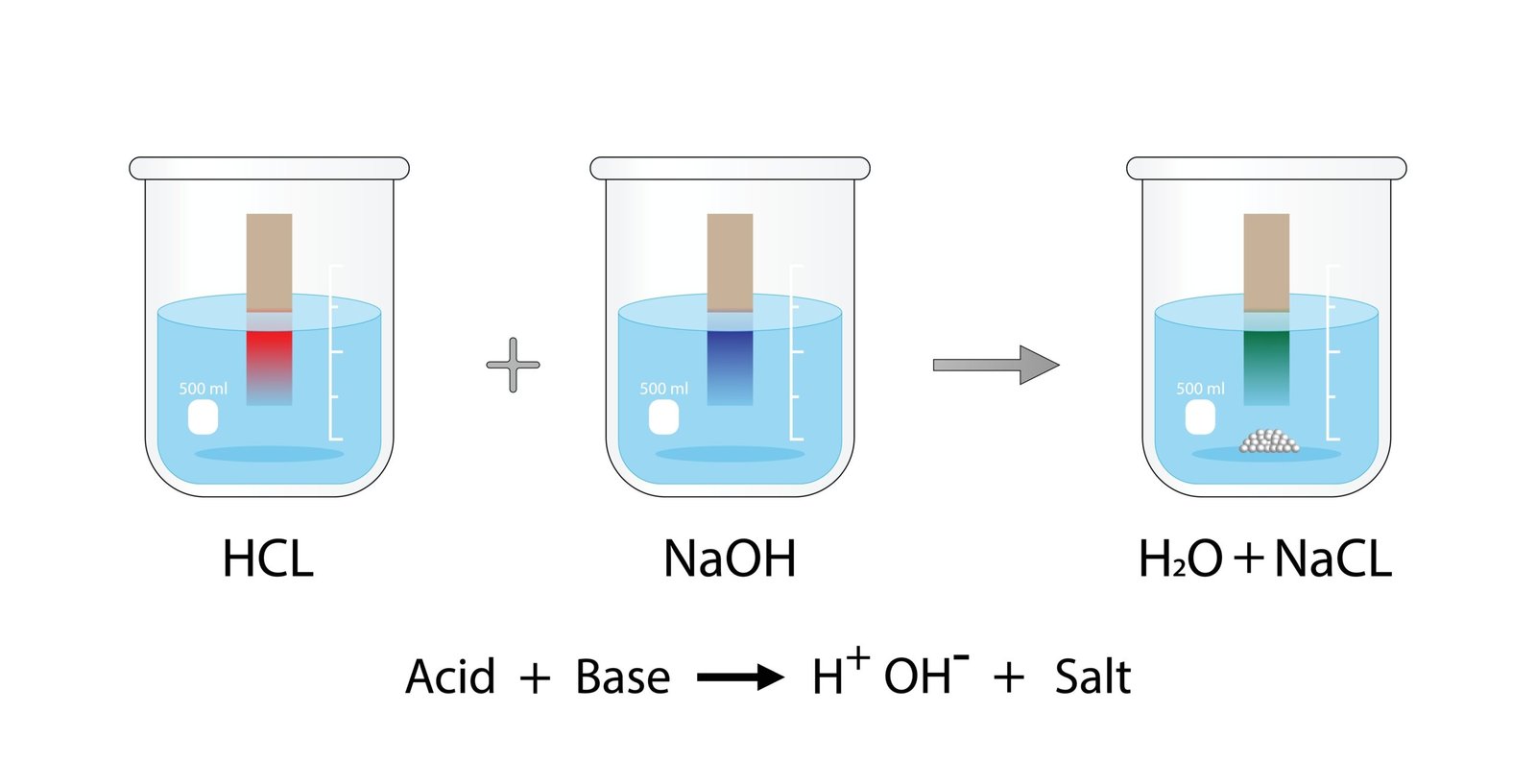
क्षारक के साथ अभिक्रिया कर लवण और जल बनाते हैं
💡 उदाहरण: HCl + NaOH → NaCl + H₂O
🔵 सांद्रता:
सांद्र अम्ल में जल की मात्रा कम होती है जबकि विलीन अम्ल में अधिक
🟡 2️⃣ क्षारक (Bases)
💡 परिभाषा:
वे पदार्थ जो जल में घुलकर हाइड्रॉक्साइड आयन (OH⁻) उत्पन्न करते हैं, क्षारक कहलाते हैं।
🔵 उदाहरण:
NaOH, KOH, Ca(OH)₂
✏️ प्रकार:
🟢 घुलनशील क्षारक – NaOH, KOH
🟡 अघुलनशील क्षारक – Cu(OH)₂, Fe(OH)₃
🔴 गुण:
कड़वे स्वाद के
फिसलनयुक्त स्पर्श
लाल लिटमस को नीला करते हैं
अम्लों के साथ अभिक्रिया कर लवण और जल बनाते हैं
💡 NaOH + HCl → NaCl + H₂O
कुछ क्षारक धातुओं से क्रिया कर हाइड्रोजन गैस उत्पन्न करते हैं
➡️ 2Al + 2NaOH + 6H₂O → 2NaAl(OH)₄ + 3H₂↑
🔵 3️⃣ लवण (Salts)
💡 परिभाषा:
अम्ल और क्षारक की अभिक्रिया से बनने वाले तटस्थ पदार्थ लवण कहलाते हैं।
✏️ उदाहरण:
NaCl, Na₂SO₄, CaCO₃
🟢 लवण बनने की अभिक्रिया:
➡️ अम्ल + क्षारक → लवण + जल
💡 H₂SO₄ + 2NaOH → Na₂SO₄ + 2H₂O
🔴 प्रकार:
सामान्य लवण (NaCl)
अम्लीय लवण (NaHSO₄)
क्षारीय लवण (Na₂CO₃)
🟡 प्रकृति:
अम्लीय, क्षारीय या तटस्थ हो सकते हैं
🟣 4️⃣ संकेतक (Indicators)
💡 परिभाषा:
वे पदार्थ जो अम्लीय या क्षारीय माध्यम में भिन्न रंग दिखाते हैं, संकेतक कहलाते हैं।
✏️ मुख्य संकेतक:
🔵 लिटमस – अम्ल में लाल, क्षारक में नीला
🟢 फिनॉल्फ्थेलिन – अम्ल में रंगहीन, क्षारक में गुलाबी
🟡 मीथाइल ऑरेंज – अम्ल में लाल, क्षारक में पीला
🔴 प्राकृतिक संकेतक – हल्दी, लाल पत्ता गोभी
🟢 5️⃣ अम्ल–क्षारक अभिक्रियाएँ (Neutralization Reactions)
💡 जब अम्ल और क्षारक क्रिया करते हैं तो लवण और जल बनता है तथा ऊष्मा निकलती है
➡️ HCl + NaOH → NaCl + H₂O + ऊष्मा
✔️ यह अभिक्रिया ऊष्माक्षेपी होती है
🔵 घरेलू उपयोग:
पेट की अम्लता में एंटासिड Mg(OH)₂ का उपयोग
कीट डंक में बेकिंग सोडा लगाने से राहत
🟡 6️⃣ pH मान (pH Scale)
💡 pH किसी विलयन की अम्लीय या क्षारीय प्रकृति को दर्शाता है
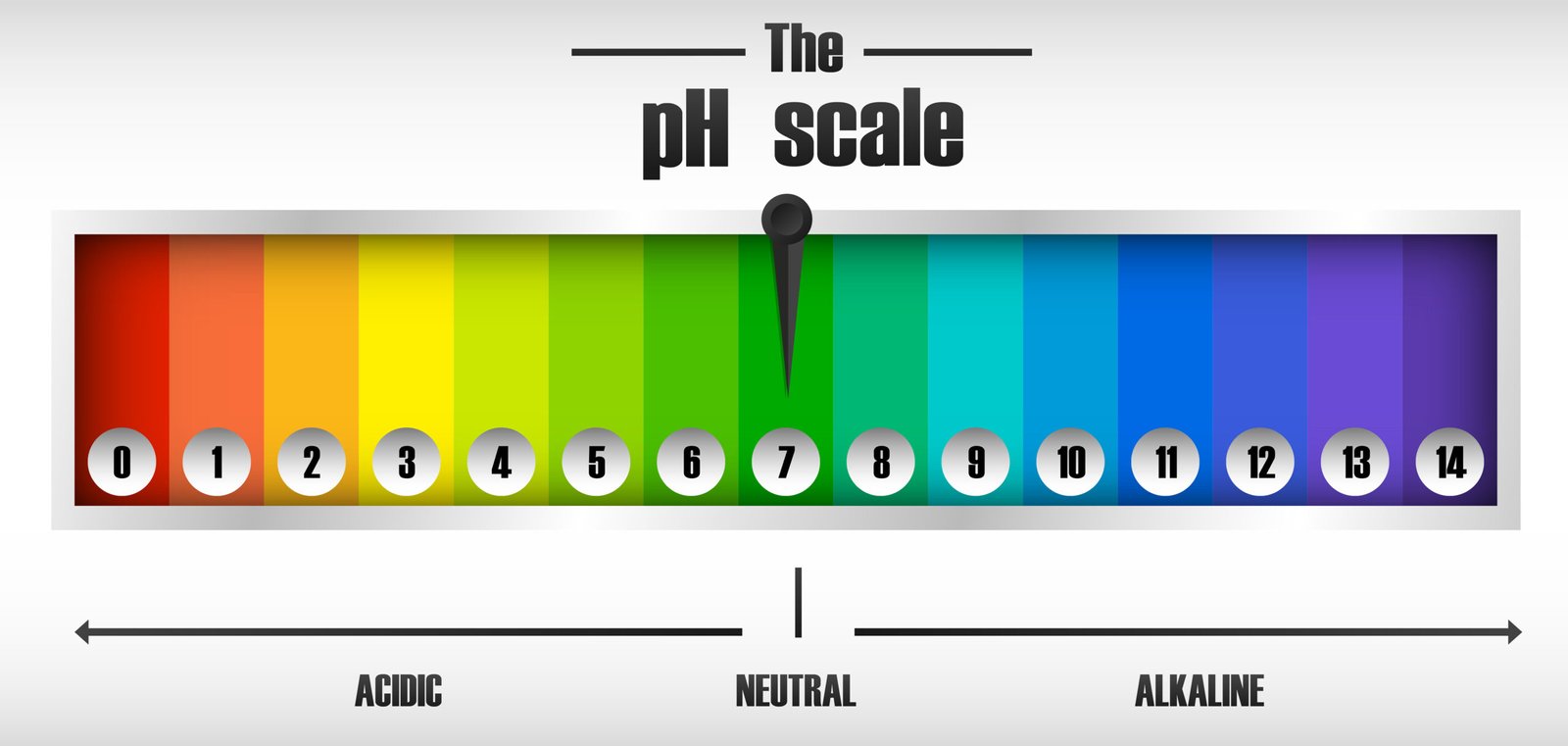
🔵 pH पैमाना: 0 से 14
0–7 अम्लीय
7 तटस्थ
7–14 क्षारीय
🟢 उपयोग:
मृदा की अम्लता नियंत्रित करने के लिए चूना
रक्त का pH 7.4 बनाए रखना
कृषि, औषधि और उद्योग में प्रयोग
🔴 7️⃣ सामान्य लवण एवं उनके उपयोग
💡 (a) सोडियम क्लोराइड (NaCl): खाने का नमक
💡 (b) सोडियम हाइड्रॉक्साइड (NaOH): साबुन, कागज़, वस्त्र उद्योग
💡 (c) बेकिंग सोडा (NaHCO₃): भोजन फुलाने व अम्लनाशी
💡 (d) वाशिंग सोडा (Na₂CO₃·10H₂O): कठोर जल को मुलायम बनाता है
💡 (e) प्लास्टर ऑफ पेरिस (CaSO₄·½H₂O): पट्टियाँ व सजावट
🟣 8️⃣ दैनंदिन जीवन में उपयोग
एंटासिड द्वारा पेट की अम्लता नियंत्रित
सोडियम कार्बोनेट से जल मुलायम
चूने से मृदा का संतुलन
औद्योगिक अम्लों का उपयोग
हड्डी स्थिरीकरण में प्लास्टर ऑफ पेरिस
🟡 9️⃣ सुरक्षा सावधानियाँ
अम्लों और क्षारकों को संभालते समय दस्ताने पहनें
हमेशा अम्ल को जल में डालें, जल को अम्ल में नहीं
त्वचा पर अम्ल गिरने पर तुरन्त जल और NaHCO₃ लगाएँ
क्षारक गिरने पर सिरका या कमजोर अम्ल लगाएँ
🔵 10️⃣ सारांश (Summary)
अम्ल → जल में H⁺ आयन उत्पन्न करते हैं, नीले लिटमस को लाल करते हैं
क्षारक → जल में OH⁻ आयन उत्पन्न करते हैं, लाल लिटमस को नीला करते हैं
लवण → अम्ल और क्षारक की क्रिया से बनते हैं
संकेतक → अम्ल व क्षारक की पहचान करते हैं
pH → अम्लता या क्षारकता का मान बताता है
उपयोग → औद्योगिक, औषधीय, कृषि व घरेलू कार्यों में
📝 Quick Recap
🔵 अम्ल – H⁺ आयन उत्पन्न करते हैं
🟢 क्षारक – OH⁻ आयन उत्पन्न करते हैं
🟡 अम्ल + क्षारक → लवण + जल + ऊष्मा
🔴 लिटमस, फिनॉल्फ्थेलिन, मीथाइल ऑरेंज मुख्य संकेतक
🟣 सामान्य लवण – NaCl, NaOH, NaHCO₃, Na₂CO₃, CaSO₄·½H₂O
✔️ अम्ल–क्षारक संतुलन जीवन और उद्योग दोनों में आवश्यक है
————————————————————————————————————————————————————————————————————————————
पाठ्यपुस्तक के प्रश्न
🔵 प्रश्न 1:
कोई विलयन लाल लिटमस को नीला कर देता है, इसका pH संभवतः क्या होगा?
(a) 1 (b) 4 (c) 5 (d) 10
🟢 उत्तर:
💡 लाल लिटमस का नीला होना दर्शाता है कि विलयन क्षारीय (Basic) है।
🔵 क्षारीय विलयन का pH मान 7 से अधिक होता है।
🟢 अतः दिए गए विकल्पों में 10 ही एकमात्र मान है जो क्षारीय विलयन को दर्शाता है।
✔️ सही उत्तर: (d) 10
🔵 प्रश्न 2:
कोई विलयन अंडे के फिसे हुए कवच से अभिक्रिया कर एक गैस उत्पन्न करता है जो चूने के पानी को दूधिया कर देती है। इस विलयन में क्या होगा?
(a) NaCl (b) HCl (c) LiCl (d) KCl
🟢 उत्तर:
💡 अंडे का कवच कैल्शियम कार्बोनेट (CaCO₃) से बना होता है।
🔵 जब यह किसी अम्ल जैसे HCl से क्रिया करता है तो कार्बन डाइऑक्साइड गैस उत्पन्न होती है:
➡️ CaCO₃ + 2HCl → CaCl₂ + H₂O + CO₂↑
🟢 CO₂ गैस चूने के पानी को दूधिया बना देती है क्योंकि —
➡️ CO₂ + Ca(OH)₂ → CaCO₃ + H₂O
✔️ सही उत्तर: (b) HCl
🔵 प्रश्न 3:
NaOH का 10 mL विलयन, HCl के 8 mL विलयन से पूर्णतः उदासीन हो जाता है। यदि हम NaOH के उसी विलयन का 20 mL लें तो इसे उदासीन करने के लिए HCl के उसी विलयन की कितनी मात्रा की आवश्यकता होगी?
(a) 4 mL (b) 8 mL (c) 12 mL (d) 16 mL
🟢 उत्तर:
💡 उदासीनता का नियम – अम्ल की शक्ति × आयतन = क्षारक की शक्ति × आयतन।
✏️ चूंकि सांद्रता समान है, अतः
NaOH (10 mL) ⇔ HCl (8 mL)
🔵 अनुपात 10 : 8 = 20 : x
➡️ 10 × 8 = 20 × x / ?
नहीं, सही चरण:
10 : 8 = 20 : x
🔵 x = (20 × 8) / 10
➡️ x = 16 mL
✔️ सही उत्तर: (d) 16 mL
🔵 प्रश्न 4:
अपच का उपचार करने के लिए निम्नलिखित में से किस औषधि का उपयोग होता है?
(a) एंटीबायोटिक (प्रतिजैविक)
(b) एनाल्जेसिक (पीड़ाहारी)
(c) एंटासिड (अम्लरोधी)
(d) एंटीसेप्टिक (प्रतिरोही)
🟢 उत्तर:
💡 अपच (Acidity) में पेट में अधिक अम्ल बनने से असुविधा होती है।
🔵 इसे निष्क्रिय करने के लिए क्षारीय औषधियाँ दी जाती हैं जिन्हें एंटासिड (Antacid) कहते हैं।
🟢 सामान्य एंटासिड उदाहरण – मैग्नीशियम हाइड्रॉक्साइड (Mg(OH)₂), एल्यूमिनियम हाइड्रॉक्साइड (Al(OH)₃)।
✔️ सही उत्तर: (c) एंटासिड (अम्लरोधी)
🔵 प्रश्न 5:
निम्नलिखित अभिक्रियाओं के लिए पहले शब्द-समीकरण लिखिए तथा उसके बाद संतुलित समीकरण लिखिए –
(a) जब सल्फ्यूरिक अम्ल जिंक के साथ अभिक्रिया करता है।
(b) जब सोडियम हाइड्रॉक्साइड हाइड्रोक्लोरिक अम्ल के साथ अभिक्रिया करता है।
(c) जब हाइड्रोक्लोरिक अम्ल एल्यूमिनियम के साथ अभिक्रिया करता है।
(d) जब जिंक सल्फ्यूरिक अम्ल के साथ अभिक्रिया करता है।
🟢 उत्तर:
(a) शब्द-समीकरण: सल्फ्यूरिक अम्ल + जिंक → जिंक सल्फेट + हाइड्रोजन
🔵 संतुलित समीकरण: H₂SO₄ + Zn → ZnSO₄ + H₂↑
(b) शब्द-समीकरण: सोडियम हाइड्रॉक्साइड + हाइड्रोक्लोरिक अम्ल → सोडियम क्लोराइड + जल
🔵 संतुलित समीकरण: NaOH + HCl → NaCl + H₂O
(c) शब्द-समीकरण: हाइड्रोक्लोरिक अम्ल + एल्यूमिनियम → एल्यूमिनियम क्लोराइड + हाइड्रोजन
🔵 संतुलित समीकरण: 6HCl + 2Al → 2AlCl₃ + 3H₂↑
(d) शब्द-समीकरण: जिंक + सल्फ्यूरिक अम्ल → जिंक सल्फेट + हाइड्रोजन
🔵 संतुलित समीकरण: Zn + H₂SO₄ → ZnSO₄ + H₂↑
✔️ सभी समीकरण संतुलित हैं और धातु + अम्ल अभिक्रिया के उदाहरण हैं।
🔵 प्रश्न 6:
फलों के रस में अम्ल होते हैं और हाइड्रोजन आयन होते हैं, लेकिन इनका pH मान अम्ल की तरह नहीं होता है। एक वैज्ञानिक कारण देकर समझाइए।
🟢 उत्तर:
💡 फलों के रस में अम्ल होते हैं, परंतु ये कमज़ोर अम्ल (Weak Acids) हैं।
🔵 ये जल में पूर्णतः आयनित नहीं होते, इसलिए H⁺ आयनों की मात्रा कम होती है।
🟢 फलस्वरूप उनका pH 4–6 के बीच रहता है, जो बहुत तीव्र अम्लता नहीं दर्शाता।
✔️ निष्कर्ष: फलों के रस का अम्लीय प्रभाव मृदु होता है क्योंकि इनमें अम्ल आंशिक रूप से आयनित होते हैं।
🔵 प्रश्न 7:
शुद्ध जल विद्युत का चालक क्यों नहीं है, जबकि नमक का घोल चालक होता है?
🟢 उत्तर:
💡 शुद्ध जल में आयन (H⁺ और OH⁻) बहुत कम मात्रा में होते हैं, इसलिए यह विद्युत का चालक नहीं है।
🔵 नमक का घोल (जैसे NaCl) आयनों में विघटित होता है:
➡️ NaCl → Na⁺ + Cl⁻
🟢 ये आयन विद्युत धारा का वहन करते हैं।
✔️ निष्कर्ष: विद्युत चालकता आयनों की उपस्थिति पर निर्भर करती है, जो शुद्ध जल में नहीं होती।
🔵 प्रश्न 8:
जल की अशुद्धियों में अम्ल या क्षारक की उपस्थिति की जाँच कैसे की जाती है?
🟢 उत्तर:
💡 किसी जल नमूने में अम्ल या क्षारक की पहचान के लिए संकेतकों का उपयोग किया जाता है।
🔵 लिटमस परीक्षण सबसे सरल है —
नीला लिटमस → लाल बने तो अम्ल
लाल लिटमस → नीला बने तो क्षारक
🟢 अन्य संकेतक – फिनॉल्फ्थेलिन (क्षारक में गुलाबी), मीथाइल ऑरेंज (अम्ल में लाल)।
✔️ निष्कर्ष: संकेतकों के रंग परिवर्तन से जल की अम्लीय या क्षारीय प्रकृति ज्ञात की जा सकती है।
🔵 प्रश्न 9:
पाँच विलयनों A, B, C, D, और E की जब सार्वभौमिक सूचक से जाँच की जाती है तो pH के मान क्रमशः 4, 1, 11, 7, एवं 9 प्राप्त होते हैं। कौन-सा विलयन —
(a) उदासीन है?
(b) प्रबल अम्लीय है?
(c) प्रबल क्षारीय है?
(d) दुर्बल अम्लीय है?
(e) दुर्बल क्षारीय है?
🟢 उत्तर:
💡 pH मान का अर्थ —
- pH = 7 → उदासीन (Neutral)
- pH < 7 → अम्लीय
- pH > 7 → क्षारीय
🔵 अब प्रश्न के अनुसार —
(a) उदासीन विलयन: D (pH = 7)
(b) प्रबल अम्लीय विलयन: B (pH = 1)
(c) प्रबल क्षारीय विलयन: C (pH = 11)
(d) दुर्बल अम्लीय विलयन: A (pH = 4)
(e) दुर्बल क्षारीय विलयन: E (pH = 9)
✔️ अंतिम उत्तर:
(a) D (b) B (c) C (d) A (e) E
🔵 प्रश्न 10:
pH के मानों को हाइड्रोजन आयन की सांद्रता के आरोही क्रम में व्यवस्थित कीजिए।
🟢 उत्तर:
💡 हाइड्रोजन आयन की सांद्रता (H⁺) और pH में संबंध:
➡️ [H⁺] = 1 / 10^(pH)
🔵 इसलिए pH जितना कम होगा, H⁺ आयनों की मात्रा उतनी अधिक होगी।
🟢 आरोही क्रम में H⁺ आयन सांद्रता =
pH 11 < pH 9 < pH 7 < pH 4 < pH 1
✔️ अर्थात्:
C < E < D < A < B (आरोही क्रम में H⁺ आयन सांद्रता)
🔵 प्रश्न 11:
फसलतल ‘A’ एवं ‘B’ में समान लंबाई की मैग्नीशियम की पट्टियाँ डालिए। फसलतल ‘A’ में हाइड्रोक्लोरिक अम्ल (HCl) तथा फसलतल ‘B’ में एसीटिक अम्ल (CH₃COOH) डालिए। दोनों अम्लों की मात्रा तथा सांद्रता समान है। किस फसलतल में अधिक तीव्रता से बुदबुदाहट होगी तथा क्यों?
🟢 उत्तर:
💡 अभिक्रियाएँ —
➡️ Mg + 2HCl → MgCl₂ + H₂↑
➡️ Mg + 2CH₃COOH → (CH₃COO)₂Mg + H₂↑
🟢 हाइड्रोक्लोरिक अम्ल (HCl) एक प्रबल अम्ल है जो पूर्ण रूप से आयनित होता है।
🟡 एसीटिक अम्ल (CH₃COOH) एक दुर्बल अम्ल है जो आंशिक रूप से आयनित होता है।
🔴 अतः HCl से अभिक्रिया में हाइड्रोजन गैस तेज़ी से बनेगी।
✔️ निष्कर्ष:
फसलतल ‘A’ में अधिक बुदबुदाहट होगी क्योंकि HCl, CH₃COOH की अपेक्षा अधिक H⁺ आयन उत्पन्न करता है।
🔵 प्रश्न 12:
ताज़े दूध का pH का मान 6 होता है। दही बनने पर इसके pH के मान में क्या परिवर्तन होगा? अपना उत्तर समझाइए।
🟢 उत्तर:
💡 दही बनने की प्रक्रिया में दूध में उपस्थित लैक्टोज शर्करा, लैक्टिक अम्ल में परिवर्तित हो जाती है।
🔵 इस अम्ल के बनने से दूध का pH घटता है।
➡️ नया pH < 6 (लगभग 4.5)
✔️ निष्कर्ष:
दही बनने पर दूध का pH कम हो जाता है क्योंकि उसमें अम्लता बढ़ जाती है।
🔵 प्रश्न 13:
एक ताज़ा तले हुए दूध में थोड़ा बेकिंग सोडा मिलाया है।
(a) ताज़ा दूध के pH के मान को 6 से बदलकर थोड़ा क्षारीय क्यों बना देता है?
(b) इस दूध के दही बनने में अधिक समय क्यों लगता है?
🟢 उत्तर:
(a)
💡 बेकिंग सोडा (NaHCO₃) एक क्षारीय यौगिक है।
➡️ NaHCO₃ + H⁺ → Na⁺ + CO₂ + H₂O
🔵 यह दूध में उपस्थित अम्लीय तत्वों को निष्क्रिय करता है।
✔️ इसलिए दूध का pH 6 से बढ़कर क्षारीय (लगभग 8) हो जाता है।
(b)
💡 दही बनने के लिए अम्लता आवश्यक है।
🔵 जब दूध क्षारीय हो जाता है, तो लैक्टिक अम्ल बनने में अधिक समय लगता है।
✔️ इसलिए दही बनने की प्रक्रिया धीमी हो जाती है।
🔵 प्रश्न 14:
प्लास्टिक ऑफ़ पेरिस को वायुरोधी बर्तन में क्यों रखा जाना चाहिए? इसकी व्याख्या कीजिए।
🟢 उत्तर:
💡 प्लास्टर ऑफ पेरिस (CaSO₄·½H₂O) जल के साथ अभिक्रिया कर जिप्सम (CaSO₄·2H₂O) बनाता है।
➡️ CaSO₄·½H₂O + 1½H₂O → CaSO₄·2H₂O
🔵 यदि इसे खुले में रखा जाए तो यह हवा की नमी से अभिक्रिया कर ठोस जिप्सम में परिवर्तित हो जाएगा।
✔️ निष्कर्ष:
प्लास्टर ऑफ पेरिस को नमी से बचाने हेतु वायुरोधी बर्तन में रखना चाहिए।
🔵 प्रश्न 15:
उदासनीकरण अभिक्रिया क्या है? दो उदाहरण दीजिए।
🟢 उत्तर:
💡 जब अम्ल और क्षार अभिक्रिया करके लवण और जल बनाते हैं, तो उसे उदासनीकरण (Neutralization) कहते हैं।
🧪 उदाहरण 1:
➡️ NaOH + HCl → NaCl + H₂O
🧪 उदाहरण 2:
➡️ H₂SO₄ + 2KOH → K₂SO₄ + 2H₂O
✔️ निष्कर्ष:
उदासनीकरण अभिक्रिया में अम्लीय और क्षारीय प्रभाव परस्पर समाप्त हो जाते हैं।
————————————————————————————————————————————————————————————————————————————
अन्य महत्वपूर्ण प्रश्न
(CBSE MODEL प्रश्न पत्र)
सिर्फ इसी पाठ से निर्मित CBSE MODEL प्रश्न पत्र
🔵 SECTION A (प्रश्न 1–6 : 1 अंक वाले लघु या वस्तुनिष्ठ प्रश्न)
🔵 Question 1:
किसी विलयन का pH मान 1 है। यह किस प्रकार का विलयन है?
🟢 Answer:
💡 pH = 1 का अर्थ है अत्यधिक अम्लीय विलयन।
✔️ यह एक प्रबल अम्लीय विलयन है।
🔵 Question 2:
कौन-सा अम्ल पेट में पाया जाता है जो भोजन के पाचन में सहायता करता है?
🟢 Answer:
➡️ पेट में पाया जाने वाला अम्ल हाइड्रोक्लोरिक अम्ल (HCl) होता है।
✔️ यह पाचक रसों के निर्माण और भोजन के विघटन में सहायक होता है।
🔵 Question 3:
कौन-सा पदार्थ अम्लीय जलने (acid burn) के उपचार में प्रयोग किया जाता है?
🟢 Answer:
➡️ अम्लीय जलन के उपचार के लिए सोडियम हाइड्रोजेन कार्बोनेट (NaHCO₃) या बेकिंग सोडा का प्रयोग किया जाता है क्योंकि यह क्षारीय होता है।
🔵 Question 4:
कौन-सा सूचक (indicator) अम्लीय विलयन में लाल और क्षारीय विलयन में नीला होता है?
🟢 Answer:
➡️ लिटमस (Litmus) सूचक।
✔️ अम्लीय विलयन में लाल तथा क्षारीय विलयन में नीला रंग दर्शाता है।
🔵 Question 5:
कैल्सियम ऑक्साइड (CaO) को बुझा चूना क्यों कहा जाता है?
🟢 Answer:
➡️ CaO जल के साथ अभिक्रिया कर Ca(OH)₂ बनाता है:
CaO + H₂O → Ca(OH)₂
✔️ यह अभिक्रिया ऊष्माक्षेपी होती है, इसलिए इसे बुझा चूना कहते हैं।
🔵 Question 6:
बेकिंग पाउडर में कौन-से दो यौगिक होते हैं?
🟢 Answer:
➡️ बेकिंग पाउडर = सोडियम हाइड्रोजेन कार्बोनेट (NaHCO₃) + टार्टरिक अम्ल (C₄H₆O₆)
✔️ यह गैस उत्पन्न कर आटे को फुलाने में मदद करता है।
🟢 SECTION B (प्रश्न 7–12 : 2 अंक वाले प्रश्न)
🔵 Question 7:
NaOH और HCl के बीच उदासनीकरण अभिक्रिया लिखिए तथा उसका उत्पाद बताइए।
🟢 Answer:
💡 जब अम्ल और क्षार क्रिया करते हैं तो लवण एवं जल बनता है।
➡️ NaOH + HCl → NaCl + H₂O
✔️ उत्पाद: सोडियम क्लोराइड (NaCl) और जल।
🔵 Question 8:
किसी अम्ल और क्षारक के बीच उदासनीकरण अभिक्रिया ऊष्माक्षेपी क्यों होती है?
🟢 Answer:
💡 अम्ल और क्षार अभिक्रिया कर जल बनाते हैं जिससे ऊष्मा निकलती है।
➡️ H⁺ + OH⁻ → H₂O + Heat
✔️ इसलिए यह अभिक्रिया ऊष्माक्षेपी (Exothermic) होती है।
🔵 Question 9:
HCl और CH₃COOH में क्या अंतर है? कौन-सा अधिक प्रबल अम्ल है और क्यों?
🟢 Answer:
➡️ HCl एक प्रबल अम्ल है जो पूर्ण रूप से आयनित होता है।
➡️ CH₃COOH एक दुर्बल अम्ल है जो आंशिक रूप से आयनित होता है।
✔️ इसलिए HCl अधिक प्रबल अम्ल है क्योंकि यह अधिक H⁺ आयन उत्पन्न करता है।
🔵 Question 10:
NaHCO₃ का उपयोग अम्लीय अपच के उपचार में कैसे किया जाता है?
🟢 Answer:
💡 NaHCO₃ क्षारीय प्रकृति का होता है जो पेट के HCl को निष्क्रिय करता है।
➡️ NaHCO₃ + HCl → NaCl + H₂O + CO₂↑
✔️ परिणाम: पेट की अम्लता समाप्त होकर आराम मिलता है।
🔵 Question 11:
pH मान क्या है और इसे कैसे ज्ञात किया जाता है?
🟢 Answer:
💡 pH किसी विलयन में हाइड्रोजन आयन (H⁺) की सांद्रता का माप है।
➡️ pH = −log[H⁺]
🟢 इसे pH पेपर या सार्वभौमिक सूचक से ज्ञात किया जाता है।
🔵 Question 12:
कैल्शियम सल्फेट हेमीहाइड्रेट को प्लास्टर ऑफ पेरिस क्यों कहा जाता है?
🟢 Answer:
➡️ इसका सूत्र CaSO₄·½H₂O होता है जो जल मिलने पर जिप्सम (CaSO₄·2H₂O) बनाता है।
✔️ यह जलने पर मुलायम और ठंडा परतदार पदार्थ बनाता है इसलिए इसे प्लास्टर ऑफ पेरिस कहा जाता है।
🟡 SECTION C (प्रश्न 13–22 : 3 अंक वाले मध्यम प्रश्न)
🔵 Question 13:
क्यों अम्ल जल में घुलने पर आयन बनाते हैं जबकि अल्कोहल ऐसा नहीं करते?
🟢 Answer:
💡 अम्ल (Acid) जल में घुलने पर हाइड्रोजन आयन (H⁺) बनाते हैं, उदाहरण –
➡️ HCl + H₂O → H₃O⁺ + Cl⁻
🔵 जबकि अल्कोहल (जैसे C₂H₅OH) में OH समूह सहसंयोजक बंध से जुड़ा होता है, जो जल में आयनित नहीं होता।
✔️ इसलिए अल्कोहल विद्युत चालक नहीं होता जबकि अम्ल चालक होता है।
🔵 Question 14:
अम्ल वर्षा (acid rain) क्या है? इसके दो हानिकारक प्रभाव बताइए।
🟢 Answer:
💡 जब वायुमण्डल में उपस्थित सल्फर डाइऑक्साइड (SO₂) और नाइट्रोजन ऑक्साइड (NO₂) जलवाष्प से अभिक्रिया कर H₂SO₄ और HNO₃ बनाते हैं, तो इन्हें अम्ल वर्षा कहते हैं।
➡️ SO₂ + H₂O → H₂SO₃
➡️ 2NO₂ + H₂O → HNO₂ + HNO₃
🟢 हानिकारक प्रभाव:
🔹 फसलों, पेड़ों और मिट्टी की उर्वरता को नष्ट करती है।
🔹 भवनों और संगमरमर की मूर्तियों (जैसे ताजमहल) को क्षति पहुँचाती है।
✔️ निष्कर्ष: अम्ल वर्षा पर्यावरण और स्थापत्य दोनों के लिए हानिकारक है।
🔵 Question 15:
जब धातु अम्ल के साथ अभिक्रिया करती है, तो क्या बनता है? एक उदाहरण सहित समझाइए।
🟢 Answer:
💡 धातु + अम्ल → लवण + हाइड्रोजन गैस
उदाहरण –
➡️ Zn + 2HCl → ZnCl₂ + H₂↑
🟢 इस गैस की पुष्टि चटकने वाली आवाज़ से होती है जब इसे जलती हुई तीली से पास लाया जाता है।
✔️ निष्कर्ष: अम्ल धातुओं से अभिक्रिया कर हाइड्रोजन गैस उत्पन्न करते हैं।
🔵 Question 16:
NaOH विलयन के विद्युत अपघटन से क्या उत्पाद बनते हैं?
🟢 Answer:
💡 NaOH का विद्युत अपघटन (Electrolysis) → सोडियम आयन और हाइड्रॉक्साइड आयन।
➡️ 2NaOH → 2Na + H₂O + ½O₂ + H₂↑
🟢 उत्पाद – सोडियम, हाइड्रोजन और ऑक्सीजन गैस।
✔️ यह प्रक्रिया विद्युत उद्योग में महत्वपूर्ण है।
🔵 Question 17:
टूथपेस्ट का pH 8–9 के बीच क्यों रखा जाता है?
🟢 Answer:
💡 हमारे मुख में बनने वाला लार अम्लीय हो जाता है जब बैक्टीरिया भोजन के अवशेषों को विघटित करते हैं।
🔵 अम्लीय लार दाँतों की इनेमल (Ca₅(PO₄)₃OH) को घोल देता है।
🟢 क्षारीय टूथपेस्ट (pH > 7) इस अम्ल को निष्क्रिय करता है और दाँतों की रक्षा करता है।
✔️ निष्कर्ष: टूथपेस्ट को थोड़ा क्षारीय रखा जाता है ताकि दाँतों को अम्लीय क्षति से बचाया जा सके।
🔵 Question 18:
क्यों अम्लीय विलयन नीले लिटमस को लाल और क्षारीय विलयन लाल लिटमस को नीला करते हैं?
🟢 Answer:
💡 अम्ल में H⁺ आयन होते हैं जो नीले लिटमस को लाल बना देते हैं।
💡 क्षार में OH⁻ आयन होते हैं जो लाल लिटमस को नीला बना देते हैं।
✔️ यह सूचक की रासायनिक संरचना में होने वाले परिवर्तन के कारण होता है।
🔵 Question 19 (OR):
(a) HCl, H₂SO₄, और HNO₃ में कौन सबसे प्रबल अम्ल है और क्यों?
(b) अम्लों के तीन प्रयोग बताइए।
🟢 Answer:
(a) H₂SO₄ सबसे प्रबल अम्ल है क्योंकि यह पूर्ण रूप से आयनित होकर दो H⁺ आयन देता है।
(b) प्रयोग –
🔹 बैटरी निर्माण में (H₂SO₄)
🔹 उर्वरक निर्माण में (HNO₃)
🔹 धातु की सफाई में (HCl)
🔵 Question 20:
जब बेकिंग सोडा को गरम किया जाता है तो क्या होता है? संतुलित समीकरण लिखिए।
🟢 Answer:
💡 बेकिंग सोडा (NaHCO₃) को गरम करने पर → सोडियम कार्बोनेट, जल और कार्बन डाइऑक्साइड बनते हैं।
➡️ 2NaHCO₃ → Na₂CO₃ + H₂O + CO₂↑
✔️ यह अभिक्रिया ऊष्मीय विघटन (Thermal decomposition) है।
🔵 Question 21:
क्या सभी लवणों का pH 7 होता है? उचित कारण सहित बताइए।
🟢 Answer:
💡 नहीं, सभी लवणों का pH 7 नहीं होता।
- मजबूत अम्ल + मजबूत क्षार → pH = 7 (उदाहरण: NaCl)
- मजबूत अम्ल + कमजोर क्षार → pH < 7 (उदाहरण: NH₄Cl)
- कमजोर अम्ल + मजबूत क्षार → pH > 7 (उदाहरण: Na₂CO₃)
✔️ इसलिए लवण का pH उसके बनने वाले अम्ल और क्षार पर निर्भर करता है।
🔵 Question 22 (OR):
(a) अम्ल व क्षार के बीच अंतर लिखिए।
(b) लवण के दो उपयोग बताइए।
🟢 Answer:
(a)
🔹 अम्ल → खट्टे, नीले लिटमस को लाल करते हैं, H⁺ आयन देते हैं।
🔹 क्षार → कड़वे, लाल लिटमस को नीला करते हैं, OH⁻ आयन देते हैं।
(b)
🔹 लवण का उपयोग दाँत मंजन, सोडा ऐश, खाद्य संरक्षण आदि में।
🔹 बेकिंग सोडा व वाशिंग सोडा घरेलू उपयोग में सामान्य लवण हैं।
🔴 SECTION D (प्रश्न 23–30 : 4 अंक वाले दीर्घ एवं अनुप्रयोगात्मक प्रश्न)
🔵 Question 23:
pH स्केल क्या है? अम्लीय, उदासीन और क्षारीय विलयनों के लिए pH मानों की श्रेणियाँ लिखिए। pH का महत्व स्पष्ट कीजिए।
🟢 Answer:
💡 pH स्केल: यह किसी विलयन में हाइड्रोजन आयन (H⁺) की सांद्रता का माप है।
➡️ pH = –log[H⁺]
🔵 श्रेणियाँ:
- 0 से 7 → अम्लीय
- 7 → उदासीन
- 7 से 14 → क्षारीय
🟢 महत्व:
🔹 मानव शरीर के रक्त का pH लगभग 7.4 होता है; यह बदलने पर स्वास्थ्य पर असर होता है।
🔹 मिट्टी का pH फसलों की वृद्धि के लिए नियंत्रित रखना आवश्यक है।
🔹 औद्योगिक रासायनिक प्रक्रियाओं में भी सही pH अत्यंत आवश्यक होता है।
✔️ निष्कर्ष: pH प्राकृतिक एवं औद्योगिक दोनों स्तरों पर रासायनिक संतुलन का सूचक है।
🔵 Question 24:
आपके विद्यालय के प्रयोगशाला में तीन रंगहीन द्रव रखे हैं — हाइड्रोक्लोरिक अम्ल, सोडियम हाइड्रॉक्साइड तथा पानी। आप कैसे पहचानेंगे कि कौन-सा कौन है?
🟢 Answer:
💡 सूचक (Indicators) के प्रयोग से पहचान संभव है।
🔹 लिटमस परीक्षण:
- नीला लिटमस → लाल बने → अम्ल (HCl)
- लाल लिटमस → नीला बने → क्षार (NaOH)
- कोई परिवर्तन नहीं → जल (H₂O)
🔹 फिनॉल्फ्थेलिन परीक्षण:
- गुलाबी रंग → क्षार
- रंगहीन → अम्ल या जल
✔️ निष्कर्ष:
दोनों परीक्षणों के परिणामों की तुलना से तीनों विलयनों की पहचान की जा सकती है।
🔵 Question 25 (OR):
(a) अम्ल वर्षा के बनने की रासायनिक प्रक्रिया समझाइए।
(b) इसके दो पर्यावरणीय प्रभाव बताइए।
🟢 Answer:
(a)
💡 जब SO₂, NO₂ जैसी गैसें वातावरण में उपस्थित जलवाष्प से क्रिया करती हैं:
➡️ SO₂ + H₂O → H₂SO₃
➡️ 2NO₂ + H₂O → HNO₂ + HNO₃
🔵 ये वर्षा के साथ नीचे गिरकर अम्लीय जल बनाती हैं।
(b)
🔹 फसलों व मिट्टी की उर्वरता कम करती है।
🔹 ऐतिहासिक स्मारकों की संगमरमर सतह को क्षति पहुँचाती है (जैसे ताजमहल)।
✔️ निष्कर्ष: अम्ल वर्षा वायुमंडलीय प्रदूषण की गंभीर समस्या है।
🔵 Question 26:
‘सोडा ऐश’ क्या है? इसे कैसे प्राप्त किया जाता है? इसके दो उपयोग बताइए।
🟢 Answer:
💡 सोडा ऐश: सोडियम कार्बोनेट (Na₂CO₃) को ही सोडा ऐश कहते हैं।
➡️ 2NaHCO₃ (गरम करने पर) → Na₂CO₃ + CO₂ + H₂O
🟢 उपयोग:
🔹 काँच उद्योग में।
🔹 धुलाई के साबुनों और डिटर्जेंट निर्माण में।
✔️ निष्कर्ष: सोडा ऐश एक महत्वपूर्ण औद्योगिक लवण है।
🔵 Question 27:
प्लास्टर ऑफ पेरिस क्या है? इसे कैसे बनाया जाता है? इसका एक उपयोग लिखिए।
🟢 Answer:
💡 रासायनिक सूत्र: CaSO₄·½H₂O
🔵 निर्माण:
➡️ CaSO₄·2H₂O (जिप्सम) → CaSO₄·½H₂O + 1½H₂O (गर्म करने पर)
🟢 उपयोग:
🔹 टूटी हुई हड्डियों पर पट्टी बाँधने में।
✔️ निष्कर्ष: प्लास्टर ऑफ पेरिस जल से अभिक्रिया कर जिप्सम बनाता है, इसलिए इसे वायुरोधी पात्र में रखा जाता है।
🔵 Question 28 (OR):
(a) बेकिंग पाउडर और बेकिंग सोडा में क्या अंतर है?
(b) बेकिंग पाउडर से आटा फुलाने का सिद्धांत समझाइए।
🟢 Answer:
(a)
🔹 बेकिंग सोडा: NaHCO₃
🔹 बेकिंग पाउडर: NaHCO₃ + टार्टरिक अम्ल
(b)
➡️ 2NaHCO₃ → Na₂CO₃ + CO₂ + H₂O
💡 CO₂ गैस आटे में बुलबुले बनाती है जिससे वह फुल जाता है।
✔️ निष्कर्ष: बेकिंग पाउडर का उपयोग हल्के व फूले हुए खाद्य पदार्थ बनाने में किया जाता है।
🔵 Question 29:
धातुएँ अम्लों और क्षारों दोनों के साथ अभिक्रिया क्यों कर सकती हैं? उपयुक्त उदाहरण दीजिए।
🟢 Answer:
💡 धातुएँ प्रतिक्रियाशील होती हैं और वे इलेक्ट्रॉन देती हैं जिससे लवण व हाइड्रोजन बनते हैं।
🔹 अम्ल के साथ:
➡️ Zn + 2HCl → ZnCl₂ + H₂↑
🔹 क्षार के साथ:
➡️ Al + 2NaOH → NaAlO₂ + H₂↑
✔️ निष्कर्ष: धातुएँ अम्ल व क्षार दोनों के साथ अभिक्रिया कर सकती हैं क्योंकि वे दोनों में इलेक्ट्रॉनों का आदान-प्रदान कर स्थायित्व प्राप्त करती हैं।
🔵 Question 30:
मानव शरीर में pH का संतुलन क्यों आवश्यक है? यदि रक्त का pH घट जाए तो क्या होगा?
🟢 Answer:
💡 सामान्य रक्त का pH = 7.4 होता है।
🔵 यदि यह मान घटे (7 से कम) तो रक्त अम्लीय हो जाता है।
🟢 यह स्थिति एसिडोसिस कहलाती है जिससे अंगों की क्रिया प्रभावित होती है।
✔️ निष्कर्ष: pH का संतुलन शरीर के रासायनिक व जैविक संतुलन के लिए आवश्यक है।
————————————————————————————————————————————————————————————————————————————
दृश्य सामग्री
————————————————————————————————————————————————————————————————————————————
