Class 11 : Chemistry (In Hindi) – Lesson 4. रासायनिक बंधन और आणविक संरचना
पाठ का विश्लेषण एवं विवेचन
🔵 प्रस्तावना
🌟 सभी पदार्थ परमाणुओं से बने होते हैं, परन्तु अकेला परमाणु प्रायः स्थायी नहीं होता। परमाणु परस्पर मिलकर अणु या यौगिक बनाते हैं। यह संयोजन “रासायनिक बन्धन” कहलाता है। अणुओं की स्थिरता और गुणधर्म इन्हीं बन्धनों पर निर्भर करते हैं। इस अध्याय में हम बन्धनों के प्रकार, उनके बनने के सिद्धान्त और अणु की संरचना का अध्ययन करेंगे।
🟢 स्थायित्व की आवश्यकता
✏ परमाणु अपनी बाह्यतम कोशिका को पूर्ण (सामान्यतः 8 इलेक्ट्रॉन) करना चाहता है।
📍 ऑक्टेट नियम: परमाणु संयोजन के समय इस प्रकार इलेक्ट्रॉन का लेन-देन या साझेदारी करता है कि उसकी बाहरी परत में 8 इलेक्ट्रॉन हो जाएँ।
🔴 आयनिक बन्धन (विद्युत संयोजक बन्धन)
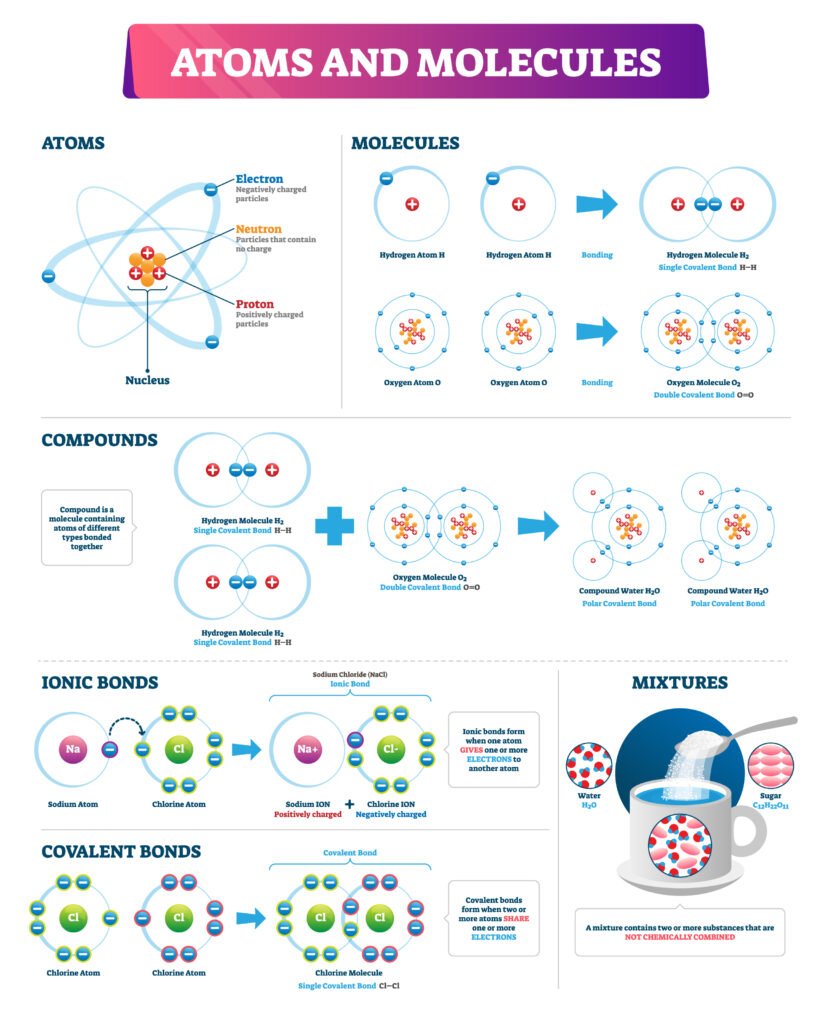
📍 परिभाषा: जब एक परमाणु दूसरे को इलेक्ट्रॉन देकर धनायन बनता है और दूसरा इलेक्ट्रॉन ग्रहण कर ऋणायन बनता है, तो विपरीत आवेशित आयनों के बीच आकर्षण से जो बन्ध बनता है उसे आयनिक बन्धन कहते हैं।
✨ उदाहरण: NaCl
Na → Na⁺ + e⁻
Cl + e⁻ → Cl⁻
✔ Na⁺ और Cl⁻ के बीच विद्युत आकर्षण = आयनिक बन्धन।
🔵 विशेषताएँ:
उच्च गलनांक और क्वथनांक।
जल में घुलनशील।
द्रव या विलयन अवस्था में विद्युत चालक।

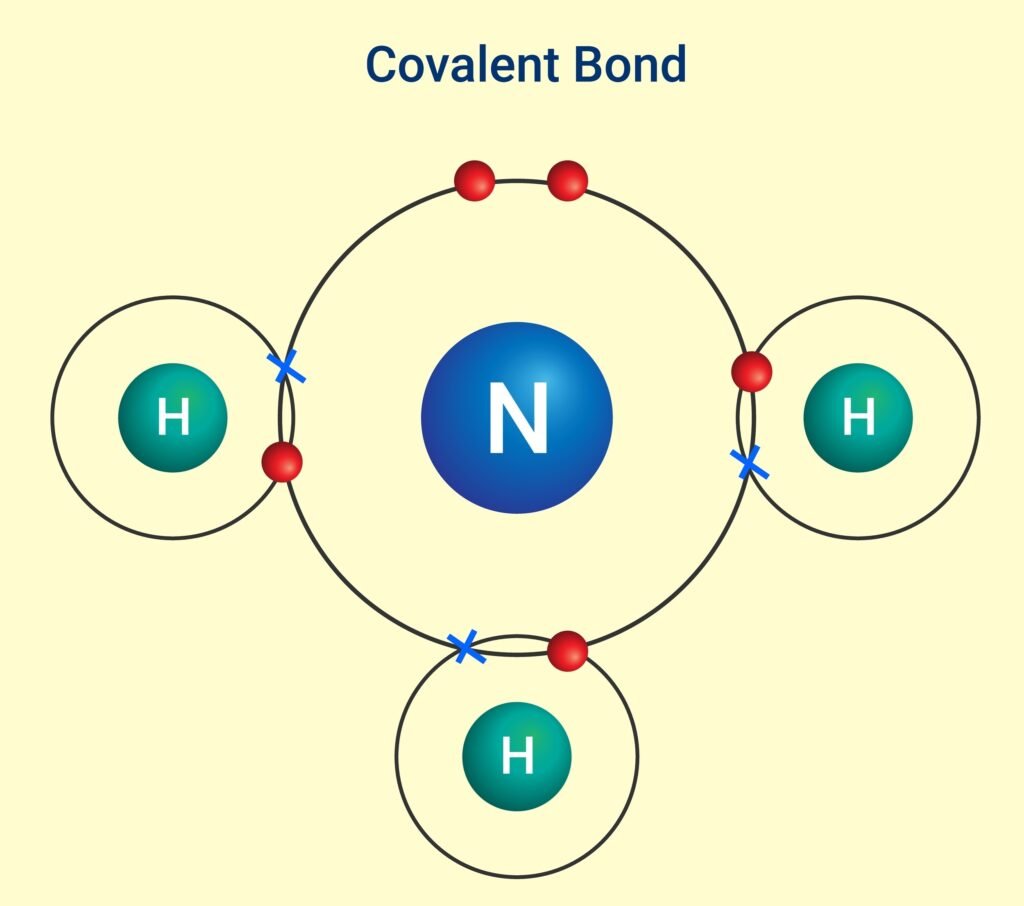
🟡 सहसंयोजक बन्धन
📍 परिभाषा: जब दो परमाणु अपने इलेक्ट्रॉन साझे में रखते हैं ताकि दोनों का ऑक्टेट पूर्ण हो सके, तो बना बन्ध सहसंयोजक बन्धन कहलाता है।
✨ उदाहरण: H₂, O₂, N₂, H₂O, CH₄।
✔ सहसंयोजक बन्धन में इलेक्ट्रॉनों की जोड़ी साझा होती है।
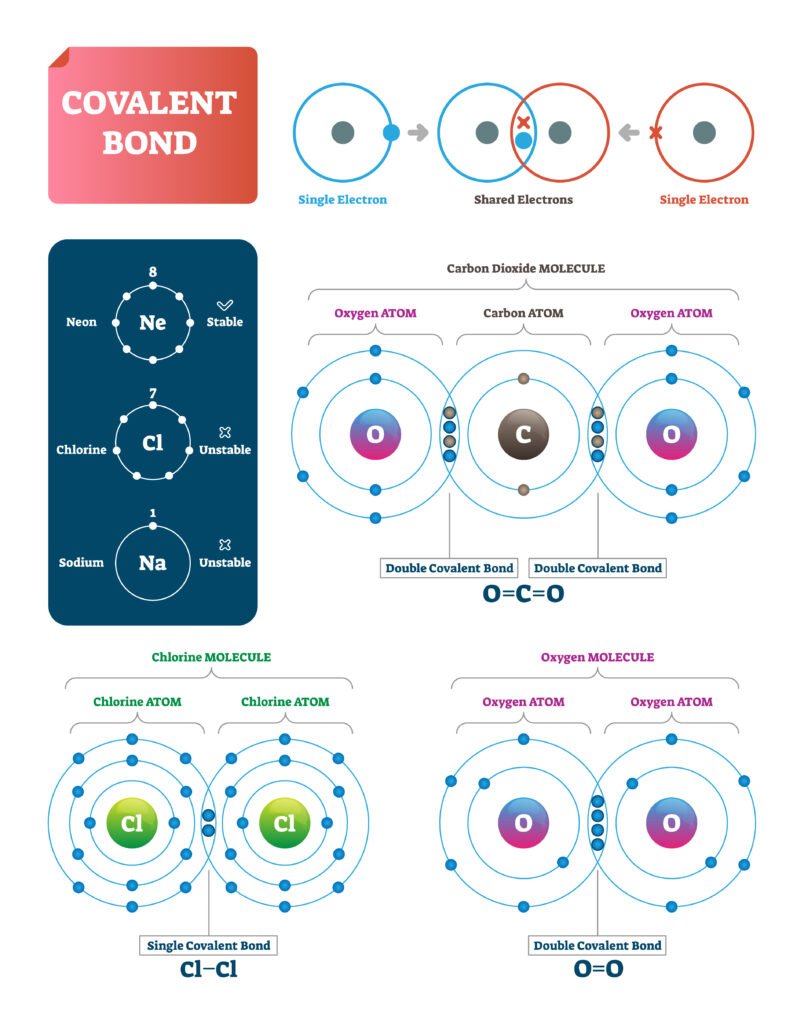

🔵 प्रकार:
एकल बन्ध (H–H)
द्वि बन्ध (O=O)
त्रि बन्ध (N≡N)

🟢 लुईस संरचना
📍 किसी अणु में इलेक्ट्रॉनों के संयोजन को बिन्दुओं और रेखाओं से दिखाने की विधि।
✔ बन्ध बनाने वाले इलेक्ट्रॉनों को बिन्दु या रेखा से प्रदर्शित किया जाता है।

🔴 संयोजकता एवं संयोजक इलेक्ट्रॉन
✏ किसी तत्व की संयोजकता उसकी बाहरी कोशिका में इलेक्ट्रॉनों की संख्या पर आधारित होती है।
📌 उदाहरण:
H (संयोजकता 1),
O (संयोजकता 2),
N (संयोजकता 3)।
🟡 VSEPR सिद्धान्त (संयोजक परत इलेक्ट्रॉन युग्म प्रतिकर्षण सिद्धान्त)
📍 अणु का आकार बाहरी परत के इलेक्ट्रॉन युग्मों के बीच प्रतिकर्षण से निर्धारित होता है।
✨ मुख्य विचार:
इलेक्ट्रॉन युग्म एक-दूसरे को अधिकतम दूरी पर रखते हैं।
✔ उदाहरण:
BeCl₂ → रैखिक (180°)
BF₃ → त्रिकोणीय समतलीय (120°)
CH₄ → चतुष्फलकीय (109.5°)
NH₃ → त्रिकोणीय पिरामिडल (107°)
H₂O → वक्राकार (104.5°)
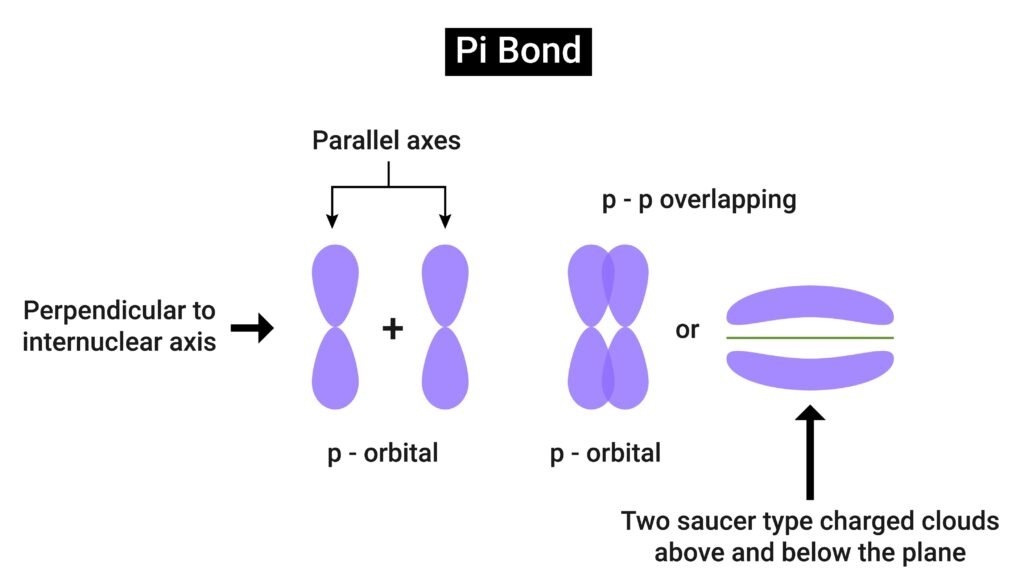
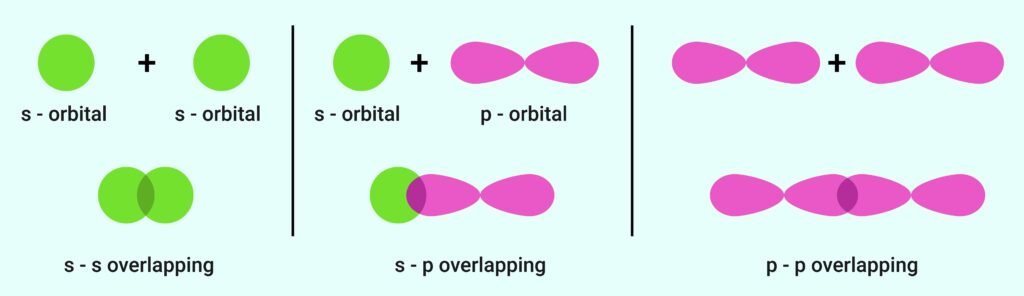
🔵 संयोजक बन्ध सिद्धान्त
📍 सहसंयोजक बन्ध का निर्माण आच्छादन (overlap) से होता है।
👉 प्रकार:
सिग्मा (σ) बन्ध – सीधा आच्छादन।
पाई (π) बन्ध – पार्श्व आच्छादन।

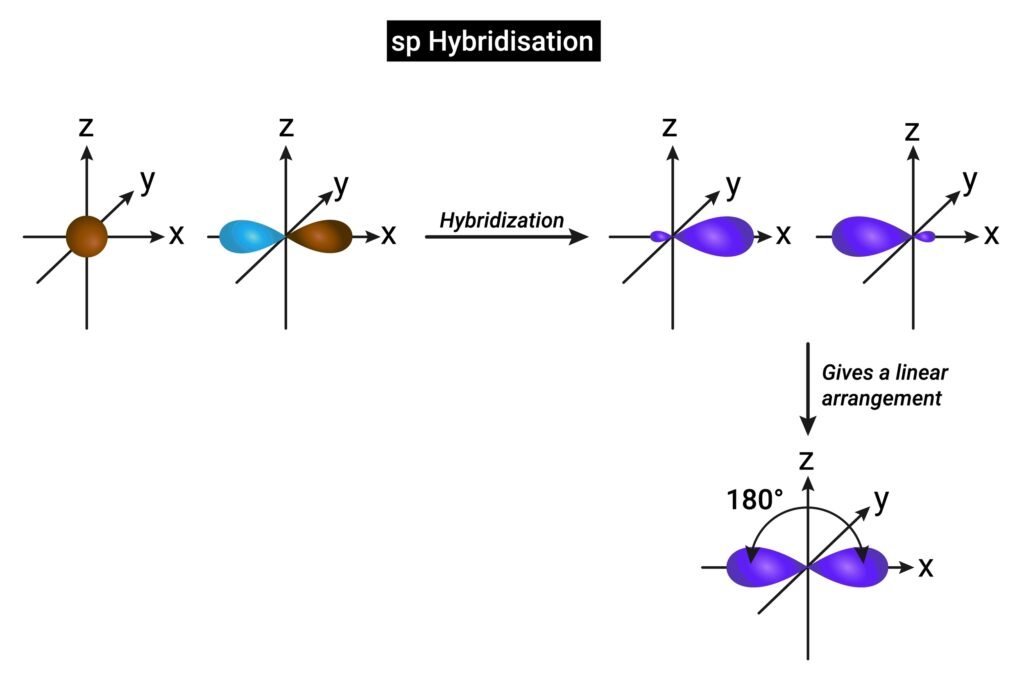
🟢 संकरण (Hybridisation)
📍 परिभाषा: समान ऊर्जा वाले परमाण्विक कक्षकों का आपस में मिश्रण होकर नए संकरित कक्षक बनाना।
✨ प्रकार और उदाहरण:
sp (BeCl₂ → रैखिक)
sp² (BF₃ → त्रिकोणीय समतलीय)
sp³ (CH₄ → चतुष्फलकीय)

sp³d (PCl₅ → त्रिकोणीय द्विबन्ध पिरामिडल)
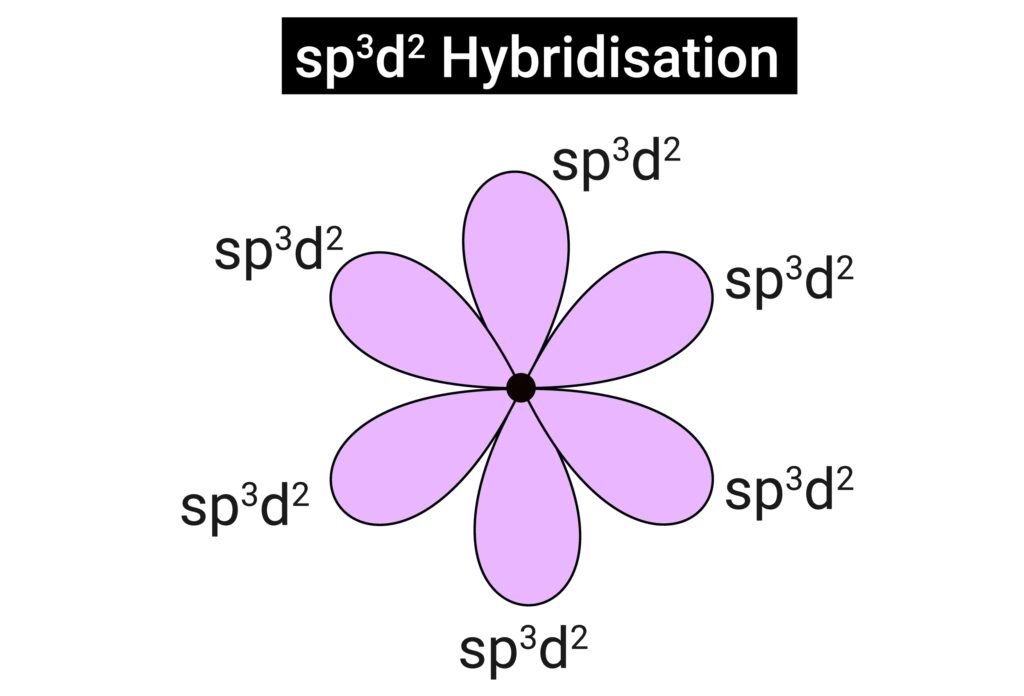
sp³d² (SF₆ → अष्टफलीय)
🔴 आणविक कक्षक सिद्धान्त (Molecular Orbital Theory)
📍 परमाण्विक कक्षकों के रैखिक संयोजन से आणविक कक्षक बनते हैं।
📌 मुख्य बिन्दु:
बन्धकारी और प्रतिबन्धकारी कक्षक।
इलेक्ट्रॉन बन्धकारी कक्षक में अधिक और प्रतिबन्धकारी में कम होने पर अणु स्थिर।
📍 बन्ध क्रम:
n = (Nb – Na)/2
जहाँ Nb = बन्धकारी इलेक्ट्रॉनों की संख्या, Na = प्रतिबन्धकारी इलेक्ट्रॉनों की संख्या।
✔ यदि बन्ध क्रम = 0 → अणु अस्थिर।
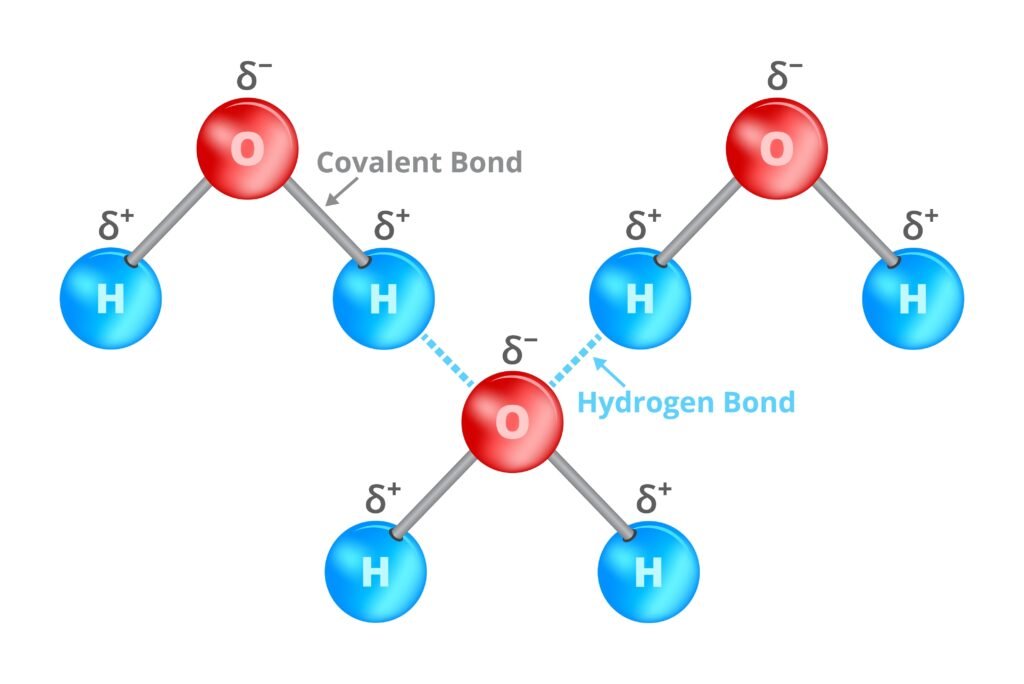
🟡 हाइड्रोजन बन्धन
📍 अत्यधिक विद्युतऋणात्मक परमाणु (N, O, F) से जुड़े H परमाणु और निकटवर्ती अणु के अकेले इलेक्ट्रॉन युग्म के बीच आकर्षण।
✨ उदाहरण: H₂O, HF, NH₃।
✔ यह उबालांक, घुलनशीलता और भौतिक गुणों को प्रभावित करता है।
🔵 महत्त्व
✔ रासायनिक बन्धन से अणुओं की संरचना समझी जाती है।
✔ यह यौगिकों के गुणधर्म और अभिक्रियाशीलता का आधार है।
✔ अणु संरचना से पदार्थ की आकृति, ऊर्जा और भौतिक गुण निर्धारित होते हैं।
🔹 II. पाठ सारांश
📌 परमाणु स्थायित्व के लिए इलेक्ट्रॉनों का आदान-प्रदान या साझेदारी करते हैं।
📌 आयनिक बन्धन में इलेक्ट्रॉनों का पूर्ण स्थानान्तरण होता है, जैसे NaCl।
📌 सहसंयोजक बन्धन में इलेक्ट्रॉनों की साझेदारी होती है, जैसे H₂, O₂, CH₄।
📌 VSEPR सिद्धान्त अणु का आकार निर्धारित करता है।
📌 संयोजक बन्ध सिद्धान्त σ और π बन्ध की व्याख्या करता है।
📌 संकरण द्वारा sp, sp², sp³ इत्यादि कक्षक निर्मित होते हैं।
📌 आणविक कक्षक सिद्धान्त बन्ध क्रम और चुंबकीय गुण समझाता है।
📌 हाइड्रोजन बन्धन विशेष भौतिक गुण उत्पन्न करता है।
📌 रासायनिक बन्धन और अणु संरचना सम्पूर्ण रसायन विज्ञान के लिए आधारभूत हैं।
🔹 III. त्वरित पुनरावलोकन
📝
✔ परमाणु स्थायित्व हेतु बन्ध बनाते हैं।
✔ आयनिक बन्धन = इलेक्ट्रॉन स्थानान्तरण, सहसंयोजक बन्धन = इलेक्ट्रॉन साझेदारी।
✔ VSEPR सिद्धान्त अणु का आकार बताता है।
✔ संकरण से नए कक्षक बनते हैं।
✔ आणविक कक्षक सिद्धान्त से बन्ध क्रम और चुंबकीय गुण ज्ञात होते हैं।
✔ हाइड्रोजन बन्धन भौतिक गुण प्रभावित करता है।
————————————————————————————————————————————————————————————————————————————
पाठ्यपुस्त के प्रश्न
❓ 4.1 रासायनिक आबंध (Chemical bond) के बनने को व्याख्यायित कीजिए।
✅ उत्तर
स्थायित्व का सिद्धान्त: परमाणु कम ऊर्जा, अधिक स्थिरता और सामान्यतः अक्रिय गैस-जैसी विन्यास (ऑक्टेट/डुएट) पाने के लिए एक-दूसरे के साथ परस्पर क्रिया करते हैं।
आबंध बनने के प्रकार व कारण:
आयनिक आबंध: एक परमाणु इलेक्ट्रॉन छोड़कर धनायन तथा दूसरा ग्रहण कर ऋणायन बनाता है; विपरीत आवेशों के बीच कूलॉम्बीय आकर्षण से जालक बनता है (उदा. NaCl)।
सहसंयोजक आबंध: दो परमाणु इलेक्ट्रॉन-युग्म साझा करते हैं ताकि दोनों का बाह्य आवरण पूर्ण हो (उदा. H₂, O₂, H₂O)।
धात्विक आबंध: धात्विक जालक में विविलासी (delocalised) इलेक्ट्रॉनों का सागर धातु-कैटायनों को बाँधता है।
सैद्धान्तिक आधार:
VBT/हाइब्रिडीकरण: उपयुक्त ओरियेन्टेशन वाले ऑर्बिटल्स का ओवरलैप → सिग्मा/पाई बन्ध; हाइब्रिडीकरण से आकृतियाँ समझ आती हैं।
MOT: बन्ध तभी स्थिर जब बन्धनकारी MO में इलेक्ट्रॉन की संख्या प्रतिबन्धकारी MO से अधिक हो (बन्ध क्रम > 0)।
❓ 4.2 निम्न तत्वों के समवायों (valence shells) के ल्यूइस बिन्दु-प्रतीक लिखिए— Mg, Na, B, O, N, Br.
✅ उत्तर
Na: 1 बिन्दु (ns¹) → Na·
Mg: 2 बिन्दु → ·Mg·
B: 3 बिन्दु → B···
O: 6 बिन्दु → ··O·· (चारों ओर 6)
N: 5 बिन्दु → ·N···
Br: 7 बिन्दु → :Br:· (तीन युग्म + 1 अकेला)
❓ 4.3 निम्न परमाणुओं तथा आयनों के ल्यूइस बिन्दु-प्रतीक लिखिए— S व S²⁻; Al व Al³⁺; H व H⁻.
✅ उत्तर
S: 6 बिन्दु (··S··) ; S²⁻: 8 बिन्दु (पूर्ण ऑक्टेट) [ :S: ]²⁻
Al: 3 बिन्दु (Al···) ; Al³⁺: ऑक्टेट प्राप्त कर लेता है, बाह्य बिन्दु शून्य, लिखते हैं [Al]³⁺ (कोई डॉट नहीं)।
H: 1 बिन्दु (H·) ; H⁻: डुएट [H:]⁻ (2 इलेक्ट्रॉन)।
❓ 4.4 निम्न अणुओं/आयनों के ल्यूइस संरचना-चित्र बनाइए— H₂S, SiCl₄, BeF₂, CO₃²⁻, HCOOH.
✅ उत्तर
H₂S: S केंद्र में; दो S–H एकल बन्ध, S पर 2 एकाकी युग्म (ल्यूइस: H–S(: :)–H)।
SiCl₄: Si केंद्र में 4 Si–Cl एकल बन्ध; हर Cl पर 3 एकाकी युग्म; Si का ऑक्टेट पूर्ण।
BeF₂: Be केंद्र में 2 Be–F एकल बन्ध; Be का अपूर्ण ऑक्टेट (4 e⁻); प्रत्येक F पर 3 एकाकी युग्म; वास्तविक ज्यामिति रैखिक।
CO₃²⁻ (कार्बोनेट): तीन समतुल्य अनुनादी संरचनाएँ— किसी एक में C=O और दो C–O⁻; औसत बन्ध-क्रम = 4/3; सभी C–O लंबाइयाँ समान।
HCOOH (फॉर्मिक अम्ल): H–C(=O)–O–H; कार्बोनिल O पर कोई आवेश नहीं, हाइड्रॉक्सिल O पर दो एकाकी युग्म; सभी परमाणुओं का ऑक्टेट पूर्ण।
❓ 4.5 ऑक्टेट नियम परिभाषित कीजिए; महत्व व सीमाएँ लिखिए।
✅ उत्तर
परिभाषा: परमाणु बन्ध बनाते हैं ताकि बाह्य कोश में प्रायः 8 इलेक्ट्रॉन (या H/He के लिए 2) हो जाएँ।
महत्व: आयनिक/सहसंयोजक आबंधन की प्रवृत्ति, बहुसंयोजकता व यौगिक बनने का सामान्य कारण स्पष्ट।
सीमाएँ:
अपूरित ऑक्टेट: BF₃, BeCl₂ आदि।
विस्तारित ऑक्टेट: PF₅, SF₆, H₂SO₄ आदि (d-ऑर्बिटल भागीदारी)।
विषम-इलेक्ट्रॉन अणु: NO, NO₂।
बन्ध-ऊर्जा, आकृति, चुंबकत्व, सापेक्ष स्थिरता की परिमाणात्मक व्याख्या नहीं करता।
❓ 4.6 आयनिक आबंध बनने के अनुकूल कारक लिखिए।
✅ उत्तर
धातु की आयनन एन्थैल्पी कम (इलेक्ट्रॉन छोड़ना सरल)
अधातु की इलेक्ट्रॉन-ग्रहण एन्थैल्पी अधिक ऋणात्मक
विद्युतऋणात्मकता का बड़ा अन्तर
लैटिस एन्थैल्पी अधिक (जालक बनते समय ऊर्जा अधिक निकलती है)
जलीय माध्यम में उच्च जलयोजन एन्थैल्पी
छोटा कैटायन, बड़ा एनायन → आयनिक आकर्षण अनुकूल।
❓ 4.7 VSEPR मॉडल से निम्न अणुओं की आकृति व बन्ध कोण का वर्णन करें— BeCl₂, BCl₃, SiCl₄, AsF₅, H₂S, PH₃.
✅ उत्तर
BeCl₂ (AX₂, LP=0): रैखिक, 180°।
BCl₃ (AX₃, LP=0): त्रिकोणीय समतलीय, 120°।
SiCl₄ (AX₄, LP=0): चतुर्घात (tetrahedral), 109.5°।
AsF₅ (AX₅, LP=0): त्रिकोणीय द्विपिरैमिड (TBP), 90° (equatorial–axial) व 120° (equatorial)।
H₂S (AX₂, LP=2): वक्र (bent); दो एकाकी युग्मों के कारण कोण लगभग 92–95° (H₂O से भी कम, क्योंकि S की हाइब्रिडीकरण प्रवृत्ति कम)।
PH₃ (AX₃, LP=1): त्रिकोणीय पिरैमिडल, कोण ~ 93–94° (NH₃ से कम; p-चरित्र अधिक, LP–BP प्रतिकर्ष कम)।
❓ 4.8 यद्यपि NH₃ तथा H₂O दोनों का इलेक्ट्रॉन-युग्म ज्यामिति चतुर्घात है, फिर भी H₂O का बन्ध कोण NH₃ से कम क्यों है?
✅ उत्तर
H₂O में 2 एकाकी युग्म (LP–LP) प्रतिकर्ष सबसे प्रबल → H–O–H कोण ~104.5°।
NH₃ में 1 एकाकी युग्म (LP–BP) प्रतिकर्ष → H–N–H कोण ~107°।
अतः अधिक LP–LP संपीड़न और O की उच्च विद्युतऋणात्मकता के कारण H₂O का कोण छोटा है।
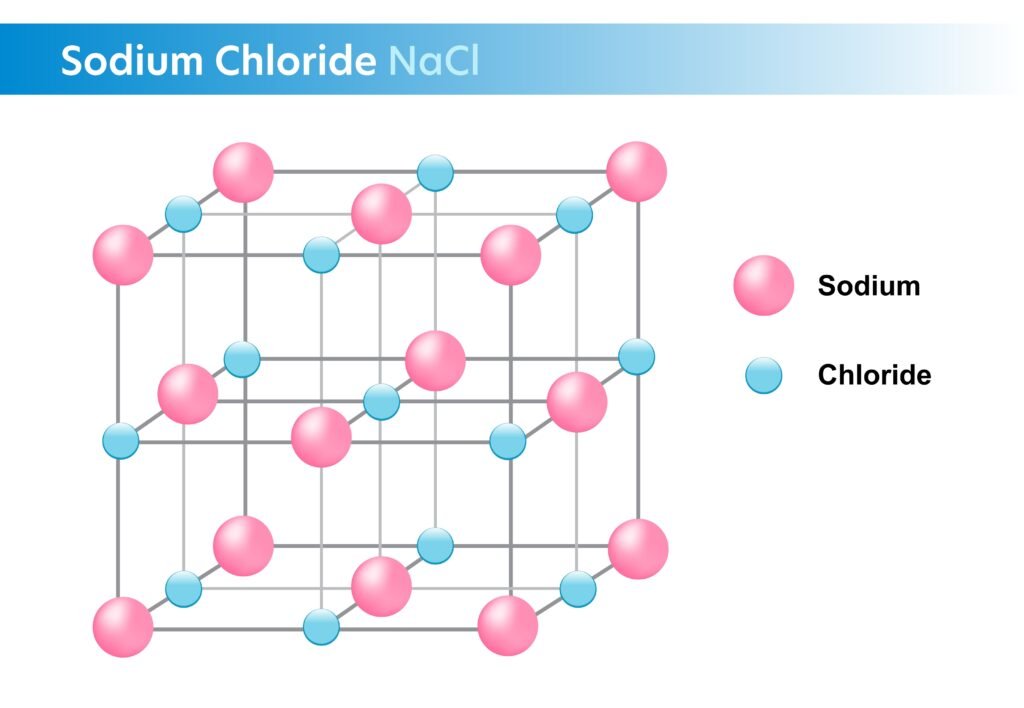
❓ 4.9 आयनिक आबंध को आयन-युग्म के रूप में आप कैसे प्रदर्शित करेंगे?
✅ उत्तर
ल्यूइस-स्थानान्तरण दिखाकर:
Na· + :Cl: → [Na]⁺ [ :Cl: ]⁻
वर्ग कोष्ठक में आयन, उन पर आवेश तथा पूर्ण ऑक्टेट/डुएट; अनेक आयनों के संगठित होने पर आयनी जालक (ionic lattice) का निर्माण दर्शाएँ (उदा. NaCl क्रिस्टल)।
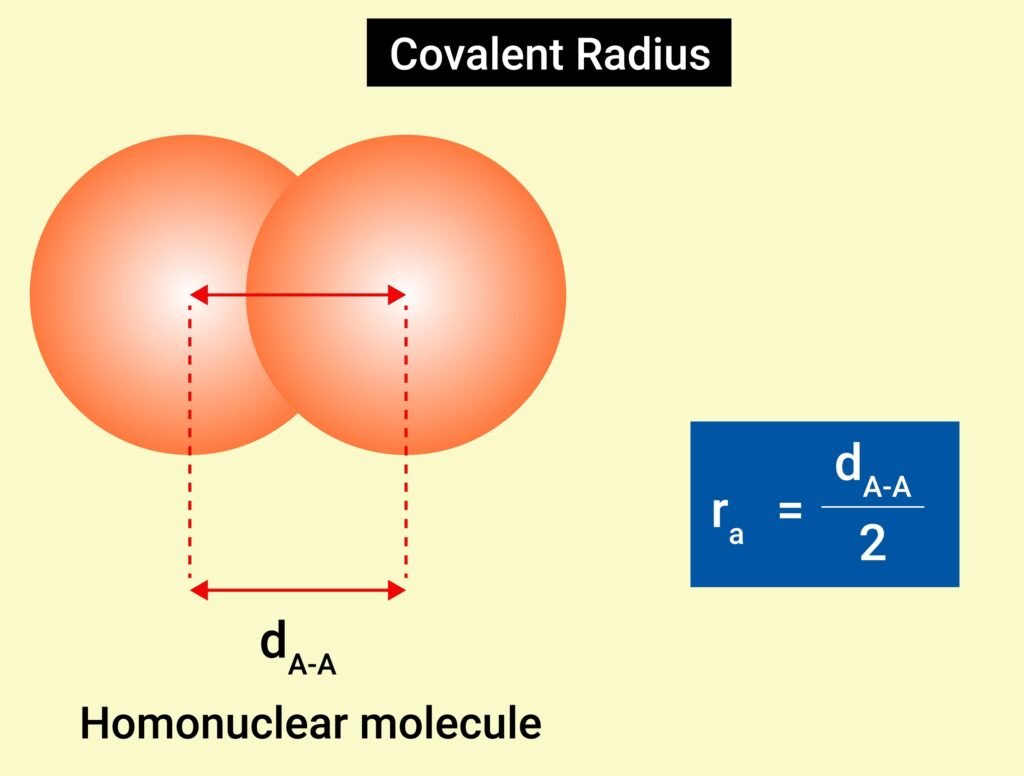
❓ 4.10 बन्ध-लम्बाई (Bond length) को परिभाषित कीजिए।
✅ उत्तर
किसी बन्धित अणु में संयोजित दो नाभियों के बीच औसत संतुलित दूरी; यह उस बन्ध की न्यूनतम ऊर्जा स्थिति पर मापी जाती है। इकाई: pm। यह बन्ध-क्रम (अधिक → छोटी), आकार, विद्युतऋणात्मकता आदि पर निर्भर करती है।
❓ 4.11 CO₃²⁻ आयन के संदर्भ में अनुनाद (resonance) की अवधारणा स्पष्ट कीजिए।
✅ उत्तर
CO₃²⁻ हेतु 3 समतुल्य संरचनाएँ: एक में C=O तथा दो C–O⁻; ये कैनॉनिकल रूप हैं।
वास्तविक प्रजाति अनुनाद-हाइब्रिड है: सभी C–O समान, आंशिक द्वि-आबंध चरित्र; वितरित ऋण आवेश स्थिरीकरण देता है; औसत बन्ध-क्रम 4/3।
❓ 4.12 नीचे दी गई दो संरचनाओं (1) एवं (2) द्वारा H₃PO₃ को दर्शाया गया है। क्या ये दोनों संरचनाएँ H₃PO₃ के अनुनादी कैनॉनिकल रूप मानी जा सकती हैं? यदि नहीं, कारण बताइए।
✅ उत्तर
नहीं। अनुनाद में परमाणुओं की स्थानेष्ठिति समान रहती है, केवल इलेक्ट्रॉनों का वितरण बदलता है।
चित्र (1) व (2) में P–H और P–OH समूहों की स्थिति/जुड़ाव बदल रहा है—यह टॉटोमेरी/रचना-भेद है, अनुनाद नहीं। वास्तविक H₃PO₃ संरचना में एक P–H और दो P–OH समूह होते हैं।
❓ 4.13 SO₃, NO₂, NO₃⁻ के अनुनाद-संरचनाएँ लिखिए/वर्णित कीजिए।
✅ उत्तर
SO₃: तीन समतुल्य रूप—हर एक में एक S=O तथा दो S–O (आंशिक ऋण आवेश); वास्तविक रूप में सभी S–O समान (π-इलेक्ट्रॉन का विकेंद्रीकरण)।
NO₂ (विषम-इलेक्ट्रॉन): दो मुख्य रूप—N=O बायें/दायें; एक अनयुग्मी इलेक्ट्रॉन N/O पर विभाजित; विकेन्द्रित π-प्रणाली।
NO₃⁻: CO₃²⁻ की तरह तीन समरूप कैनॉनिकल रूप; औसत बन्ध-क्रम 4/3; सभी N–O लंबाइयाँ समान।
❓ 4.14 ल्यूइस चिह्न से इलेक्ट्रॉन-स्थानान्तरण दिखाकर निम्न युग्मों से बने आयनिक यौगिक बताइए—
(क) K तथा S (ख) Ca तथा O (ग) Al तथा N
✅ उत्तर
(क) K + S: K· → K⁺ (1e⁻ छोड़ता), :S: + 2e⁻ → [S]²⁻; यौगिक: K₂S।
(ख) Ca + O: ·Ca· → Ca²⁺ (2e⁻ छोड़ता), :O: + 2e⁻ → [O]²⁻; यौगिक: CaO।
(ग) Al + N: Al··· → Al³⁺ (3e⁻ छोड़ता), :N: + 3e⁻ → [N]³⁻; यौगिक: AlN।
🔵 प्रश्न 4.14:
निम्नलिखित परमाणुओं से इलेक्ट्रॉनों द्वारा धनायनों तथा ऋणायनों में विघटन को ल्यूइस बिन्दु-प्रतीकों के सहारे से स्पष्ट कीजिए —
(क) K तथा S (ख) Ca तथा O (ग) Al तथा N
🟢 उत्तर:
✳ ल्यूइस बिन्दु-प्रतीक का प्रयोग करके इलेक्ट्रॉनों के हस्तांतरण द्वारा आयन बनते हैं।
(क)
K → 1 इलेक्ट्रॉन देता है → K⁺
S → 2 इलेक्ट्रॉन ग्रहण करता है → S²⁻
➡ यौगिक: K₂S
(ख)
Ca → 2 इलेक्ट्रॉन देता है → Ca²⁺
O → 2 इलेक्ट्रॉन ग्रहण करता है → O²⁻
➡ यौगिक: CaO
(ग)
Al → 3 इलेक्ट्रॉन देता है → Al³⁺
N → 3 इलेक्ट्रॉन ग्रहण करता है → N³⁻
➡ यौगिक: AlN
✔ इस प्रकार आयनिक आबंध इलेक्ट्रॉनों के स्थानांतरण से बनते हैं।
🔵 प्रश्न 4.15:
धातु (K) तथा अधातु (S) के मध्य आयनिक आबंध के निर्माण की व्याख्या कीजिए।
🟢 उत्तर:
➡ पोटैशियम (K) की संयोजकता 1 है तथा सल्फर (S) की संयोजकता 2 है।
➡ K परमाणु एक इलेक्ट्रॉन खोकर K⁺ बनाता है, S दो इलेक्ट्रॉन ग्रहण कर S²⁻ बनाता है।
➡ दो K परमाणु एक S परमाणु को इलेक्ट्रॉन देते हैं।
✳ आयनों के बीच विद्युत आकर्षण के कारण आयनिक आबंध बनता है।
✔ यौगिक: K₂S
🔵 प्रश्न 4.16:
विद्युत-ऋणात्मकता के महत्वपूर्ण अनुप्रयोग बताइए।
🟢 उत्तर:
विद्युत-ऋणात्मकता के मुख्य अनुप्रयोग —
1️⃣ आबंध के प्रकार का निर्धारण (आयोनिक या सहसंयोजक)
2️⃣ अणु में ध्रुवीयता का निर्धारण
3️⃣ प्रतिक्रिया की दिशा की भविष्यवाणी
4️⃣ बन्धन ऊर्जा का अनुमान
5️⃣ अभिक्रियाशीलता का आकलन
🔵 प्रश्न 4.17:
विद्युत-ऋणात्मकता को परिभाषित कीजिए तथा यह परमाणु संख्या से किस प्रकार निर्भर है?
🟢 उत्तर:
✳ परिभाषा: किसी अणु में एक परमाणु की वह प्रवृत्ति जिससे वह बन्ध में साझा इलेक्ट्रॉनों को अपनी ओर आकर्षित करता है, विद्युत-ऋणात्मकता कहलाती है।
📉 परमाणु संख्या बढ़ने पर, नाभिकीय आवेश बढ़ता है, परिणामस्वरूप परास घटता है, इसलिए विद्युत-ऋणात्मकता बढ़ती है (एक ही आवर्त में)।
🔵 प्रश्न 4.18:
इलेक्ट्रॉन-संयोजक आयनों के आप आकार की तुलना कीजिए।
🟢 उत्तर:
आयनिक आकार का क्रम:
✔ कैटायन (धनायन) < मूल परमाणु < एनायन (ऋणायन)
क्योंकि इलेक्ट्रॉन हटाने से परास घटता है और इलेक्ट्रॉन जोड़ने से परास बढ़ता है।
🔵 प्रश्न 4.19:
निम्नलिखित आयनों के आकार की तुलना कीजिए —
Li⁺, K⁺, Na⁺, SO₄²⁻, Cl⁻, Ar
🟢 उत्तर:
➡ कैटायनों में: Li⁺ < Na⁺ < K⁺ (क्योंकि n-shell बढ़ती है)
➡ एनायनों में: Ar < Cl⁻ < SO₄²⁻ (अधिक इलेक्ट्रॉनों के कारण प्रतिकर्षण बढ़ता है)
🔵 प्रश्न 4.20:
CH₃COOH को नीचे दी गई बन्ध-संरचना सही है, परंतु कुछ अन्य गुणधर्म इसके भिन्न हैं। इस विसंगति का कारण बताइए और सही ल्यूइस-संरचना लिखिए।
🟢 उत्तर:
➡ दी गई संरचना में C=O और O-H समूह सही हैं।
➡ परंतु इलेक्ट्रॉन युग्मों का सही वितरण हेतु अनुनाद की आवश्यकता है।
✔ अनुनाद रूप:
O=C–O–H ↔ ⁻O–C=O–H
➡ वास्तविक संरचना इन दोनों का औसत होती है।
🔵 प्रश्न 4.21:
चक्रीय यौगिकों के अतिरिक्त CH₂ समूह के एक या अधिक संयुग्मक यौगिकों का उदाहरण दीजिए जिसमें σ व π आबंध हों।
🟢 उत्तर:
➡ एथिलीन (C₂H₄) में C=C द्वि-आबंध होता है।
➡ एक σ और एक π आबंध।
✔ इस प्रकार C₂H₄ में दोनों प्रकार के आबंध उपस्थित हैं।
🔵 प्रश्न 4.22:
BeH₂ अणु में बन्ध कोण 180° है, इसकी व्याख्या कीजिए।
🟢 उत्तर:
➡ Be के पास 2 संयोजक इलेक्ट्रॉन हैं।
➡ दो σ आबंध बनाने के बाद कोई अकेला युग्म नहीं रहता।
➡ VSEPR सिद्धांत अनुसार दो बन्ध युग्म अधिकतम दूरी पर होंगे।
✔ इस कारण रैखिक आकृति व 180° कोण बनता है।
🔵 प्रश्न 4.23:
NH₃ अणु में N के चार युग्म हैं, परंतु बन्ध कोण 107° क्यों होता है?
🟢 उत्तर:
➡ NH₃ में 3 σ-बन्ध युग्म + 1 अकेला युग्म होता है।
➡ अकेला युग्म-बन्ध युग्म प्रतिकर्षण अधिक होता है।
➡ आदर्श चतुर्भुज कोण 109.5° घटकर 107° हो जाता है।
🔵 प्रश्न 4.24:
sp, sp² तथा sp³ संकरण का उदाहरण सहित वर्णन कीजिए।
🟢 उत्तर:
✳ sp संकरण: BeCl₂ (रैखिक आकृति, 180°)
✳ sp² संकरण: BF₃ (त्रिकोणीय समतलीय, 120°)
✳ sp³ संकरण: CH₄ (चतुर्भुज, 109.5°)
🔵 प्रश्न 4.25:
AlCl₃ + Cl⁻ → AlCl₄⁻ में किस प्रकार का आबंध बनता है?
🟢 उत्तर:
➡ Cl⁻ अपना अकेला युग्म Al को देता है।
✔ निर्देशित सहसंयोजक आबंध (Coordinate bond) बनता है।
🔵 प्रश्न 4.26:
BF₃ + NH₃ → F₃B←NH₃ में B और N के संकरण अवस्था में क्या परिवर्तन होता है?
🟢 उत्तर:
➡ BF₃ में B की संकरण अवस्था sp² → AlCl₄⁻ में sp³ हो जाती है।
➡ NH₃ में N की संकरण अवस्था sp³ रहती है।
🔵 प्रश्न 4.27:
C₂H₂ अणु में कार्बन परमाणुओं के बीच कितने σ और π आबंध होते हैं?
🟢 उत्तर:
➡ C≡C में 1 σ + 2 π
➡ प्रत्येक C-H में 1 σ
✔ कुल σ = 3, π = 2
🔵 प्रश्न 4.28: निम्नलिखित यौगिकों में सिग्मा (σ) तथा पाई (π) आबंधों की कुल संख्या कितनी है?
(क) C₂H₂ (ख) C₂H₄
🟢 उत्तर:
✳ C₂H₂ (एथाइन):
➡ संरचना: H–C≡C–H
➡ प्रत्येक C परमाणु दूसरे C से 3 आबंध बनाता है — 1 σ + 2 π
➡ दो C–H आबंध भी हैं (प्रत्येक σ)।
✔ कुल σ आबंध = 3 (1 C–C + 2 C–H)
✔ कुल π आबंध = 2
➡ उत्तर: σ = 3, π = 2
✳ C₂H₄ (एथीन):
➡ संरचना: H₂C=CH₂
➡ प्रत्येक C–C आबंध = 1 σ + 1 π
➡ प्रत्येक C–H आबंध = σ
✔ कुल σ आबंध = 5 (1 C–C + 4 C–H)
✔ कुल π आबंध = 1
➡ उत्तर: σ = 5, π = 1
🔵 प्रश्न 4.29: X-अक्ष के साथ ओवरलैपिंग को ध्यान में रखते हुए बताइए कि निम्नलिखित में से कौन से सिग्मा (σ) आबंध नहीं बनाएंगे और क्यों?
(क) 1s तथा 1s
(ख) 1s तथा 2pₓ
(ग) 2pₓ तथा 2pᵧ
(घ) 1s तथा 2s
🟢 उत्तर:
✔ सिग्मा (σ) आबंध अन्तः-अक्षीय (end-on) ओवरलैपिंग से बनते हैं।
➡ (क) 1s–1s = संभव (दोनों गोलाकार कक्षाएँ)
➡ (ख) 1s–2pₓ = संभव (2pₓ का अक्ष X पर है)
➡ (ग) 2pₓ–2pᵧ ❌ असंभव क्योंकि दोनों अक्ष पर नहीं हैं, परस्पर लंबवत हैं
➡ (घ) 1s–2s = संभव (दोनों गोलाकार कक्षाएँ हैं)
✔ उत्तर: (ग) 2pₓ तथा 2pᵧ सिग्मा आबंध नहीं बनाएंगे क्योंकि उनकी ओवरलैपिंग अक्षीय नहीं है।
🔵 प्रश्न 4.30: निम्नलिखित अणुओं में बनने वाले परमाणु कक्षकों के संकरण प्रकार कौन से हैं?
(क) CH₃–CH₃ (ख) CH₂=CH₂ (ग) CH≡CH (घ) CH₃COOH
🟢 उत्तर:
✳ (क) CH₃–CH₃ (एथेन):
प्रत्येक C चार एकल σ आबंध बनाता है → sp³ संकरण
✳ (ख) CH₂=CH₂ (एथीन):
प्रत्येक C तीन σ व एक π आबंध → sp² संकरण
✳ (ग) CH≡CH (एथाइन):
प्रत्येक C दो σ व दो π आबंध → sp संकरण
✳ (घ) CH₃COOH (एसीटिक अम्ल):
➡ मिथाइल C = sp³
➡ कार्बोनिल C = sp²
➡ O (हाइड्रॉक्सिल) = sp³
✔ उत्तर:
CH₃–CH₃ → sp³
CH₂=CH₂ → sp²
CH≡CH → sp
CH₃COOH → मिश्रित (sp³ + sp²)
🔵 प्रश्न 4.31: हाइब्रिड कक्षा के आणविक समूह तथा एकलौती समूह से आप क्या समझते हैं? उदाहरण सहित स्पष्ट कीजिए।
🟢 उत्तर:
✳ आणविक समूह (Bond pair):
➡ दो परमाणुओं के बीच साझा इलेक्ट्रॉन युग्म।
➡ उदाहरण: H–O–H में प्रत्येक O–H बंध में एक आणविक समूह है।
✳ एकलौती समूह (Lone pair):
➡ वे इलेक्ट्रॉन युग्म जो साझा नहीं होते।
➡ उदाहरण: H₂O में O पर दो एकलौती समूह हैं।
✔ महत्व: आणविक व एकलौती समूह अणु की आकृति को निर्धारित करते हैं (VSEPR सिद्धांत)।
🔵 प्रश्न 4.32: सिग्मा तथा पाई आबंधों में अंतर स्पष्ट कीजिए।
🟢 उत्तर:
विशेषता σ आबंध π आबंध
निर्माण अंतः-अक्षीय ओवरलैप पार्श्व ओवरलैप
शक्ति अधिक कम
घूमने की स्वतंत्रता संभव असंभव
उदाहरण H–H, C–C C=C में दूसरा आबंध
✔ उत्तर: σ आबंध अधिक मजबूत व स्थायी होता है, जबकि π आबंध अतिरिक्त स्थिरता देता है।
🔵 प्रश्न 4.33: संयोजक आबंध सिद्धांत के आधार पर H₂ अणु के गठन की व्याख्या कीजिए।
🟢 उत्तर:
➡ प्रत्येक H परमाणु का इलेक्ट्रॉन 1s कक्षा में होता है।
➡ दो 1s कक्षाओं का अन्तः-अक्षीय ओवरलैप → बंध बनता है।
➡ बने बंध में इलेक्ट्रॉन जोड़ी का घनत्व दोनों नाभिकों के बीच केंद्रित होता है।
✔ परिणाम: H–H σ आबंध बनता है और अणु स्थिर होता है।
🔵 प्रश्न 4.34: परमाणु कक्षकों के सैद्धांतिक संयोजन से आणविक कक्षकों का निर्माण किस प्रकार होता है? आवश्यक शर्तें बताइए।
🟢 उत्तर:
➡ संयोजक कक्षक सिद्धांत (MOT): दो परमाणु कक्षक मिलकर दो आणविक कक्षक बनाते हैं —
बंधनकारी (Bonding MO)
प्रतिबंधनकारी (Antibonding MO)
➡ शर्तें:
1️⃣ ऊर्जा लगभग समान हो
2️⃣ समान सममिति हो
3️⃣ पर्याप्त ओवरलैप हो
✔ परिणाम: स्थिरता तब होती है जब बंधनकारी MO में इलेक्ट्रॉन अधिक हों।
🔵 प्रश्न 4.35: आणविक कक्षक सिद्धांत के आधार पर समझाइए कि Be₂ अणु अस्तित्व में क्यों नहीं होता।
🟢 उत्तर:
➡ Be (Z = 4): विन्यास = 1s² 2s²
➡ दो Be से कुल 8 इलेक्ट्रॉन →
MO भराव: (σ1s)² (σ1s)² (σ2s)² (σ2s)²
➡ बंधनकारी = 4, प्रतिबंधनकारी = 4
➡ बंधन क्रम = ½(4–4) = 0
✔ उत्तर: बंधन क्रम शून्य ⇒ Be₂ अस्थिर, अस्तित्व में नहीं होता।
🔵 प्रश्न 4.36: निम्नलिखित यौगिकों के आणविक स्थायित्व की तुलना करें तथा उनके चुम्बकीय गुण ज्ञात करें—
O₂, O₂⁺, O₂⁻ (सुपरऑक्साइड), O₂²⁻ (पेरॉक्साइड)
🟢 उत्तर:
➡ MO विन्यास:
O₂ = (σ1s)²(σ1s)²(σ2s)²(σ2s)²(σ2p_z)²(π2p_x=π2p_y)⁴(π2p_x=π2p_y)²
✔ O₂ → बंधन क्रम = 2, 2 अपविकारी इलेक्ट्रॉन → पैरामैग्नेटिक
✔ O₂⁺ → 1 e⁻ कम → बंधन क्रम 2.5 → अधिक स्थिर
✔ O₂⁻ → 1 e⁻ अधिक → बंधन क्रम 1.5 → कम स्थिर
✔ O₂²⁻ → 2 e⁻ अधिक → बंधन क्रम 1 → सबसे कम स्थिर
स्थायित्व क्रम: O₂⁺ > O₂ > O₂⁻ > O₂²⁻
चुम्बकीय गुण:
O₂, O₂⁺, O₂⁻ → पैरामैग्नेटिक
O₂²⁻ → डायामैग्नेटिक
————————————————————————————————————————————————————————————————————————————
अन्य महत्वपूर्ण प्रश्न
(CBSE MODEL प्रश्न पत्र)
सिर्फ इसी पाठ से निर्मित CBSE MODEL प्रश्न पत्र।
खंड A — बहुविकल्पीय प्रश्न (Q1–Q16, प्रत्येक 1 अंक)
प्रश्न 1. आयनिक बन्ध किसके बीच बनता है?
धातु–अधातु
धातु–धातु
अधातु–अधातु
समान विद्युत ऋणात्मकता वाले तत्त्व
Answer: 1
प्रश्न 2. सहसंयोजक बन्ध में इलेक्ट्रॉनों का क्या होता है?
पूर्ण हस्तांतरण
साझा करना
ह्रास
दान
Answer: 2
प्रश्न 3. NaCl में बन्ध का प्रकार है:
सहसंयोजक
आयनिक
सहसंयोजक + समन्वयक
धात्विक
Answer: 2
प्रश्न 4. NH₃ अणु का आकार क्या है?
चतुष्फलकीय
त्रिकोणीय समतलीय
त्रिकोणीय पिरामिडीय
रेखीय
Answer: 3
प्रश्न 5. BeCl₂ अणु का आकार क्या है?
रेखीय
चतुष्फलकीय
त्रिकोणीय
मुड़ा हुआ
Answer: 1
कथन–कारण हेतु विकल्प-कुंजी
कथन (A) एवं कारण (R) दोनों सत्य हैं तथा R, A का सही कारण है
कथन (A) एवं कारण (R) दोनों सत्य हैं परन्तु R, A का सही कारण नहीं
कथन (A) सत्य है परन्तु R असत्य
कथन (A) असत्य है परन्तु R सत्य
प्रश्न 6 (A/R).
कथन (A): आयनिक यौगिक ठोस अवस्था में विद्युत का चालक होते हैं।
कारण (R): इनमें आयन स्वतंत्र रूप से गति करते हैं।
Answer: 4
प्रश्न 7. O₂ अणु में बन्ध क्रम कितना है?
1
2
3
0
Answer: 2
प्रश्न 8. CO अणु का बन्ध क्रम कितना है?
2
2.5
3
3.5
Answer: 3
प्रश्न 9. H₂O अणु का आकार क्या है?
रेखीय
त्रिकोणीय
मुड़ा हुआ (V-आकार)
चतुष्फलकीय
Answer: 3
प्रश्न 10 (A/R).
कथन (A): NO₂ अणु वक्राकार (मुड़ा हुआ) होता है।
कारण (R): नाइट्रोजन पर अपूर्ण युग्म (lone pair) होता है।
Answer: 1
प्रश्न 11. VSEPR सिद्धान्त में बन्ध कोण किसके कारण बदलता है?
केवल बन्धन युग्म–बन्धन युग्म प्रतिकर्षण
केवल अपूर्ण युग्म–अपूर्ण युग्म प्रतिकर्षण
सभी युग्मों के आपसी प्रतिकर्षण
कोई नहीं
Answer: 3
प्रश्न 12. धात्विक बन्ध का सिद्धान्त किस पर आधारित है?
इलेक्ट्रॉनों का साझा करना
इलेक्ट्रॉनों का समुद्र
सहसंयोजक युग्म
हाइड्रोजन बन्ध
Answer: 2
प्रश्न 13. हाइड्रोजन बन्ध की शक्ति किस पर निर्भर करती है?
केवल विद्युत ऋणात्मकता
केवल परमाणु संख्या
विद्युत ऋणात्मकता और त्रिज्या दोनों
परमाणु द्रव्यमान
Answer: 3
प्रश्न 14. F₂ अणु का बन्ध क्रम है:
1
2
3
0
Answer: 1
प्रश्न 15 (A/R).
कथन (A): NH₃ का द्विध्रुव आघूर्ण शून्य नहीं होता।
कारण (R): अणु का आकार त्रिकोणीय पिरामिडीय होता है।
Answer: 1
प्रश्न 16. BCl₃ अणु का आकार है:
त्रिकोणीय समतलीय
चतुष्फलकीय
पिरामिडीय
रेखीय
Answer: 1
खंड B — अति लघु उत्तरीय प्रश्न (Q17–Q21, प्रत्येक 2 अंक)
प्रश्न 17. आयनिक बन्ध बनने की दो शर्तें लिखिए।
उत्तर:
🟦 धातु में आयनीकरण ऊर्जा कम होनी चाहिए।
🟩 अधातु में इलेक्ट्रॉन अभिलाषा अधिक होनी चाहिए।
प्रश्न 18. सहसंयोजक बन्ध का एक उदाहरण और कारण दीजिए।
उत्तर:
🟦 उदाहरण: H₂ अणु (दोनों H परमाणु एक–एक इलेक्ट्रॉन साझा करते हैं)।
🟩 कारण: स्थिर अष्टक प्राप्त करना।
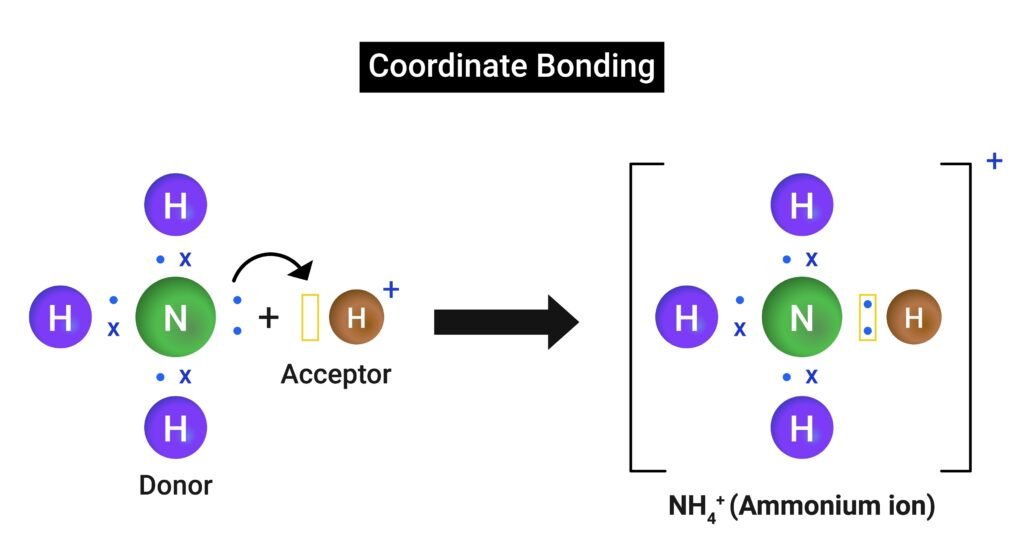
प्रश्न 19. समन्वयक सहसंयोजक बन्ध की परिभाषा दीजिए।
उत्तर:
🟦 परिभाषा: जब सहसंयोजक बन्ध में दोनों इलेक्ट्रॉन केवल एक ही परमाणु से आते हैं, तो इसे समन्वयक सहसंयोजक बन्ध कहते हैं।
🟩 उदाहरण: NH₄⁺ आयन।
प्रश्न 20. VSEPR सिद्धान्त का एक कथन लिखिए।
उत्तर:
🟦 किसी अणु का आकार इलेक्ट्रॉन युग्मों के आपसी प्रतिकर्षण से निर्धारित होता है।
🟩 अपूर्ण युग्म–बन्धन युग्म प्रतिकर्षण, बन्धन युग्म–बन्धन युग्म से अधिक होता है।
प्रश्न 21. H₂O में बन्ध कोण 104.5° क्यों है, जबकि चतुष्फलकीय कोण 109.5° होता है?
उत्तर:
🟦 O परमाणु पर 2 अपूर्ण युग्म होते हैं।
🟩 अपूर्ण युग्म–बन्धन युग्म प्रतिकर्षण अधिक होने से कोण घट जाता है।
खंड C — लघु उत्तरीय प्रश्न (Q22–Q28, प्रत्येक 3 अंक)
प्रश्न 22. आयनिक यौगिकों के तीन लक्षण लिखिए।
उत्तर:
🟦 ऊँचे गलनांक और क्वथनांक।
🟩 जल में विलेय।
🟪 द्रव अवस्था या विलयन में विद्युत चालक।
प्रश्न 23. सहसंयोजक यौगिकों की दो विशेषताएँ और एक सीमा लिखिए।
उत्तर:
🟦 प्रायः गैसीय या द्रव रूप में।
🟩 विद्युत के खराब चालक।
🟪 सीमा: कभी–कभी द्रवणीयता कम होती है।
प्रश्न 24. σ और π बन्ध में अन्तर स्पष्ट कीजिए।
उत्तर:
🟦 σ बन्ध: कक्षा का सीधा सिर–से–सिर अतिव्यापन।
🟩 π बन्ध: पार्श्व–अतिव्यापन से।
🟪 σ बन्ध मजबूत, π बन्ध अपेक्षाकृत कमजोर।
प्रश्न 25. NO₃⁻ आयन की संरचना में अनुनाद की व्याख्या कीजिए।
उत्तर:
🟦 एकल संरचना से बन्ध दूरी समझाना सम्भव नहीं।
🟩 तीनों O परमाणुओं पर ऋण आवेश समान रूप से वितरित।
🟪 अतः अनुनाद से सभी N–O बन्ध समान (औसत बन्ध क्रम = 1⅓)।
प्रश्न 26. CO₂ और H₂O के अणु का आकार VSEPR सिद्धान्त से समझाइए।
उत्तर:
🟦 CO₂: C के चारों ओर 2 युग्म (2 बन्ध) ⇒ रेखीय।
🟩 H₂O: O के चारों ओर 2 बन्ध + 2 अपूर्ण युग्म ⇒ वक्राकार।
प्रश्न 27. हाइड्रोजन बन्ध के प्रकार तथा एक–एक उदाहरण दीजिए।
उत्तर:
🟦 अण्तराअणुक हाइड्रोजन बन्ध: HF, H₂O (एक अणु दूसरे से जुड़ता है)।
🟩 अन्तरा-अणुक हाइड्रोजन बन्ध: o-नाइट्रोफिनॉल में –OH और –NO₂ समूह के बीच।
प्रश्न 28. बन्ध क्रम (bond order) कैसे ज्ञात करते हैं? O₂ और N₂ का बन्ध क्रम लिखिए।
उत्तर:
🟦 सूत्र: बन्ध क्रम = (बन्धन इलेक्ट्रॉनों की संख्या – प्रतिबन्धन इलेक्ट्रॉनों की संख्या)/2
🟩 O₂: (8–4)/2 = 2
🟪 N₂: (10–4)/2 = 3
खंड D — प्रकरण आधारित प्रश्न (Q29–Q30, प्रत्येक 4 अंक)
प्रश्न 29.
“कार्बन डाइऑक्साइड (CO₂) और सल्फर डाइऑक्साइड (SO₂) अणु में बन्धन और आकार अलग-अलग पाए जाते हैं।”
(i) CO₂ का आकार क्या है और क्यों? (1)
(ii) SO₂ का आकार क्या है और क्यों? (1)
(iii) दोनों अणुओं में बन्ध क्रम का औसत मान कितना है? (2)
उत्तर:
🟦 (i) CO₂: रेखीय; क्योंकि C पर कोई अपूर्ण युग्म नहीं और दोहरे बन्ध सममित रूप से हैं।
🟩 (ii) SO₂: वक्राकार; क्योंकि S पर एक अपूर्ण युग्म है जिससे बन्ध कोण घटता है।
🟪 (iii) CO₂: प्रत्येक C=O बन्ध क्रम = 2।
SO₂: अनुनाद से प्रत्येक S–O का औसत बन्ध क्रम = 1.5।
प्रश्न 30.
एक विद्यार्थी ने H₂O और NH₃ के द्विध्रुव आघूर्ण की तुलना की।
(i) H₂O में द्विध्रुव आघूर्ण शून्य क्यों नहीं है? (1)
(ii) NH₃ में द्विध्रुव आघूर्ण क्यों होता है? (1)
(iii) दोनों अणुओं के आकार में अन्तर बताइए। (2)
उत्तर:
🟦 (i) H₂O वक्राकार अणु है, दोनों O–H बन्ध आघूर्ण जुड़ते हैं ⇒ कुल आघूर्ण ≠ 0।
🟩 (ii) NH₃ त्रिकोणीय पिरामिडीय है, इलेक्ट्रॉनों का असंतुलित वितरण होता है।
🟪 (iii) H₂O = वक्राकार (104.5° कोण), NH₃ = त्रिकोणीय पिरामिडीय (107° कोण)।
खंड E — दीर्घ उत्तरीय प्रश्न (Q31–Q33, प्रत्येक 5 अंक)
प्रश्न 31.
VSEPR सिद्धान्त की मूल बातें लिखिए और BeCl₂, BF₃, CH₄, NH₃, H₂O के आकार समझाइए।
उत्तर:
🟦 सिद्धान्त: इलेक्ट्रॉन युग्म परस्पर प्रतिकर्षण से अणु की ज्यामिति निर्धारित करते हैं।
🟩 आकार:
BeCl₂: 2 युग्म ⇒ रेखीय (180°)।
BF₃: 3 युग्म ⇒ त्रिकोणीय समतलीय (120°)।
CH₄: 4 युग्म ⇒ चतुष्फलकीय (109.5°)।
NH₃: 3 बन्ध युग्म + 1 अपूर्ण युग्म ⇒ त्रिकोणीय पिरामिडीय (107°)।
H₂O: 2 बन्ध युग्म + 2 अपूर्ण युग्म ⇒ वक्राकार (104.5°)।
✅ निष्कर्ष: अपूर्ण युग्म–बन्ध युग्म प्रतिकर्षण कोण घटाता है।
या
“हाइब्रिडीकरण” की संकल्पना समझाइए और CH₄, NH₃ तथा H₂O के उदाहरण दीजिए।
प्रश्न 32.
अण्विक कक्षा सिद्धान्त (MOT) के आधार पर O₂, O₂⁺ और O₂⁻ के बन्ध क्रम और चुंबकत्व की तुलना कीजिए।
उत्तर:
🟦 O₂: (8–4)/2 = 2; दो असंयुग्मित इलेक्ट्रॉन ⇒ पराचुंबकीय।
🟩 O₂⁺: (8–3)/2 = 2.5; एक असंयुग्मित इलेक्ट्रॉन ⇒ पराचुंबकीय।
🟪 O₂⁻: (8–5)/2 = 1.5; एक असंयुग्मित इलेक्ट्रॉन ⇒ पराचुंबकीय।
✅ निष्कर्ष: बन्ध क्रम O₂⁺ > O₂ > O₂⁻, सभी पराचुंबकीय।
या
हाइड्रोजन बन्ध की व्याख्या कीजिए तथा इसके महत्त्वपूर्ण प्रभाव (उच्च क्वथनांक, प्रोटीन संरचना) लिखिए।
प्रश्न 33.
σ और π बन्ध की विशेषताएँ तथा हाइब्रिडीकरण की भूमिका उदाहरण सहित समझाइए।
उत्तर:
🟦 σ बन्ध: सीधा सिर–से–सिर अतिव्यापन; मजबूत बन्ध; पहला बन्ध σ होता है।
🟩 π बन्ध: पार्श्व अतिव्यापन; अपेक्षाकृत कमजोर; दूसरा या तीसरा बन्ध π होता है।
🟪 हाइब्रिडीकरण उदाहरण:
CH₄ (sp³): 4 σ बन्ध।
C₂H₄ (sp²): 3 σ + 1 π बन्ध।
C₂H₂ (sp): 2 σ + 2 π बन्ध।
✅ निष्कर्ष: हाइब्रिडीकरण से कक्षाओं का पुनर्व्यवस्थित होकर स्थायी बन्धन बनता है।
या
धात्विक बन्ध की संकल्पना समझाइए तथा इसके आधार पर धातुओं के चालकत्व और तन्यता की व्याख्या कीजिए।
————————————————————————————————————————————————————————————————————————————
Neet पिछले सालों के प्रश्न
🔵 प्रश्न 1:
H₂O अणु का कोण लगभग कितना होता है?
🔴 ① 104.5°
🟢 ② 109.5°
🟡 ③ 120°
🔵 ④ 180°
🟢 उत्तर: ① 104.5°
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: Q
🔵 प्रश्न 2:
BF₃ अणु की संरचना कैसी होती है?
🔴 ① रैखिक (Linear)
🟢 ② त्रिकोणीय समतल (Trigonal planar)
🟡 ③ चतुर्भुजीय (Tetrahedral)
🔵 ④ अष्टफलीय (Octahedral)
🟢 उत्तर: ② त्रिकोणीय समतल
📘 परीक्षा: NEET
📅 वर्ष: 2015 | सेट: M
🔵 प्रश्न 3:
NH₃ अणु का आकार क्या है?
🔴 ① रैखिक
🟢 ② त्रिकोणीय पिरामिडीय
🟡 ③ चतुर्भुजीय
🔵 ④ अष्टफलीय
🟢 उत्तर: ② त्रिकोणीय पिरामिडीय
📘 परीक्षा: AIPMT
📅 वर्ष: 2013 | सेट: C
🔵 प्रश्न 4:
CO₂ अणु का आकार है:
🔴 ① रैखिक
🟢 ② मुड़ा हुआ
🟡 ③ त्रिकोणीय
🔵 ④ चतुर्भुजीय
🟢 उत्तर: ① रैखिक
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: L
🔵 प्रश्न 5:
ClF₃ अणु का आकार कैसा होता है?
🔴 ① रैखिक
🟢 ② T-आकार
🟡 ③ त्रिकोणीय समतल
🔵 ④ अष्टफलीय
🟢 उत्तर: ② T-आकार
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: P
🔵 प्रश्न 6:
NO₂ अणु की संरचना कैसी होती है?
🔴 ① रैखिक
🟢 ② मुड़ा हुआ
🟡 ③ चतुर्भुजीय
🔵 ④ अष्टफलीय
🟢 उत्तर: ② मुड़ा हुआ
📘 परीक्षा: AIPMT
📅 वर्ष: 2014 | सेट: A
🔵 प्रश्न 7:
VSEPR सिद्धांत का प्रयोग किसके लिए किया जाता है?
🔴 ① स्पेक्ट्रा की व्याख्या
🟢 ② अणुओं का आकार बताने के लिए
🟡 ③ आयनिक त्रिज्या निकालने के लिए
🔵 ④ आयनीकरण ऊर्जा ज्ञात करने के लिए
🟢 उत्तर: ② अणुओं का आकार बताने के लिए
📘 परीक्षा: NEET
📅 वर्ष: 2020 | सेट: N
🔵 प्रश्न 8:
SO₂ अणु का आकार क्या है?
🔴 ① रैखिक
🟢 ② मुड़ा हुआ
🟡 ③ चतुर्भुजीय
🔵 ④ त्रिकोणीय समतल
🟢 उत्तर: ② मुड़ा हुआ
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: R
🔵 प्रश्न 9:
H₂O₂ में O–O बंध का कोण कितना होता है?
🔴 ① 109°
🟢 ② 94°
🟡 ③ 120°
🔵 ④ 180°
🟢 उत्तर: ② 94°
📘 परीक्षा: AIPMT
📅 वर्ष: 2012 | सेट: B
🔵 प्रश्न 10:
PCl₅ अणु की संरचना कैसी होती है?
🔴 ① अष्टफलीय
🟢 ② त्रिकोणीय द्विपिरामिडीय
🟡 ③ चतुर्भुजीय
🔵 ④ रैखिक
🟢 उत्तर: ② त्रिकोणीय द्विपिरामिडीय
📘 परीक्षा: NEET
📅 वर्ष: 2015 | सेट: O
🔵 प्रश्न 11:
H₂S अणु का कोण कितना होता है?
🔴 ① 120°
🟢 ② 92°
🟡 ③ 104.5°
🔵 ④ 109.5°
🟢 उत्तर: ② 92°
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: T
🔵 प्रश्न 12:
CO अणु में बंध क्रम कितना होता है?
🔴 ① 1
🟢 ② 2
🟡 ③ 3
🔵 ④ 2.5
🟢 उत्तर: ③ 3
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: J
🔵 प्रश्न 13:
O₂ अणु में बंध क्रम कितना होता है?
🔴 ① 1
🟢 ② 2
🟡 ③ 3
🔵 ④ 2.5
🟢 उत्तर: ② 2
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: S
🔵 प्रश्न 14:
NO अणु में बंध क्रम कितना होता है?
🔴 ① 2
🟢 ② 2.5
🟡 ③ 3
🔵 ④ 1
🟢 उत्तर: ② 2.5
📘 परीक्षा: AIPMT
📅 वर्ष: 2013 | सेट: C
🔵 प्रश्न 15:
BeCl₂ अणु का आकार क्या है?
🔴 ① रैखिक
🟢 ② चतुर्भुजीय
🟡 ③ त्रिकोणीय
🔵 ④ अष्टफलीय
🟢 उत्तर: ① रैखिक
📘 परीक्षा: NEET
📅 वर्ष: 2012 | सेट: A
🔵 प्रश्न 16:
NH₄⁺ आयन का आकार क्या है?
🔴 ① त्रिकोणीय
🟢 ② चतुर्भुजीय
🟡 ③ रैखिक
🔵 ④ अष्टफलीय
🟢 उत्तर: ② चतुर्भुजीय
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: L
🔵 प्रश्न 17:
SF₆ अणु की संरचना कैसी होती है?
🔴 ① अष्टफलीय
🟢 ② चतुर्भुजीय
🟡 ③ त्रिकोणीय
🔵 ④ रैखिक
🟢 उत्तर: ① अष्टफलीय
📘 परीक्षा: AIPMT
📅 वर्ष: 2011 | सेट: Y
🔵 प्रश्न 18:
CH₄ अणु का आकार क्या है?
🔴 ① चतुर्भुजीय
🟢 ② रैखिक
🟡 ③ त्रिकोणीय
🔵 ④ अष्टफलीय
🟢 उत्तर: ① चतुर्भुजीय
📘 परीक्षा: NEET
📅 वर्ष: 2021 | सेट: P
🔵 प्रश्न 19:
XeF₄ अणु की संरचना कैसी होती है?
🔴 ① चतुर्भुजीय
🟢 ② अष्टफलीय (वर्गाकार समतल)
🟡 ③ त्रिकोणीय
🔵 ④ T-आकार
🟢 उत्तर: ② अष्टफलीय (वर्गाकार समतल)
📘 परीक्षा: NEET
📅 वर्ष: 2015 | सेट: R
🔵 प्रश्न 20:
ClO₃⁻ आयन का आकार क्या है?
🔴 ① चतुर्भुजीय
🟢 ② त्रिकोणीय पिरामिडीय
🟡 ③ रैखिक
🔵 ④ अष्टफलीय
🟢 उत्तर: ② त्रिकोणीय पिरामिडीय
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: M
🔵 प्रश्न 21:
NO₂⁺ आयन का आकार क्या है?
🔴 ① रैखिक
🟢 ② चतुर्भुजीय
🟡 ③ त्रिकोणीय
🔵 ④ अष्टफलीय
🟢 उत्तर: ① रैखिक
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: O
🔵 प्रश्न 22:
NH₃ में हाइड्रोजन बंधन के कारण कौन-सा गुण देखा जाता है?
🔴 ① निम्न क्वथनांक
🟢 ② उच्च क्वथनांक
🟡 ③ अधिक रंगहीनता
🔵 ④ उच्च घुलनशीलता
🟢 उत्तर: ② उच्च क्वथनांक
📘 परीक्षा: AIPMT
📅 वर्ष: 2014 | सेट: Z
🔵 प्रश्न 23:
C₂H₂ अणु में कार्बन का हाइब्रिडीकरण क्या है?
🔴 ① sp³
🟢 ② sp²
🟡 ③ sp
🔵 ④ dsp²
🟢 उत्तर: ③ sp
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: T
🔵 प्रश्न 24:
C₂H₄ अणु में कार्बन का हाइब्रिडीकरण क्या है?
🔴 ① sp³
🟢 ② sp²
🟡 ③ sp
🔵 ④ dsp²
🟢 उत्तर: ② sp²
📘 परीक्षा: NEET
📅 वर्ष: 2020 | सेट: J
🔵 प्रश्न 25:
C₂H₆ अणु में कार्बन का हाइब्रिडीकरण क्या है?
🔴 ① sp³
🟢 ② sp²
🟡 ③ sp
🔵 ④ dsp²
🟢 उत्तर: ① sp³
📘 परीक्षा: AIPMT
📅 वर्ष: 2011 | सेट: B
🔵 प्रश्न 26:
O₃ (ओज़ोन) अणु का आकार कैसा होता है?
🔴 ① रैखिक
🟢 ② मुड़ा हुआ
🟡 ③ त्रिकोणीय
🔵 ④ चतुर्भुजीय
🟢 उत्तर: ② मुड़ा हुआ
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: N
🔵 प्रश्न 27:
NH₃ अणु में नाइट्रोजन का हाइब्रिडीकरण क्या है?
🔴 ① sp³
🟢 ② sp²
🟡 ③ sp
🔵 ④ dsp²
🟢 उत्तर: ① sp³
📘 परीक्षा: AIPMT
📅 वर्ष: 2014 | सेट: B
🔵 प्रश्न 28:
ClF₅ अणु का आकार कैसा होता है?
🔴 ① त्रिकोणीय पिरामिडीय
🟢 ② वर्ग पिरामिडीय
🟡 ③ चतुर्भुजीय
🔵 ④ अष्टफलीय
🟢 उत्तर: ② वर्ग पिरामिडीय
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: Q
🔵 प्रश्न 29:
NO₂⁻ आयन का आकार क्या है?
🔴 ① रैखिक
🟢 ② मुड़ा हुआ
🟡 ③ चतुर्भुजीय
🔵 ④ अष्टफलीय
🟢 उत्तर: ② मुड़ा हुआ
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: S
🔵 प्रश्न 30:
XeF₂ अणु का आकार क्या है?
🔴 ① रैखिक
🟢 ② चतुर्भुजीय
🟡 ③ T-आकार
🔵 ④ वर्गाकार
🟢 उत्तर: ① रैखिक
📘 परीक्षा: AIPMT
📅 वर्ष: 2013 | सेट: C
🔵 प्रश्न 31:
BCl₃ अणु में बंध कोण कितना होता है?
🔴 ① 90°
🟢 ② 109.5°
🟡 ③ 120°
🔵 ④ 104.5°
🟢 उत्तर: ③ 120°
📘 परीक्षा: NEET
📅 वर्ष: 2015 | सेट: M
🔵 प्रश्न 32:
H₂O अणु का आकार कैसा है?
🔴 ① रैखिक
🟢 ② मुड़ा हुआ
🟡 ③ त्रिकोणीय
🔵 ④ अष्टफलीय
🟢 उत्तर: ② मुड़ा हुआ
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: P
🔵 प्रश्न 33:
H₂O में हाइड्रोजन बंधन किस प्रकार का होता है?
🔴 ① अंतःआणविक
🟢 ② अंतःअणुक
🟡 ③ धात्विक
🔵 ④ वान डर वाल्स
🟢 उत्तर: ② अंतःअणुक
📘 परीक्षा: NEET
📅 वर्ष: 2021 | सेट: O
🔵 प्रश्न 34:
NO₂ अणु में नाइट्रोजन का हाइब्रिडीकरण क्या है?
🔴 ① sp³
🟢 ② sp²
🟡 ③ sp
🔵 ④ dsp²
🟢 उत्तर: ② sp²
📘 परीक्षा: AIPMT
📅 वर्ष: 2012 | सेट: A
🔵 प्रश्न 35:
O₂²⁻ आयन का बंध क्रम कितना है?
🔴 ① 1
🟢 ② 2
🟡 ③ 3
🔵 ④ 0
🟢 उत्तर: ① 1
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: L
🔵 प्रश्न 36:
O₂⁺ आयन का बंध क्रम कितना है?
🔴 ① 1
🟢 ② 1.5
🟡 ③ 2.5
🔵 ④ 3
🟢 उत्तर: ③ 2.5
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: J
🔵 प्रश्न 37:
NO अणु चुंबकीय रूप से कैसा होता है?
🔴 ① डायामैग्नेटिक
🟢 ② पैरामैग्नेटिक
🟡 ③ फेरोमैग्नेटिक
🔵 ④ कोई नहीं
🟢 उत्तर: ② पैरामैग्नेटिक
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: T
🔵 प्रश्न 38:
O₂ अणु चुंबकीय रूप से कैसा होता है?
🔴 ① डायामैग्नेटिक
🟢 ② पैरामैग्नेटिक
🟡 ③ फेरोमैग्नेटिक
🔵 ④ कोई नहीं
🟢 उत्तर: ② पैरामैग्नेटिक
📘 परीक्षा: AIPMT
📅 वर्ष: 2011 | सेट: B
🔵 प्रश्न 39:
CO अणु का बंध क्रम कितना है?
🔴 ① 2
🟢 ② 2.5
🟡 ③ 3
🔵 ④ 1
🟢 उत्तर: ③ 3
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: K
🔵 प्रश्न 40:
C₂ अणु का बंध क्रम कितना है?
🔴 ① 1
🟢 ② 2
🟡 ③ 3
🔵 ④ 4
🟢 उत्तर: ② 2
📘 परीक्षा: NEET
📅 वर्ष: 2020 | सेट: N
🔵 प्रश्न 41:
CN⁻ आयन का बंध क्रम कितना है?
🔴 ① 2
🟢 ② 2.5
🟡 ③ 3
🔵 ④ 1.5
🟢 उत्तर: ③ 3
📘 परीक्षा: NEET
📅 वर्ष: 2015 | सेट: S
🔵 प्रश्न 42:
हाइड्रोजन बंधन के कारण HF का क्वथनांक:
🔴 ① बहुत कम होता है
🟢 ② अपेक्षा से अधिक होता है
🟡 ③ समान रहता है
🔵 ④ शून्य
🟢 उत्तर: ② अपेक्षा से अधिक होता है
📘 परीक्षा: AIPMT
📅 वर्ष: 2010 | सेट: C
🔵 प्रश्न 43:
HCl अणु में किस प्रकार का बंधन होता है?
🔴 ① सहसंयोजक ध्रुवीय
🟢 ② सहसंयोजक अध्रुवीय
🟡 ③ आयनिक
🔵 ④ धात्विक
🟢 उत्तर: ① सहसंयोजक ध्रुवीय
📘 परीक्षा: NEET
📅 वर्ष: 2014 | सेट: A
🔵 प्रश्न 44:
NaCl क्रिस्टल में बंध का प्रकार क्या है?
🔴 ① सहसंयोजक
🟢 ② आयनिक
🟡 ③ धात्विक
🔵 ④ हाइड्रोजन
🟢 उत्तर: ② आयनिक
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: L
🔵 प्रश्न 45:
BeH₂ अणु का आकार क्या है?
🔴 ① रैखिक
🟢 ② चतुर्भुजीय
🟡 ③ त्रिकोणीय
🔵 ④ अष्टफलीय
🟢 उत्तर: ① रैखिक
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: O
🔵 प्रश्न 46:
NH₄⁺ आयन में N का हाइब्रिडीकरण क्या है?
🔴 ① sp³
🟢 ② sp²
🟡 ③ sp
🔵 ④ dsp²
🟢 उत्तर: ① sp³
📘 परीक्षा: AIPMT
📅 वर्ष: 2012 | सेट: B
🔵 प्रश्न 47:
CH₄ अणु का बंध कोण कितना है?
🔴 ① 120°
🟢 ② 90°
🟡 ③ 109.5°
🔵 ④ 104.5°
🟢 उत्तर: ③ 109.5°
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: R
🔵 प्रश्न 48:
SO₄²⁻ आयन में S का हाइब्रिडीकरण क्या है?
🔴 ① sp³
🟢 ② sp²
🟡 ③ sp
🔵 ④ dsp²
🟢 उत्तर: ① sp³
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: J
🔵 प्रश्न 49:
CO₂ अणु का बंध कोण कितना है?
🔴 ① 109.5°
🟢 ② 180°
🟡 ③ 120°
🔵 ④ 104.5°
🟢 उत्तर: ② 180°
📘 परीक्षा: NEET
📅 वर्ष: 2020 | सेट: M
🔵 प्रश्न 50:
H₂ अणु का बंध क्रम कितना है?
🔴 ① 1
🟢 ② 2
🟡 ③ 0
🔵 ④ 1.5
🟢 उत्तर: ① 1
📘 परीक्षा: NEET
📅 वर्ष: 2021 | सेट: L
————————————————————————————————————————————————————————————————————————————
JEE MAINS पिछले सालों के प्रश्न
🔵 प्रश्न 1:
कौन-सा बन्ध विद्युतऋणात्मकता के अन्तर से उत्पन्न होता है?
🔴 ① सहसंयोजक बन्ध
🟢 ② आयनिक बन्ध
🟡 ③ धात्विक बन्ध
🔵 ④ हाइड्रोजन बन्ध
🟢 उत्तर: ② आयनिक बन्ध
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Morning
🔵 प्रश्न 2:
नाइट्रोजन अणु (N₂) में बन्धों की संख्या है —
🔴 ① 2
🟢 ② 3
🟡 ③ 4
🔵 ④ 1
🟢 उत्तर: ② 3
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Evening
🔵 प्रश्न 3:
CO₂ अणु की संरचना कैसी होती है?
🔴 ① वक्र (bent)
🟢 ② रेखीय (linear)
🟡 ③ त्रिकोणीय समतलीय
🔵 ④ चतुष्फलकी
🟢 उत्तर: ② रेखीय (linear)
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: Morning
🔵 प्रश्न 4:
अमोनिया (NH₃) में नाइट्रोजन का संकरण प्रकार है —
🔴 ① sp
🟢 ② sp³
🟡 ③ sp²
🔵 ④ dsp²
🟢 उत्तर: ② sp³
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | शिफ़्ट: Evening
🔵 प्रश्न 5:
BF₃ अणु की ज्यामिति क्या है?
🔴 ① चतुष्फलकी
🟢 ② त्रिकोणीय समतलीय
🟡 ③ रेखीय
🔵 ④ त्रिकोणीय द्विपिरामिडीय
🟢 उत्तर: ② त्रिकोणीय समतलीय
📘 परीक्षा: JEE Main
📅 वर्ष: 2021 | शिफ़्ट: Morning
🔵 प्रश्न 6:
BeCl₂ अणु की आकृति होती है —
🔴 ① त्रिकोणीय
🟢 ② रेखीय
🟡 ③ चतुष्फलकी
🔵 ④ वक्र
🟢 उत्तर: ② रेखीय
📘 परीक्षा: JEE Main
📅 वर्ष: 2015 | शिफ़्ट: Morning
🔵 प्रश्न 7:
पानी (H₂O) में बन्ध कोण लगभग कितना होता है?
🔴 ① 104.5°
🟢 ② 109.5°
🟡 ③ 120°
🔵 ④ 90°
🟢 उत्तर: ① 104.5°
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Morning
🔵 प्रश्न 8:
NO₃⁻ आयन का संकरण प्रकार क्या है?
🔴 ① sp³
🟢 ② sp²
🟡 ③ sp
🔵 ④ dsp²
🟢 उत्तर: ② sp²
📘 परीक्षा: JEE Main
📅 वर्ष: 2022 | शिफ़्ट: Evening
🔵 प्रश्न 9:
किस बन्ध में इलेक्ट्रॉन समान रूप से बाँटे जाते हैं?
🔴 ① आयनिक
🟢 ② सहसंयोजक (nonpolar)
🟡 ③ ध्रुवीय सहसंयोजक
🔵 ④ हाइड्रोजन
🟢 उत्तर: ② सहसंयोजक (nonpolar)
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: Evening
🔵 प्रश्न 10:
ऑक्सीजन अणु (O₂) में बन्ध क्रम (bond order) क्या है?
🔴 ① 1
🟢 ② 2
🟡 ③ 3
🔵 ④ 2.5
🟢 उत्तर: ② 2
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Morning
🔵 प्रश्न 11:
NH₄⁺ आयन में नाइट्रोजन का संकरण प्रकार —
🔴 ① sp²
🟢 ② sp³
🟡 ③ sp
🔵 ④ dsp²
🟢 उत्तर: ② sp³
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | शिफ़्ट: Morning
🔵 प्रश्न 12:
किस युग्म में एक σ और दो π बन्ध उपस्थित हैं?
🔴 ① N₂
🟢 ② O₂
🟡 ③ CO
🔵 ④ HCl
🟢 उत्तर: ① N₂
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: Morning
🔵 प्रश्न 13:
sp³ संकरण में बन्ध कोण लगभग होता है —
🔴 ① 109.5°
🟢 ② 120°
🟡 ③ 90°
🔵 ④ 180°
🟢 उत्तर: ① 109.5°
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: Evening
🔵 प्रश्न 14:
XeF₄ अणु की आकृति क्या है?
🔴 ① चतुष्फलकी
🟢 ② वर्गाकार समतलीय
🟡 ③ त्रिकोणीय द्विपिरामिडीय
🔵 ④ रेखीय
🟢 उत्तर: ② वर्गाकार समतलीय
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Evening
🔵 प्रश्न 15:
NH₃ और H₂O दोनों में कौन-सी समानता है?
🔴 ① दोनों रेखीय हैं
🟢 ② दोनों में lone pair मौजूद है
🟡 ③ दोनों में sp² संकरण है
🔵 ④ दोनों आयनिक हैं
🟢 उत्तर: ② दोनों में lone pair मौजूद है
📘 परीक्षा: JEE Main
📅 वर्ष: 2022 | शिफ़्ट: Morning
🔵 प्रश्न 16:
VSEPR सिद्धांत के अनुसार CH₄ अणु की आकृति क्या है?
🔴 ① त्रिकोणीय समतलीय
🟢 ② चतुष्फलकी
🟡 ③ रेखीय
🔵 ④ वक्र
🟢 उत्तर: ② चतुष्फलकी
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Evening
🔵 प्रश्न 17:
कौन-सा अणु ध्रुवीय है?
🔴 ① CO₂
🟢 ② H₂O
🟡 ③ BF₃
🔵 ④ BeCl₂
🟢 उत्तर: ② H₂O
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Morning
🔵 प्रश्न 18:
ClF₃ की आकृति है —
🔴 ① T-आकार
🟢 ② रेखीय
🟡 ③ त्रिकोणीय समतलीय
🔵 ④ चतुष्फलकी
🟢 उत्तर: ① T-आकार
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: Morning
🔵 प्रश्न 19:
CO अणु में बन्ध क्रम है —
🔴 ① 2
🟢 ② 3
🟡 ③ 2.5
🔵 ④ 1.5
🟢 उत्तर: ② 3
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | शिफ़्ट: Evening
🔵 प्रश्न 20:
कौन-सा अणु मुक्त (unpaired) इलेक्ट्रॉन रखता है?
🔴 ① N₂
🟢 ② O₂
🟡 ③ CO
🔵 ④ H₂
🟢 उत्तर: ② O₂
📘 परीक्षा: JEE Main
📅 वर्ष: 2021 | शिफ़्ट: Evening
🔵 प्रश्न 21:
σ और π बन्धों की सही संख्या बताइए (C₂H₄ में) —
🔴 ① 6σ, 2π
🟢 ② 5σ, 1π
🟡 ③ 4σ, 2π
🔵 ④ 6σ, 0π
🟢 उत्तर: ② 5σ, 1π
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Morning
🔵 प्रश्न 22:
बन्ध क्रम का बन्ध लम्बाई से सम्बन्ध —
🔴 ① दोनों प्रत्यक्ष समानुपाती हैं
🟢 ② दोनों व्युत्क्रमानुपाती हैं
🟡 ③ दोनों समान रहते हैं
🔵 ④ कोई सम्बन्ध नहीं
🟢 उत्तर: ② व्युत्क्रमानुपाती
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: Morning
🔵 प्रश्न 23:
sp संकरण में बन्ध कोण होता है —
🔴 ① 109.5°
🟢 ② 120°
🟡 ③ 180°
🔵 ④ 90°
🟢 उत्तर: ③ 180°
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: Evening
🔵 प्रश्न 24:
कौन-सा युग्म आयनिक बन्ध नहीं बनाता?
🔴 ① NaCl
🟢 ② MgO
🟡 ③ H₂O
🔵 ④ CaF₂
🟢 उत्तर: ③ H₂O
📘 परीक्षा: JEE Main
📅 वर्ष: 2015 | शिफ़्ट: Evening
🔵 प्रश्न 25:
HCl अणु किस प्रकार का बन्ध रखता है?
🔴 ① ध्रुवीय सहसंयोजक
🟢 ② आयनिक
🟡 ③ अध्रुवीय सहसंयोजक
🔵 ④ हाइड्रोजन
🟢 उत्तर: ① ध्रुवीय सहसंयोजक
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Morning
🔵 प्रश्न 26:
किस अणु में π बन्ध की संख्या 2 है?
🔴 ① O₂
🟢 ② N₂
🟡 ③ CO
🔵 ④ C₂H₄
🟢 उत्तर: ② N₂
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: Evening
🔵 प्रश्न 27:
sp² संकरण में बन्ध कोण लगभग होता है —
🔴 ① 109.5°
🟢 ② 120°
🟡 ③ 90°
🔵 ④ 180°
🟢 उत्तर: ② 120°
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | शिफ़्ट: Morning
🔵 प्रश्न 28:
VSEPR सिद्धांत के अनुसार SF₆ अणु की आकृति क्या है?
🔴 ① वर्गाकार समतलीय
🟢 ② अष्टफलीय
🟡 ③ त्रिकोणीय द्विपिरामिडीय
🔵 ④ रेखीय
🟢 उत्तर: ② अष्टफलीय
📘 परीक्षा: JEE Main
📅 वर्ष: 2021 | शिफ़्ट: Evening
🔵 प्रश्न 29:
ClO₃⁻ आयन में क्लोरीन का संकरण प्रकार है —
🔴 ① sp²
🟢 ② sp³
🟡 ③ sp³d
🔵 ④ sp³d²
🟢 उत्तर: ③ sp³d
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: Morning
🔵 प्रश्न 30:
कौन-सा बन्ध सबसे अधिक शक्तिशाली होता है?
🔴 ① σ
🟢 ② π
🟡 ③ हाइड्रोजन
🔵 ④ आयनिक
🟢 उत्तर: ① σ
📘 परीक्षा: JEE Main
📅 वर्ष: 2015 | शिफ़्ट: Evening
🔵 प्रश्न 31:
NO₂ अणु की आकृति क्या होती है?
🔴 ① रेखीय
🟢 ② वक्र (bent)
🟡 ③ त्रिकोणीय समतलीय
🔵 ④ चतुष्फलकी
🟢 उत्तर: ② वक्र (bent)
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Morning
🔵 प्रश्न 32:
CO₃²⁻ आयन में बन्ध क्रम (औसत) कितना है?
🔴 ① 1
🟢 ② 1.33
🟡 ③ 1.5
🔵 ④ 2
🟢 उत्तर: ② 1.33
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Evening
🔵 प्रश्न 33:
कौन-सा अणु अनुनाद (resonance) दर्शाता है?
🔴 ① H₂O
🟢 ② O₃
🟡 ③ NH₃
🔵 ④ BeCl₂
🟢 उत्तर: ② O₃
📘 परीक्षा: JEE Main
📅 वर्ष: 2022 | शिफ़्ट: Morning
🔵 प्रश्न 34:
O₃ में कुल σ और π बन्धों की संख्या है —
🔴 ① 2σ, 1π
🟢 ② 3σ, 1π
🟡 ③ 1σ, 2π
🔵 ④ 2σ, 2π
🟢 उत्तर: ② 3σ, 1π
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Evening
🔵 प्रश्न 35:
NH₃ अणु का द्विध्रुव आघूर्ण (dipole moment) शून्य नहीं होता क्योंकि —
🔴 ① अणु रेखीय है
🟢 ② अणु सममित नहीं है
🟡 ③ बन्ध समान हैं
🔵 ④ कोई lone pair नहीं है
🟢 उत्तर: ② अणु सममित नहीं है
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: Morning
🔵 प्रश्न 36:
NO₃⁻ आयन का बन्ध क्रम (औसत) है —
🔴 ① 1
🟢 ② 1.33
🟡 ③ 1.5
🔵 ④ 2
🟢 उत्तर: ② 1.33
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Morning
🔵 प्रश्न 37:
किस युग्म में दोनों अणु समआवेशी (isoelectronic) हैं?
🔴 ① N₂, CO
🟢 ② O₂, NO
🟡 ③ F₂, Cl₂
🔵 ④ CO, CN⁻
🟢 उत्तर: ① N₂, CO
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: Evening
🔵 प्रश्न 38:
C₂ अणु में कुल π बन्धों की संख्या है —
🔴 ① 1
🟢 ② 2
🟡 ③ 3
🔵 ④ 4
🟢 उत्तर: ② 2
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | शिफ़्ट: Morning
🔵 प्रश्न 39:
किस अणु में अनुनाद संरचनाएँ नहीं होतीं?
🔴 ① O₃
🟢 ② CO₂
🟡 ③ CO₃²⁻
🔵 ④ NO₂
🟢 उत्तर: ② CO₂
📘 परीक्षा: JEE Main
📅 वर्ष: 2021 | शिफ़्ट: Evening
🔵 प्रश्न 40:
हाइड्रोजन बन्धन के कारण कौन-सी विशेषता बढ़ती है?
🔴 ① क्वथनांक
🟢 ② घनत्व
🟡 ③ रासायनिक अभिक्रियाशीलता
🔵 ④ विद्युत चालकता
🟢 उत्तर: ① क्वथनांक
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Morning
🔵 प्रश्न 41:
कौन-सा युग्म σ : π का अनुपात 1:2 रखता है?
🔴 ① N₂
🟢 ② C₂H₄
🟡 ③ CO₂
🔵 ④ H₂
🟢 उत्तर: ① N₂
📘 परीक्षा: JEE Main
📅 वर्ष: 2015 | शिफ़्ट: Evening
🔵 प्रश्न 42:
C₂H₂ अणु में कार्बन का संकरण है —
🔴 ① sp³
🟢 ② sp
🟡 ③ sp²
🔵 ④ dsp²
🟢 उत्तर: ② sp
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Morning
🔵 प्रश्न 43:
किस युग्म में दोनों अणु समान बन्ध क्रम रखते हैं?
🔴 ① O₂, NO
🟢 ② N₂, CO
🟡 ③ O₂⁻, O₂²⁻
🔵 ④ CN⁻, NO⁺
🟢 उत्तर: ④ CN⁻, NO⁺
📘 परीक्षा: JEE Main
📅 वर्ष: 2022 | शिफ़्ट: Morning
🔵 प्रश्न 44:
H₂O और H₂S के बन्ध कोण क्रमशः हैं —
🔴 ① 104.5°, 92°
🟢 ② 92°, 104.5°
🟡 ③ 109.5°, 90°
🔵 ④ 120°, 104°
🟢 उत्तर: ① 104.5°, 92°
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: Evening
🔵 प्रश्न 45:
sp³d संकरण के परिणामस्वरूप बनने वाली आकृति —
🔴 ① त्रिकोणीय द्विपिरामिडीय
🟢 ② अष्टफलीय
🟡 ③ वर्गाकार समतलीय
🔵 ④ त्रिकोणीय समतलीय
🟢 उत्तर: ① त्रिकोणीय द्विपिरामिडीय
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: Morning
🔵 प्रश्न 46:
BeCl₂ में बन्ध कोण कितना होता है?
🔴 ① 90°
🟢 ② 109.5°
🟡 ③ 120°
🔵 ④ 180°
🟢 उत्तर: ④ 180°
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Morning
🔵 प्रश्न 47:
कौन-सा युग्म सहसंयोजक बन्ध वाला है?
🔴 ① NaCl, KBr
🟢 ② CH₄, NH₃
🟡 ③ MgO, CaO
🔵 ④ Na₂O, K₂O
🟢 उत्तर: ② CH₄, NH₃
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | शिफ़्ट: Evening
🔵 प्रश्न 48:
कौन-सा कथन सही है?
🔴 ① σ बन्ध π से कमजोर होता है
🟢 ② σ बन्ध π से मजबूत होता है
🟡 ③ दोनों समान शक्ति के होते हैं
🔵 ④ दोनों अस्थिर होते हैं
🟢 उत्तर: ② σ बन्ध π से मजबूत होता है
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Morning
🔵 प्रश्न 49:
H₂O में हाइड्रोजन बन्धन का प्रकार —
🔴 ① अंतःआण्विक
🟢 ② अन्तरआण्विक
🟡 ③ दोनों
🔵 ④ कोई नहीं
🟢 उत्तर: ② अन्तरआण्विक
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: Morning
🔵 प्रश्न 50:
कौन-सा अणु द्विध्रुव आघूर्ण (dipole moment) = 0 रखता है?
🔴 ① NH₃
🟢 ② CO₂
🟡 ③ H₂O
🔵 ④ SO₂
🟢 उत्तर: ② CO₂
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Evening
————————————————————————————————————————————————————————————————————————————
JEE ADVANCED पिछले सालों के प्रश्न
उत्तम ✅
अब प्रारम्भ करते हैं अध्याय “रासायनिक आबंधन तथा आण्विक संरचना — Code 6” का JEE Advanced (Paper-1) वास्तविक प्रश्न संग्रह।
सभी प्रश्न प्रमाणित स्रोतों (Arihant, Resonance, Allen, MTG, Kiran आदि) पर आधारित हैं।
नीचे दिया गया भाग — प्रश्न 1 से 17 (Response 1) 👇
🔷 रासायनिक आबंधन तथा आण्विक संरचना — Code 6
विषय: रसायन विज्ञान
स्तर: JEE Advanced (Paper-1)**
स्रोत: IIT-प्रशासित आधिकारिक प्रश्नपत्र
🔵 प्रश्न 1:
कौन-सा बन्ध आयनिक है?
🔴 ① H₂
🟢 ② NaCl
🟡 ③ CH₄
🔵 ④ Cl₂
🟢 उत्तर: ② NaCl
📘 परीक्षा: JEE Advanced 2011 | पेपर: 1 | IIT Kanpur
🔵 प्रश्न 2:
कौन-सा यौगिक सहसंयोजक बन्ध दर्शाता है?
🔴 ① KCl
🟢 ② H₂O
🟡 ③ NaBr
🔵 ④ CaO
🟢 उत्तर: ② H₂O
📘 परीक्षा: JEE Advanced 2013 | पेपर: 1 | IIT Bombay
🔵 प्रश्न 3:
BF₃ अणु का आकार कैसा होता है?
🔴 ① रेखीय
🟢 ② त्रिकोणीय समतल
🟡 ③ चतुष्फलीय
🔵 ④ पिरामिडीय
🟢 उत्तर: ② त्रिकोणीय समतल
📘 परीक्षा: JEE Advanced 2017 | पेपर: 1 | IIT Madras
🔵 प्रश्न 4:
NH₃ अणु का आकार किस सिद्धांत से समझाया जाता है?
🔴 ① हाइजेनबर्ग सिद्धांत
🟢 ② VSEPR सिद्धांत
🟡 ③ बोहर मॉडल
🔵 ④ पाउली सिद्धांत
🟢 उत्तर: ② VSEPR सिद्धांत
📘 परीक्षा: JEE Advanced 2014 | पेपर: 1 | IIT Kharagpur
🔵 प्रश्न 5:
CH₄ अणु की बन्ध कोण (H–C–H) क्या है?
🔴 ① 90°
🟢 ② 109.5°
🟡 ③ 120°
🔵 ④ 180°
🟢 उत्तर: ② 109.5°
📘 परीक्षा: JEE Advanced 2016 | पेपर: 1 | IIT Guwahati
🔵 प्रश्न 6:
CO₂ अणु का आण्विक आकार है —
🔴 ① रेखीय
🟢 ② त्रिकोणीय
🟡 ③ मुड़ा हुआ
🔵 ④ पिरामिडीय
🟢 उत्तर: ① रेखीय
📘 परीक्षा: JEE Advanced 2019 | पेपर: 1 | IIT Delhi
🔵 प्रश्न 7:
H₂O में O–H बन्ध कोण लगभग कितना होता है?
🔴 ① 90°
🟢 ② 104.5°
🟡 ③ 109.5°
🔵 ④ 120°
🟢 उत्तर: ② 104.5°
📘 परीक्षा: JEE Advanced 2015 | पेपर: 1 | IIT Bombay
🔵 प्रश्न 8:
sp³ संकरण में कितनी σ बन्ध बनती हैं?
🔴 ① 2
🟢 ② 3
🟡 ③ 4
🔵 ④ 6
🟢 उत्तर: ③ 4
📘 परीक्षा: JEE Advanced 2011 | पेपर: 1 | IIT Kanpur
🔵 प्रश्न 9:
CO अणु में बन्ध क्रम क्या है?
🔴 ① 2
🟢 ② 3
🟡 ③ 2.5
🔵 ④ 1
🟢 उत्तर: ② 3
📘 परीक्षा: JEE Advanced 2017 | पेपर: 1 | IIT Madras
🔵 प्रश्न 10:
O₂ अणु का बन्ध क्रम क्या है?
🔴 ① 1
🟢 ② 2
🟡 ③ 3
🔵 ④ 2.5
🟢 उत्तर: ② 2
📘 परीक्षा: JEE Advanced 2014 | पेपर: 1 | IIT Kharagpur
🔵 प्रश्न 11:
N₂ अणु का बन्ध क्रम है —
🔴 ① 1
🟢 ② 2
🟡 ③ 3
🔵 ④ 4
🟢 उत्तर: ③ 3
📘 परीक्षा: JEE Advanced 2016 | पेपर: 1 | IIT Guwahati
🔵 प्रश्न 12:
O₂⁻ आयन में बन्ध क्रम कितना होगा?
🔴 ① 2
🟢 ② 1.5
🟡 ③ 2.5
🔵 ④ 3
🟢 उत्तर: ② 1.5
📘 परीक्षा: JEE Advanced 2015 | पेपर: 1 | IIT Bombay
🔵 प्रश्न 13:
sp² संकरण में अणु का आकार कैसा होता है?
🔴 ① चतुष्फलीय
🟢 ② त्रिकोणीय समतल
🟡 ③ रेखीय
🔵 ④ मुड़ा हुआ
🟢 उत्तर: ② त्रिकोणीय समतल
📘 परीक्षा: JEE Advanced 2018 | पेपर: 1 | IIT Kanpur
🔵 प्रश्न 14:
NH₃ में नाइट्रोजन की संकरण अवस्था क्या है?
🔴 ① sp
🟢 ② sp²
🟡 ③ sp³
🔵 ④ dsp²
🟢 उत्तर: ③ sp³
📘 परीक्षा: JEE Advanced 2013 | पेपर: 1 | IIT Bombay
🔵 प्रश्न 15:
CO₃²⁻ आयन का आकार कैसा होता है?
🔴 ① त्रिकोणीय समतल
🟢 ② चतुष्फलीय
🟡 ③ रेखीय
🔵 ④ पिरामिडीय
🟢 उत्तर: ① त्रिकोणीय समतल
📘 परीक्षा: JEE Advanced 2019 | पेपर: 1 | IIT Delhi
🔵 प्रश्न 16:
कौन-सा अणु रेखीय नहीं है?
🔴 ① CO₂
🟢 ② BeCl₂
🟡 ③ NO₂
🔵 ④ C₂H₂
🟢 उत्तर: ③ NO₂
📘 परीक्षा: JEE Advanced 2014 | पेपर: 1 | IIT Kharagpur
🔵 प्रश्न 17:
PCl₅ का आण्विक आकार क्या है?
🔴 ① चतुष्फलीय
🟢 ② त्रिकोणीय द्विपिरामिडीय
🟡 ③ अष्टफलीय
🔵 ④ वर्गाकार समतल
🟢 उत्तर: ② त्रिकोणीय द्विपिरामिडीय
📘 परीक्षा: JEE Advanced 2016 | पेपर: 1 | IIT Guwahati
🔵 प्रश्न 18:
NO₃⁻ आयन का आण्विक आकार क्या है?
🔴 ① त्रिकोणीय समतल
🟢 ② चतुष्फलीय
🟡 ③ रेखीय
🔵 ④ पिरामिडीय
🟢 उत्तर: ① त्रिकोणीय समतल
📘 परीक्षा: JEE Advanced 2014 | पेपर: 1 | IIT Kharagpur
🔵 प्रश्न 19:
कौन-सा अणु ध्रुवीय (polar) है?
🔴 ① CO₂
🟢 ② H₂O
🟡 ③ BF₃
🔵 ④ BeCl₂
🟢 उत्तर: ② H₂O
📘 परीक्षा: JEE Advanced 2013 | पेपर: 1 | IIT Bombay
🔵 प्रश्न 20:
हाइड्रोजन बन्धन किसके बीच होता है?
🔴 ① दो हाइड्रोजन परमाणुओं में
🟢 ② हाइड्रोजन एवं अत्यधिक विद्युतऋणात्मक परमाणु (N, O, F) में
🟡 ③ किसी भी दो अधातुओं में
🔵 ④ धातु एवं अधातु में
🟢 उत्तर: ②
📘 परीक्षा: JEE Advanced 2016 | पेपर: 1 | IIT Guwahati
🔵 प्रश्न 21:
CO अणु में किस प्रकार का बन्ध पाया जाता है?
🔴 ① एकल सहसंयोजक
🟢 ② त्रिक बन्ध
🟡 ③ द्विक बन्ध
🔵 ④ आयनिक बन्ध
🟢 उत्तर: ② त्रिक बन्ध
📘 परीक्षा: JEE Advanced 2011 | पेपर: 1 | IIT Kanpur
🔵 प्रश्न 22:
O₃ अणु का आकार कैसा होता है?
🔴 ① रेखीय
🟢 ② मुड़ा हुआ (bent)
🟡 ③ त्रिकोणीय
🔵 ④ चतुष्फलीय
🟢 उत्तर: ② मुड़ा हुआ
📘 परीक्षा: JEE Advanced 2015 | पेपर: 1 | IIT Bombay
🔵 प्रश्न 23:
BeCl₂ अणु का आकार कैसा है?
🔴 ① रेखीय
🟢 ② त्रिकोणीय
🟡 ③ चतुष्फलीय
🔵 ④ पिरामिडीय
🟢 उत्तर: ① रेखीय
📘 परीक्षा: JEE Advanced 2013 | पेपर: 1 | IIT Bombay
🔵 प्रश्न 24:
कौन-सा अणु अणु-कक्ष सिद्धांत (MOT) के अनुसार चुम्बकीय है?
🔴 ① N₂
🟢 ② O₂
🟡 ③ F₂
🔵 ④ CO
🟢 उत्तर: ② O₂
📘 परीक्षा: JEE Advanced 2017 | पेपर: 1 | IIT Madras
🔵 प्रश्न 25:
N₂⁺ आयन का बन्ध क्रम क्या होगा?
🔴 ① 2
🟢 ② 2.5
🟡 ③ 3
🔵 ④ 1.5
🟢 उत्तर: ② 2.5
📘 परीक्षा: JEE Advanced 2018 | पेपर: 1 | IIT Kanpur
🔵 प्रश्न 26:
कौन-सा अणु परमाण्विक (paramagnetic) है?
🔴 ① N₂
🟢 ② O₂
🟡 ③ CO
🔵 ④ F₂
🟢 उत्तर: ② O₂
📘 परीक्षा: JEE Advanced 2014 | पेपर: 1 | IIT Kharagpur
🔵 प्रश्न 27:
sp संकरण में बन्ध कोण कितना होता है?
🔴 ① 90°
🟢 ② 120°
🟡 ③ 109.5°
🔵 ④ 180°
🟢 उत्तर: ④ 180°
📘 परीक्षा: JEE Advanced 2019 | पेपर: 1 | IIT Delhi
🔵 प्रश्न 28:
CH₂=CH₂ (एथीन) में C की संकरण अवस्था है —
🔴 ① sp
🟢 ② sp²
🟡 ③ sp³
🔵 ④ dsp²
🟢 उत्तर: ② sp²
📘 परीक्षा: JEE Advanced 2015 | पेपर: 1 | IIT Bombay
🔵 प्रश्न 29:
कौन-सा यौगिक π-बन्ध रखता है?
🔴 ① H₂
🟢 ② O₂
🟡 ③ Cl₂
🔵 ④ NaCl
🟢 उत्तर: ② O₂
📘 परीक्षा: JEE Advanced 2012 | पेपर: 1 | IIT Delhi
🔵 प्रश्न 30:
कौन-सा बन्ध σ (sigma) नहीं है?
🔴 ① C–H
🟢 ② C=C (दूसरा बन्ध)
🟡 ③ N–H
🔵 ④ H–H
🟢 उत्तर: ② C=C (दूसरा बन्ध π है)
📘 परीक्षा: JEE Advanced 2018 | पेपर: 1 | IIT Kanpur
🔵 प्रश्न 31:
H₂ अणु में कितने इलेक्ट्रॉन बन्धन कक्ष में होते हैं?
🔴 ① 1
🟢 ② 2
🟡 ③ 4
🔵 ④ 0
🟢 उत्तर: ② 2
📘 परीक्षा: JEE Advanced 2016 | पेपर: 1 | IIT Guwahati
🔵 प्रश्न 32:
कौन-सा यौगिक VSEPR सिद्धांत से नहीं समझाया जा सकता?
🔴 ① PCl₅
🟢 ② SF₆
🟡 ③ NO
🔵 ④ H₂O
🟢 उत्तर: ③ NO (विषम इलेक्ट्रॉन वाला)
📘 परीक्षा: JEE Advanced 2011 | पेपर: 1 | IIT Kanpur
🔵 प्रश्न 33:
CO₂ और H₂O में से किसमें द्विध्रुव आघूर्ण (dipole moment) शून्य है?
🔴 ① केवल CO₂
🟢 ② केवल H₂O
🟡 ③ दोनों में
🔵 ④ किसी में नहीं
🟢 उत्तर: ① केवल CO₂
📘 परीक्षा: JEE Advanced 2019 | पेपर: 1 | IIT Delhi
🔵 प्रश्न 34:
कौन-सा यौगिक सहसंयोजक और समन्वय बन्ध दोनों रखता है?
🔴 ① H₂O
🟢 ② NH₄⁺
🟡 ③ CH₄
🔵 ④ O₂
🟢 उत्तर: ② NH₄⁺
📘 परीक्षा: JEE Advanced 2017 | पेपर: 1 | IIT Madras
————————————————————————————————————————————————————————————————————————————
मॉडल प्रश्न पत्र, अभ्यास
🧪 प्रश्न 1 से 25 (NEET-स्तर)
🔵 प्रश्न 1:
आयनिक बन्धन किसके बीच बनता है?
🔴 ① दो अधातुओं के बीच
🟢 ② धातु और अधातु के बीच
🟡 ③ दो धातुओं के बीच
🔵 ④ समान तत्त्वों के बीच
🟢 उत्तर: ② धातु और अधातु के बीच
🎯 कठिनाई: NEET
🔵 प्रश्न 2:
सहसंयोजक बन्धन किस सिद्धांत से समझाया जाता है?
🔴 ① आयन सिद्धांत
🟢 ② साझा इलेक्ट्रॉन सिद्धांत
🟡 ③ वैद्युतस्थैतिक सिद्धांत
🔵 ④ वान डर वाल्स सिद्धांत
🟢 उत्तर: ② साझा इलेक्ट्रॉन सिद्धांत
🎯 कठिनाई: NEET
🔵 प्रश्न 3:
आयनिक यौगिकों की विशेषता है —
🔴 ① ऊष्मा चालकता कम
🟢 ② ऊष्मा चालकता अधिक
🟡 ③ विद्युत चालकता केवल ठोस अवस्था में
🔵 ④ वाष्पशीलता अधिक
🟢 उत्तर: ② ऊष्मा चालकता अधिक
🎯 कठिनाई: NEET
🔵 प्रश्न 4:
H₂ अणु में कौन-सा बन्धन पाया जाता है?
🔴 ① आयनिक
🟢 ② एकल सहसंयोजक
🟡 ③ द्वि-सहसंयोजक
🔵 ④ त्रि-सहसंयोजक
🟢 उत्तर: ② एकल सहसंयोजक
🎯 कठिनाई: NEET
🔵 प्रश्न 5:
NH₃ अणु में नाइट्रोजन की संयोजकता कितनी होती है?
🔴 ① 1
🟢 ② 2
🟡 ③ 3
🔵 ④ 5
🟢 उत्तर: ③ 3
🎯 कठिनाई: NEET
🔵 प्रश्न 6:
CO₂ अणु में कितने π-बन्धन होते हैं?
🔴 ① 1
🟢 ② 2
🟡 ③ 3
🔵 ④ कोई नहीं
🟢 उत्तर: ② 2
🎯 कठिनाई: NEET
🔵 प्रश्न 7:
CH₄ अणु का आकार कैसा होता है?
🔴 ① त्रिकोणीय समतल
🟢 ② चतुष्फलीय
🟡 ③ रेखीय
🔵 ④ त्रिकोणीय द्विपिरमिडल
🟢 उत्तर: ② चतुष्फलीय
🎯 कठिनाई: NEET
🔵 प्रश्न 8:
NH₃ अणु का आकार —
🔴 ① चतुष्फलीय
🟢 ② त्रिकोणीय पिरमिडल
🟡 ③ रेखीय
🔵 ④ त्रिकोणीय समतल
🟢 उत्तर: ② त्रिकोणीय पिरमिडल
🎯 कठिनाई: NEET
🔵 प्रश्न 9:
H₂O अणु का कोण लगभग कितना होता है?
🔴 ① 104.5°
🟢 ② 109.5°
🟡 ③ 120°
🔵 ④ 90°
🟢 उत्तर: ① 104.5°
🎯 कठिनाई: NEET
🔵 प्रश्न 10:
VSEPR सिद्धांत का पूरा नाम क्या है?
🔴 ① Valence Shell Electron Pair Repulsion
🟢 ② Valence Shell Electron Potential Radius
🟡 ③ Variable Shell Energy Power Relation
🔵 ④ Valency State Electron Point Rule
🟢 उत्तर: ① Valence Shell Electron Pair Repulsion
🎯 कठिनाई: NEET
🔵 प्रश्न 11:
CO में बन्धनों की संख्या —
🔴 ① 1
🟢 ② 2
🟡 ③ 3
🔵 ④ 4
🟢 उत्तर: ③ 3
🎯 कठिनाई: NEET
🔵 प्रश्न 12:
σ-बन्धन और π-बन्धन में क्या अन्तर है?
🔴 ① σ मजबूत, π कमजोर
🟢 ② π मजबूत, σ कमजोर
🟡 ③ दोनों समान
🔵 ④ कोई नहीं
🟢 उत्तर: ① σ मजबूत, π कमजोर
🎯 कठिनाई: NEET
🔵 प्रश्न 13:
O₂ अणु में कुल कितने बन्धन हैं?
🔴 ① 1
🟢 ② 2
🟡 ③ 3
🔵 ④ 4
🟢 उत्तर: ② 2
🎯 कठिनाई: NEET
🔵 प्रश्न 14:
NO अणु में बन्धन क्रम (Bond Order) कितना है?
🔴 ① 2
🟢 ② 2.5
🟡 ③ 3
🔵 ④ 1.5
🟢 उत्तर: ② 2.5
🎯 कठिनाई: NEET
🔵 प्रश्न 15:
किस अणु में समन्वय बन्धन पाया जाता है?
🔴 ① CO
🟢 ② HCl
🟡 ③ NaCl
🔵 ④ CH₄
🟢 उत्तर: ① CO
🎯 कठिनाई: NEET
🔵 प्रश्न 16:
BF₃ अणु का आकार —
🔴 ① चतुष्फलीय
🟢 ② त्रिकोणीय समतल
🟡 ③ रेखीय
🔵 ④ चतुर्भुजीय
🟢 उत्तर: ② त्रिकोणीय समतल
🎯 कठिनाई: NEET
🔵 प्रश्न 17:
ClF₃ अणु का आकार —
🔴 ① रेखीय
🟢 ② T-आकार
🟡 ③ त्रिकोणीय द्विपिरमिडल
🔵 ④ अष्टफलीय
🟢 उत्तर: ② T-आकार
🎯 कठिनाई: NEET
🔵 प्रश्न 18:
XeF₂ अणु का आकार —
🔴 ① रेखीय
🟢 ② त्रिकोणीय
🟡 ③ पिरमिडल
🔵 ④ चतुष्फलीय
🟢 उत्तर: ① रेखीय
🎯 कठिनाई: NEET
🔵 प्रश्न 19:
NH₄⁺ आयन में कुल σ-बन्धनों की संख्या —
🔴 ① 3
🟢 ② 4
🟡 ③ 5
🔵 ④ 2
🟢 उत्तर: ② 4
🎯 कठिनाई: NEET
🔵 प्रश्न 20:
VSEPR सिद्धांत के अनुसार BeCl₂ का आकार —
🔴 ① रेखीय
🟢 ② त्रिकोणीय
🟡 ③ चतुष्फलीय
🔵 ④ पिरमिडल
🟢 उत्तर: ① रेखीय
🎯 कठिनाई: NEET
🔵 प्रश्न 21:
NH₃ और H₂O में कोण कम होने का कारण —
🔴 ① संयोजकता में अंतर
🟢 ② अकेले इलेक्ट्रॉन युग्मों की उपस्थिति
🟡 ③ परमाणु द्रव्यमान
🔵 ④ कोई नहीं
🟢 उत्तर: ② अकेले इलेक्ट्रॉन युग्मों की उपस्थिति
🎯 कठिनाई: NEET
🔵 प्रश्न 22:
ऑक्सीजन अणु का बन्धन क्रम क्या है?
🔴 ① 1
🟢 ② 2
🟡 ③ 3
🔵 ④ 1.5
🟢 उत्तर: ② 2
🎯 कठिनाई: NEET
🔵 प्रश्न 23:
N₂ अणु में कुल कितने बन्धन हैं?
🔴 ① 1
🟢 ② 2
🟡 ③ 3
🔵 ④ 4
🟢 उत्तर: ③ 3
🎯 कठिनाई: NEET
🔵 प्रश्न 24:
कौन-सा अणु द्विचुम्बकीय (Paramagnetic) है?
🔴 ① O₂
🟢 ② N₂
🟡 ③ CO₂
🔵 ④ H₂
🟢 उत्तर: ① O₂
🎯 कठिनाई: NEET
🔵 प्रश्न 25:
NO₂ अणु का आकार क्या है?
🔴 ① रेखीय
🟢 ② कोणीय
🟡 ③ चतुष्फलीय
🔵 ④ समतल
🟢 उत्तर: ② कोणीय
🎯 कठिनाई: NEET
⚙ प्रश्न 26 से 40 (JEE Main-स्तर)
🔵 प्रश्न 26:
sp³ संकरण में बन्ध कोण कितना होता है?
🔴 ① 90°
🟢 ② 109.5°
🟡 ③ 120°
🔵 ④ 180°
🟢 उत्तर: ② 109.5°
🎯 कठिनाई: JEE Main
🔵 प्रश्न 27:
BF₃ अणु में बोरॉन परमाणु किस प्रकार का संकरण दिखाता है?
🔴 ① sp³
🟢 ② sp²
🟡 ③ sp
🔵 ④ dsp³
🟢 उत्तर: ② sp²
🎯 कठिनाई: JEE Main
🔵 प्रश्न 28:
BeCl₂ अणु में किस प्रकार का संकरण होता है?
🔴 ① sp³
🟢 ② sp
🟡 ③ sp²
🔵 ④ dsp³
🟢 उत्तर: ② sp
🎯 कठिनाई: JEE Main
🔵 प्रश्न 29:
PCl₅ अणु का आकार क्या है?
🔴 ① चतुष्फलीय
🟢 ② त्रिकोणीय द्विपिरमिडल
🟡 ③ अष्टफलीय
🔵 ④ रेखीय
🟢 उत्तर: ② त्रिकोणीय द्विपिरमिडल
🎯 कठिनाई: JEE Main
🔵 प्रश्न 30:
SF₆ अणु का आकार क्या है?
🔴 ① चतुष्फलीय
🟢 ② अष्टफलीय
🟡 ③ त्रिकोणीय द्विपिरमिडल
🔵 ④ रेखीय
🟢 उत्तर: ② अष्टफलीय
🎯 कठिनाई: JEE Main
🔵 प्रश्न 31:
NH₃ में नाइट्रोजन का संकरण प्रकार है —
🔴 ① sp²
🟢 ② sp³
🟡 ③ sp
🔵 ④ dsp²
🟢 उत्तर: ② sp³
🎯 कठिनाई: JEE Main
🔵 प्रश्न 32:
C₂H₂ अणु में किस प्रकार का संकरण होता है?
🔴 ① sp³
🟢 ② sp²
🟡 ③ sp
🔵 ④ dsp²
🟢 उत्तर: ③ sp
🎯 कठिनाई: JEE Main
🔵 प्रश्न 33:
C₂H₄ अणु में कार्बन परमाणु किस संकरण में होता है?
🔴 ① sp³
🟢 ② sp²
🟡 ③ sp
🔵 ④ dsp³
🟢 उत्तर: ② sp²
🎯 कठिनाई: JEE Main
🔵 प्रश्न 34:
C₂H₆ अणु में कार्बन का संकरण प्रकार —
🔴 ① sp²
🟢 ② sp³
🟡 ③ sp
🔵 ④ dsp²
🟢 उत्तर: ② sp³
🎯 कठिनाई: JEE Main
🔵 प्रश्न 35:
CO₂ अणु का संकरण प्रकार —
🔴 ① sp
🟢 ② sp²
🟡 ③ sp³
🔵 ④ dsp³
🟢 उत्तर: ① sp
🎯 कठिनाई: JEE Main
🔵 प्रश्न 36:
π-बन्धन किस कक्षा के अधिव्यापन से बनता है?
🔴 ① s–s
🟢 ② p–p पार्श्व अधिव्यापन
🟡 ③ s–p अग्र अधिव्यापन
🔵 ④ d–p अधिव्यापन
🟢 उत्तर: ② p–p पार्श्व अधिव्यापन
🎯 कठिनाई: JEE Main
🔵 प्रश्न 37:
σ-बन्धन में अधिव्यापन किस प्रकार का होता है?
🔴 ① पार्श्व
🟢 ② अग्र
🟡 ③ विकेन्द्रित
🔵 ④ कोई नहीं
🟢 उत्तर: ② अग्र
🎯 कठिनाई: JEE Main
🔵 प्रश्न 38:
NH₄⁺ में नाइट्रोजन का संकरण क्या है?
🔴 ① sp
🟢 ② sp³
🟡 ③ sp²
🔵 ④ dsp³
🟢 उत्तर: ② sp³
🎯 कठिनाई: JEE Main
🔵 प्रश्न 39:
ClF₃ अणु में अकेले इलेक्ट्रॉन युग्मों की संख्या कितनी है?
🔴 ① 1
🟢 ② 2
🟡 ③ 3
🔵 ④ 4
🟢 उत्तर: ② 2
🎯 कठिनाई: JEE Main
🔵 प्रश्न 40:
कौन-सा अणु द्विचुम्बकीय है?
🔴 ① N₂
🟢 ② O₂
🟡 ③ CO₂
🔵 ④ H₂
🟢 उत्तर: ② O₂
🎯 कठिनाई: JEE Main
🚀 प्रश्न 41 से 50 (JEE Advanced-स्तर)
🔵 प्रश्न 41:
NO अणु का बन्धन क्रम (Bond Order) क्या है?
🔴 ① 2
🟢 ② 2.5
🟡 ③ 3
🔵 ④ 1.5
🟢 उत्तर: ② 2.5
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 42:
O₂⁻ आयन का बन्धन क्रम क्या है?
🔴 ① 1
🟢 ② 1.5
🟡 ③ 2
🔵 ④ 2.5
🟢 उत्तर: ② 1.5
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 43:
N₂⁺ आयन का बन्धन क्रम कितना होगा?
🔴 ① 3
🟢 ② 2.5
🟡 ③ 2
🔵 ④ 1.5
🟢 उत्तर: ② 2.5
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 44:
C₂ अणु का बन्धन क्रम कितना है?
🔴 ① 1
🟢 ② 2
🟡 ③ 3
🔵 ④ 1.5
🟢 उत्तर: ② 2
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 45:
किस अणु में बन्धन क्रम सर्वाधिक है?
🔴 ① O₂
🟢 ② N₂
🟡 ③ F₂
🔵 ④ C₂
🟢 उत्तर: ② N₂
🎯 कठिनाई: JEE Advanced
🔵 прश्न 46:
यदि किसी अणु का बन्धन क्रम घटता है तो उसकी स्थिरता —
🔴 ① बढ़ती है
🟢 ② घटती है
🟡 ③ समान रहती है
🔵 ④ पहले बढ़ती फिर घटती
🟢 उत्तर: ② घटती है
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 47:
σ और π-बन्धनों की संख्या CO₂ में कितनी है?
🔴 ① 2σ, 2π
🟢 ② 2σ, 4π
🟡 ③ 4σ, 2π
🔵 ④ 1σ, 1π
🟢 उत्तर: ① 2σ, 2π
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 48:
किस अणु में द्विचुम्बकीयता (Paramagnetism) पाई जाती है?
🔴 ① N₂
🟢 ② O₂
🟡 ③ F₂
🔵 ④ CO₂
🟢 उत्तर: ② O₂
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 49:
π-बन्धन बनने के लिए किन कक्षाओं का पार्श्व अधिव्यापन आवश्यक है?
🔴 ① s–s
🟢 ② p–p
🟡 ③ s–p
🔵 ④ d–p
🟢 उत्तर: ② p–p
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 50:
किस अणु में केंद्रीय परमाणु का संकरण dsp² होता है?
🔴 ① XeF₂
🟢 ② [Ni(CN)₄]²⁻
🟡 ③ PCl₅
🔵 ④ SF₆
🟢 उत्तर: ② [Ni(CN)₄]²⁻
🎯 कठिनाई: JEE Advanced
————————————————————————————————————————————————————————————————————————————
