Class 11 : Chemistry (In Hindi) – 3. तत्वों का वर्गीकरण और गुणधर्मों में आवर्तिता
पाठ का विश्लेषण एवं विवेचन
🔵 प्रस्तावना
मानव ने प्रारम्भ से ही विभिन्न पदार्थों को पहचाना और उनका उपयोग किया। 🌟 परन्तु पदार्थ अनेक प्रकार के होते हैं और उनके गुण भी भिन्न होते हैं। इस विविधता को व्यवस्थित ढंग से समझने के लिए तत्वों का वर्गीकरण आवश्यक हुआ। यही वर्गीकरण आगे चलकर आवर्त सारणी के रूप में विकसित हुआ।
🟢 डॉबराइनर की त्रिक व्यवस्था (1829)
📍 डॉबराइनर ने तत्वों को त्रिकों में बाँटा।
✏ उदाहरण: कैल्शियम, स्ट्रॉन्शियम, बेरियम।
✔ किसी भी त्रिक में मध्य तत्व का परमाणु द्रव्यमान लगभग पहले और तीसरे तत्व के परमाणु द्रव्यमान का औसत होता है।
💡 यह प्रारम्भिक प्रयास था, परन्तु सीमित तत्वों पर ही लागू हुआ।
🔴 न्यूलैंड का अष्टक नियम (1864)
📍 न्यूलैंड ने पाया कि यदि तत्वों को बढ़ते परमाणु द्रव्यमान के अनुसार व्यवस्थित करें तो प्रत्येक आठवाँ तत्व पहले से मिलता-जुलता गुण दिखाता है।
✨ उदाहरण: Li, Be, B, C, N, O, F, (Na)।
✔ यह संगीत के सप्तक जैसा प्रतीत होता था।
❌ परन्तु यह केवल कैल्शियम तक सही बैठा; उसके बाद असफल हो गया।
🟡 मेंडलीफ की आवर्त सारणी (1869)
📍 दिमित्री मेंडलीफ ने तत्वों को उनके परमाणु द्रव्यमान के अनुसार व्यवस्थित किया।
📌 मुख्य विशेषताएँ:
प्रत्येक 8वें तत्व के गुण समान।
उन्होंने 63 ज्ञात तत्वों को सारणी में रखा।
कुछ स्थान खाली छोड़े और भविष्य के तत्वों की भविष्यवाणी की (जैसे एकलुमिनियम = गैलियम)।
✔ यह भविष्यवाणियाँ सही सिद्ध हुईं।
❌ सीमाएँ:
हाइड्रोजन की स्थिति स्पष्ट नहीं।
समस्थानिकों का स्थान स्पष्ट नहीं।
परमाणु द्रव्यमान पर आधारित होने से कई विसंगतियाँ उत्पन्न हुईं।
🔵 आधुनिक आवर्त नियम (मोज़ली, 1913)
📍 मोज़ली ने परमाणु क्रमांक का विचार दिया।
✔ आधुनिक आवर्त नियम: “तत्वों के गुण उनके परमाणु क्रमांक के आवर्ती फलन हैं।”
👉 अब तत्वों को परमाणु क्रमांक के आधार पर व्यवस्थित किया गया।
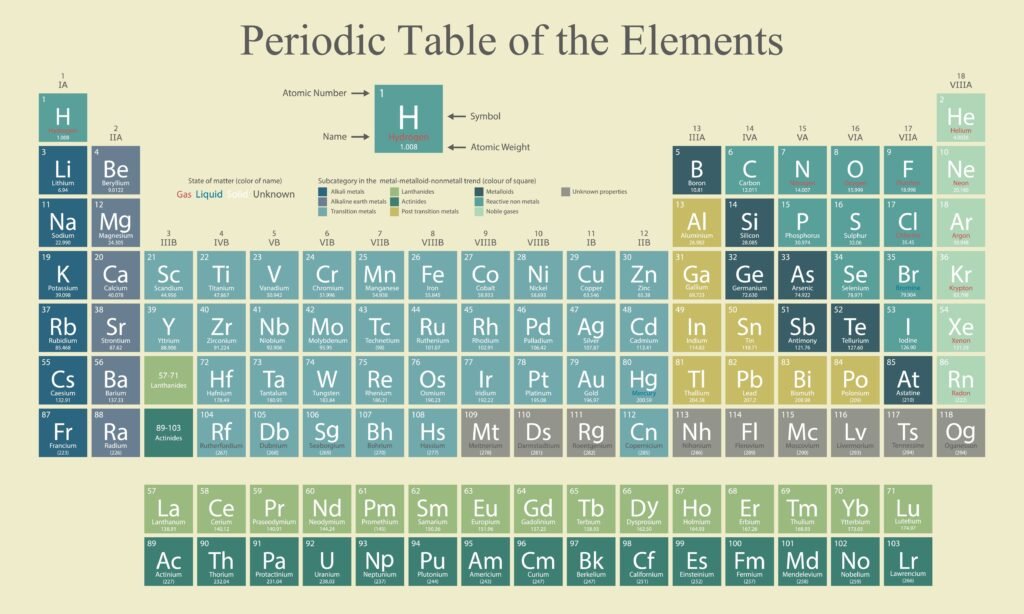
🟢 आधुनिक आवर्त सारणी की रचना
📍 लम्बवत स्तम्भ = समूह, क्षैतिज पंक्तियाँ = आवर्त।
🌟 विशेषताएँ:
कुल 18 समूह और 7 आवर्त।
समान समूह के तत्वों के रासायनिक गुण समान।
धातु, अधातु और उपधातु की स्पष्ट स्थिति।
संक्रमण और अंतःसंक्रमण तत्वों का अलग वर्गीकरण।
🔴 आवर्तता में गुणधर्म
📌 यह वह आवर्ती प्रवृत्ति है जिसमें किसी गुणधर्म का मान तत्वों में क्रम से पुनः प्रकट होता है।
🌟 प्रमुख आवर्ती गुणधर्म:
परमाणु त्रिज्या
समूह में ऊपर से नीचे जाने पर बढ़ती है (नये आवरण जुड़ते हैं)।
आवर्त में बाएँ से दाएँ जाने पर घटती है (नाभिकीय आकर्षण बढ़ता है)।
आयनन ऊर्जा
किसी परमाणु से इलेक्ट्रॉन हटाने के लिए आवश्यक ऊर्जा।
समूह में नीचे जाने पर घटती है।
आवर्त में बाएँ से दाएँ जाने पर बढ़ती है।
वैद्युत ऋणात्मकता
किसी परमाणु की इलेक्ट्रॉन को आकर्षित करने की क्षमता।
आवर्त में बढ़ती है, समूह में घटती है।
इलेक्ट्रॉन अभिलाषा
परमाणु में इलेक्ट्रॉन जुड़ने पर मुक्त ऊर्जा।
आवर्त में बढ़ती है, समूह में घटती है।
धात्विक तथा अधात्विक चरित्र
समूह में धात्विक चरित्र बढ़ता है।
आवर्त में अधात्विक चरित्र बढ़ता है।
🟡 विशेष महत्व
✔ आवर्त सारणी तत्वों का “नक्शा” है।
✔ इससे अज्ञात तत्वों के गुणों की भविष्यवाणी सम्भव।
✔ यह रासायनिक बन्धन, अभिक्रियाशीलता और यौगिकों के स्वरूप को समझने का आधार है।
🔹 II. पाठ सारांश
📌 तत्वों का वर्गीकरण उनकी समानता और गुणों के आधार पर किया गया।
📌 डॉबराइनर की त्रिक व्यवस्था पहला प्रयास था।
📌 न्यूलैंड ने अष्टक नियम दिया पर यह सीमित रहा।
📌 मेंडलीफ की आवर्त सारणी ने परमाणु द्रव्यमान को आधार बनाया और भविष्य के तत्वों की भविष्यवाणी की।
📌 मोज़ली ने आधुनिक आवर्त नियम दिया – परमाणु क्रमांक पर आधारित।
📌 आधुनिक आवर्त सारणी में 18 समूह और 7 आवर्त हैं।
📌 आवर्तता में प्रमुख गुणधर्म: परमाणु त्रिज्या, आयनन ऊर्जा, वैद्युत ऋणात्मकता, इलेक्ट्रॉन अभिलाषा और धात्विक/अधात्विक चरित्र।
📌 यह सारणी रसायन विज्ञान की सम्पूर्ण संरचना की कुंजी है।
🔹 III. त्वरित पुनरावलोकन
📝
✔ तत्वों का वर्गीकरण आवश्यक था ताकि विविधता को समझा जा सके।
✔ डॉबराइनर, न्यूलैंड, मेंडलीफ ने प्रारम्भिक प्रयास किये।
✔ मोज़ली ने परमाणु क्रमांक को आधार बनाकर आधुनिक आवर्त नियम दिया।
✔ आधुनिक सारणी में 18 समूह और 7 आवर्त हैं।
✔ आवर्तता के गुणधर्म: त्रिज्या, आयनन ऊर्जा, वैद्युत ऋणात्मकता, इलेक्ट्रॉन अभिलाषा।
✔ यह सारणी तत्वों के गुणों और अभिक्रियाओं का मार्गदर्शन करती है।
————————————————————————————————————————————————————————————————————————————
पाठ्यपुस्त के प्रश्न
🔵 प्रश्न 3.1:
आवर्त सारणी में व्यवस्था का भौतिक आधार क्या है?
🟢 उत्तर:
➡ तत्वों की व्यवस्था का भौतिक आधार परमाणु क्रमांक (Atomic Number) है।
➡ आधुनिक आवर्त सारणी में तत्वों को उनके बढ़ते परमाणु क्रमांक के अनुसार रखा गया है।
➡ यह परमाणु क्रमांक इलेक्ट्रॉनों की संख्या को दर्शाता है, जिससे उनके गुणधर्मों में आवर्तिता आती है।
🔵 प्रश्न 3.2:
मेंडलीफ ने किस महत्वपूर्ण गुणधर्म को अपनी आवर्त सारणी में तत्वों के वर्गीकरण का आधार बनाया था? उस आधार का उल्लेख करें।
🟢 उत्तर:
➡ मेंडलीफ ने तत्वों का वर्गीकरण परमाणु द्रव्यमान (Atomic Mass) के आधार पर किया।
➡ उन्होंने कहा — “तत्वों के गुणधर्म उनके परमाणु द्रव्यमान का आवर्ती फलन हैं।”
➡ इसलिए उनकी सारणी में तत्वों को बढ़ते परमाणु द्रव्यमान के अनुसार रखा गया।
🔵 प्रश्न 3.3:
मेंडलीफ की आवर्त सारणी और आधुनिक आवर्त नियम में भौतिक आधार में क्या अंतर है?
🟢 उत्तर:
बिंदु मेंडलीफ की आवर्त सारणी आधुनिक आवर्त सारणी
आधार परमाणु द्रव्यमान परमाणु क्रमांक
आवर्त नियम गुणधर्म परमाणु द्रव्यमान का फलन हैं गुणधर्म परमाणु क्रमांक का फलन हैं
त्रुटियाँ कुछ तत्वों की स्थिति गलत त्रुटियाँ समाप्त
🔵 प्रश्न 3.4:
कक्षा संख्याओं के आधार पर एक चित्र बनाइए जिसमें आवर्त सारणी के खण्डों का 32 खानों वाला चित्र हो।
🟢 उत्तर:
➡ आधुनिक आवर्त सारणी को s, p, d, f खण्डों में बाँटा गया है:
s-खंड: समूह 1 और 2
p-खंड: समूह 13 से 18
d-खंड: समूह 3 से 12
f-खंड: लैन्थेनाइड्स और एक्टिनाइड्स
➡ कुल 7 आवर्त और 18 समूह हैं।
➡ यदि आप चित्र बनाना चाहें तो इसमें 32 खाने होंगे (7 आवर्त × समूह)।
🔵 प्रश्न 3.5:
ऑक्सीजन और गंधक के कौन से तत्व क्रम में Z=14 के निकट स्थित हैं?
🟢 उत्तर:
➡ Z = 14 (सिलिकॉन) के आसपास के तत्व हैं —
Z = 13 → एल्यूमिनियम (Al)
Z = 15 → फॉस्फोरस (P)
➡ इन तत्वों के गुणधर्म समान आवर्त में क्रमबद्ध हैं।
🔵 प्रश्न 3.6:
उस तत्व का परमाणु क्रमांक लिखिए, जो आवर्त सारणी में चौथे आवर्त और 17वें समूह में स्थित होता है।
🟢 उत्तर:
➡ चौथा आवर्त और 17वाँ समूह = क्लोरीन (Cl)
➡ परमाणु क्रमांक = 17
🔵 प्रश्न 3.7:
कौन से तत्व का नाम निम्नलिखित द्वारा दिया गया है —
(i) लैबोरेटरी प्रयोगशाला द्वारा
(ii) सोने जैसा रंग
🟢 उत्तर:
(i) लैबोरेटरी प्रयोगशाला द्वारा → लॉरेन्सियम (Lr)
(ii) सोने जैसा रंग → ऑरम (Aurum) → Au (स्वर्ण)
🔵 प्रश्न 3.8:
एक ही वर्ग में उपस्थित तत्वों के भौतिक और रासायनिक गुणधर्म समान क्यों होते हैं?
🟢 उत्तर:
➡ एक ही वर्ग (समूह) के तत्वों में समान संयोजक इलेक्ट्रॉन विन्यास होता है।
➡ समान संयोजक इलेक्ट्रॉन समान रासायनिक गुणधर्म उत्पन्न करते हैं।
🔵 प्रश्न 3.9:
‘परमाणु आकार’ और ‘आयनिक त्रिज्या’ से आप क्या समझते हैं?
🟢 उत्तर:
➡ परमाणु आकार (Atomic Size): नाभिक से बाहरी इलेक्ट्रॉन तक की दूरी।
➡ आयनिक त्रिज्या (Ionic Radius): जब परमाणु आयन बनता है तो उसकी त्रिज्या बदलती है।
धनायन (Cation): आकार घटता है।
ऋणायन (Anion): आकार बढ़ता है।
🔵 प्रश्न 3.10:
किस वर्ग या समूह में परमाणु आकार किस प्रकार परिवर्तित होता है?
🟢 उत्तर:
➡ आवर्त में बाएँ से दाएँ: आकार घटता है (नाभिकीय आवेश बढ़ता है)।
➡ समूह में ऊपर से नीचे: आकार बढ़ता है (नए आवरण जुड़ते हैं)।
🔵 प्रश्न 3.11:
समसंरचनात्मक प्रजातियों से आप क्या समझते हैं?
🟢 उत्तर:
➡ जिन आयनों में इलेक्ट्रॉनों की संख्या समान होती है उन्हें समसंरचनात्मक प्रजाति (Isoelectronic Species) कहते हैं।
➡ उदाहरण:
F⁻ (9+1=10 इलेक्ट्रॉन)
Ne (10 इलेक्ट्रॉन)
Mg²⁺ (12−2=10 इलेक्ट्रॉन)
➡ इन सबमें 10 इलेक्ट्रॉन हैं, इसलिए ये समसंरचनात्मक हैं।
🔵 प्रश्न 3.12:
निम्नलिखित प्रजातियों पर विचार करें:
N³⁻, O²⁻, F⁻, Na⁺, Mg²⁺, Al³⁺
(क) इनमें क्या समानता है?
(ख) इन्हें परमाणु क्रमांक के बढ़ते क्रम में व्यवस्थित कीजिए।
🟢 उत्तर:
(क) समानता: सभी में 10 इलेक्ट्रॉन हैं → समसंरचनात्मक प्रजातियाँ।
(ख) बढ़ते परमाणु क्रमांक में:
N (7) < O (8) < F (9) < Na (11) < Mg (12) < Al (13)
🔵 प्रश्न 3.13:
धनायन अपने जनक परमाणुओं से छोटे क्यों होते हैं और ऋणायन बड़े क्यों होते हैं?
🟢 उत्तर:
➡ धनायन (Cation): इलेक्ट्रॉन खोने से इलेक्ट्रॉन-इलेक्ट्रॉन प्रतिकर्षण घटता है → त्रिज्या घटती है।
➡ ऋणायन (Anion): इलेक्ट्रॉन प्राप्त करने से प्रतिकर्षण बढ़ता है → त्रिज्या बढ़ती है।
🔵 प्रश्न 3.14:
आयनन एन्थैल्पी और इलेक्ट्रॉन अभिग्रहण एन्थैल्पी को परिभाषित करें।
🟢 उत्तर:
➡ आयनन एन्थैल्पी:
परमाणु से 1 इलेक्ट्रॉन हटाने के लिए आवश्यक ऊर्जा।
उदाहरण:
M(g) → M⁺(g) + e⁻
➡ इलेक्ट्रॉन अभिग्रहण एन्थैल्पी:
परमाणु द्वारा इलेक्ट्रॉन ग्रहण करने पर उत्सर्जित ऊर्जा।
उदाहरण:
X(g) + e⁻ → X⁻(g)
🔵 प्रश्न 3.15:
हाइड्रोजन परमाणु में आधा अवशोषण में संक्रमणीय ऊर्जा (–2.18 × 10⁻¹⁸ J) है। परमाण्विक हाइड्रोजन को एक मोल के लिए J mol⁻¹ में परिवर्तित कीजिए।
🟢 उत्तर:
➡ एक परमाणु के लिए ऊर्जा = –2.18 × 10⁻¹⁸ J
➡ 1 mol में परमाणु = 6.022 × 10²³
✏ कुल ऊर्जा = (–2.18 × 10⁻¹⁸) × (6.022 × 10²³)
➡ = –1.31 × 10⁶ J mol⁻¹
✔ अतः परमाण्विक हाइड्रोजन की ऊर्जा = –1.31 × 10⁶ J mol⁻¹
🔵 प्रश्न 3.16:
दिए गए तत्वों के लिए प्रथम आयनन एन्थैल्पी का क्रम है:
Li < B < Be < C < O < N < F < Ne
(i) Be की ΔH₁, B से अधिक क्यों है?
(ii) O की ΔH₁, N से कम क्यों है?
🟢 उत्तर:
(i) Be में पूर्ण भरी हुई 2s² उपकक्षा है, जो स्थिर है → इलेक्ट्रॉन निकालना कठिन → ΔH₁ अधिक।
(ii) N में 2p³ आधी भरी उपकक्षा है, जो स्थिर है → O से ΔH₁ अधिक।
🔵 प्रश्न 3.17:
क्यों सोडियम की प्रथम आयनन एन्थैल्पी मैग्नीशियम से कम होती है, परन्तु दूसरी आयनन एन्थैल्पी मैग्नीशियम से अधिक होती है?
🟢 उत्तर:
➡ Na की पहली आयनन एन्थैल्पी कम क्योंकि वह 3s¹ से इलेक्ट्रॉन हटाता है।
➡ दूसरी बार Na⁺ से इलेक्ट्रॉन हटाना 2p⁶ से होगा, जो स्थिर है → अधिक ऊर्जा चाहिए।
➡ जबकि Mg⁺ में 3s¹ से हटाना सरल है → दूसरी एन्थैल्पी Na से कम।
🔵 प्रश्न 3.18:
किसी समूह में आयनन एन्थैल्पी ऊपर से नीचे घटती क्यों है?
🟢 उत्तर:
➡ नीचे जाते समय परमाणु आकार बढ़ता है।
➡ नाभिकीय आकर्षण घटता है।
➡ इलेक्ट्रॉन निकालना आसान → आयनन एन्थैल्पी घटती है।
🔵 प्रश्न 3.19:
समूह 13 के तत्वों की प्रथम आयनन एन्थैल्पी के मान (kJ mol⁻¹):
B = 801, Al = 577, Ga = 579, In = 558, Tl = 589
इनका क्रम समझाइए।
🟢 उत्तर:
➡ सामान्यतः नीचे जाने पर आकार बढ़ने से ΔH₁ घटनी चाहिए, परंतु
Ga और Tl में d- एवं f-ऑर्बिटल्स का खराब शील्डिंग प्रभाव नाभिकीय आवेश बढ़ा देता है → थोड़ा अपवाद।
✔ क्रम: B > Tl > Ga > Al > In
🔵 प्रश्न 3.20:
निम्नलिखित युग्मों में से किस तत्व की वैद्युतऋणात्मकता अधिक होगी?
(i) O या F
(ii) F या Cl
🟢 उत्तर:
(i) F > O
(ii) F > Cl
➡ क्योंकि फ्लोरीन का नाभिकीय आकर्षण सर्वाधिक है।
🔵 प्रश्न 3.21:
क्या किसी तत्व की वैद्युतऋणात्मकता और आयनन एन्थैल्पी के समान रुझान होते हैं?
🟢 उत्तर:
✔ हाँ, दोनों गुणधर्म आवर्त में बढ़ते हैं और समूह में घटते हैं।
➡ क्योंकि दोनों नाभिकीय आकर्षण पर निर्भर हैं।
🔵 प्रश्न 3.22:
इलेक्ट्रॉन अभिग्रहण एन्थैल्पी और वैद्युतऋणात्मकता में क्या अंतर है?
🟢 उत्तर:
गुणधर्म इलेक्ट्रॉन अभिग्रहण एन्थैल्पी वैद्युतऋणात्मकता
परिभाषा परमाणु द्वारा इलेक्ट्रॉन ग्रहण करने पर ऊर्जा परिवर्तन सहसंयोजक बंध में इलेक्ट्रॉन आकर्षण की प्रवृत्ति
इकाई kJ mol⁻¹ बिना इकाई
प्रकार मापनीय सापेक्ष
🔵 प्रश्न 3.23:
सभी निष्क्रिय गैसों की वैद्युतऋणात्मकता शून्य क्यों होती है?
🟢 उत्तर:
➡ निष्क्रिय गैसों के ऑर्बिटल पूर्ण भरे होते हैं।
➡ इलेक्ट्रॉन आकर्षण की प्रवृत्ति नहीं → वैद्युतऋणात्मकता = 0।
🔵 प्रश्न 3.24:
रासायनिक बंध बनाने की प्रवृत्ति परमाणु की किस ऊर्जा पर निर्भर करती है?
🟢 उत्तर:
➡ यह आयनन एन्थैल्पी और इलेक्ट्रॉन अभिग्रहण एन्थैल्पी दोनों पर निर्भर करती है।
➡ जो तत्व इलेक्ट्रॉन आसानी से खोता या प्राप्त करता है, उसकी बंध बनाने की प्रवृत्ति अधिक होती है।
🔵 प्रश्न 3.25:
कौन से तत्वों में प्रथम आयनन एन्थैल्पी न्यूनतम होगी?
🟢 उत्तर:
➡ क्षार धातुएँ (Group 1): Li, Na, K, Rb, Cs
➡ कारण: बाहरी परत में केवल 1 इलेक्ट्रॉन → निकालना सरल।
🔵 प्रश्न 3.26:
धातु और अधातु में मूलभूत अंतर बताइए।
🟢 उत्तर:
गुणधर्म धातु अधातु
आयनन एन्थैल्पी कम अधिक
इलेक्ट्रॉन अभिग्रहण एन्थैल्पी कम अधिक
विद्युत चालकता अधिक नगण्य
वैद्युतऋणात्मकता कम अधिक
🔵 प्रश्न 3.27:
आवर्त सारणी के उपयोग करते हुए बताइए —
(क) वह तत्व जिसका इलेक्ट्रॉन विन्यास समाप्त होता है ns²np⁵
(ख) वह तत्व जिसका इलेक्ट्रॉन विन्यास समाप्त होता है ns²np³
(ग) वह तत्व जो क्षार धातु है
(घ) वह तत्व जो क्षारीय पार्थिव धातु है
🟢 उत्तर:
(क) ns²np⁵ → हैलोजन (जैसे F, Cl)
(ख) ns²np³ → नाइट्रोजन समूह (जैसे N, P)
(ग) क्षार धातु → Li, Na, K
(घ) क्षारीय पार्थिव → Be, Mg, Ca
🔵 प्रश्न 3.28:
प्रथम वर्ग के तत्वों के लिए अभिक्रियाशीलता का क्रम इस प्रकार है —
Li < Na < K < Rb < Cs जबकि समूह 17 के तत्वों में क्रम है — F > Cl > Br > I
इसका कारण स्पष्ट कीजिए।
🟢 उत्तर:
➡ समूह 1 (क्षार धातु) में नीचे जाने पर परमाणु आकार बढ़ता है, आयनन एन्थैल्पी घटती है → इलेक्ट्रॉन खोना आसान → अभिक्रियाशीलता बढ़ती है।
➡ समूह 17 (हैलोजन) में नीचे जाने पर परमाणु आकार बढ़ता है, नाभिकीय आकर्षण घटता है → इलेक्ट्रॉन ग्रहण कठिन → अभिक्रियाशीलता घटती है।
🔵 प्रश्न 3.29:
s-, p-, d- और f- ब्लॉक के तत्वों का सामान्य बाह्य इलेक्ट्रॉनिक विन्यास लिखिए।
🟢 उत्तर:
ब्लॉक सामान्य विन्यास
s-ब्लॉक ns¹–²
p-ब्लॉक ns² np¹–⁶
d-ब्लॉक (n–1)d¹–¹⁰ ns⁰–²
f-ब्लॉक (n–2)f¹–¹⁴ (n–1)d⁰–¹ ns²
🔵 प्रश्न 3.30:
यदि किसी तत्व का बाह्य इलेक्ट्रॉनिक विन्यास ns² np¹ है, तो वह आवर्त सारणी के किस वर्ग में होगा?
यदि विन्यास (n–1)d² ns² है, तो वह किस ब्लॉक में होगा?
🟢 उत्तर:
➡ ns² np¹ → p-ब्लॉक (समूह 13)
➡ (n–1)d² ns² → d-ब्लॉक (समूह 4)
🔵 प्रश्न 3.31:
निम्नलिखित तत्वों के लिए ΔH₁ (kJ mol⁻¹), ΔH₂, और ΔH (एन्थैल्पी परिवर्तन) दिए गए हैं:
तत्व ΔH₁ ΔH₂ ΔH
I 520 7300 –60
II 419 3051 –48
III 1681 3374 –32
IV 1008 1846 –295
V 2372 5251 +48
VI 738 1451 –40
(क) सबसे कम अभिक्रियाशील धातु कौन?
(ख) सबसे अधिक अभिक्रियाशील धातु कौन?
(ग) सबसे अधिक अभिक्रियाशील अधातु कौन?
(घ) सबसे कम अभिक्रियाशील अधातु कौन?
🟢 उत्तर:
➡ सबसे कम अभिक्रियाशील धातु = V (ΔH धनात्मक → अभिक्रिया कठिन)
➡ सबसे अधिक अभिक्रियाशील धातु = II (कम ΔH₁ और ऋणात्मक ΔH)
➡ सबसे अधिक अभिक्रियाशील अधातु = IV (ΔH अधिक ऋणात्मक)
➡ सबसे कम अभिक्रियाशील अधातु = III (कम ऋणात्मक ΔH)
🔵 प्रश्न 3.32:
निम्नलिखित युग्मों में से कौन सा स्थायी द्विआधारी यौगिक बनाएगा?
(क) लिथियम और ऑक्सीजन
(ख) बेरियम और नाइट्रोजन
(ग) एल्युमिनियम और आयोडीन
(घ) सिलिकॉन और ऑक्सीजन
🟢 उत्तर:
➡ सभी युग्म स्थायी यौगिक बनाते हैं, परंतु सर्वाधिक स्थायी: लिथियम और ऑक्सीजन (Li₂O)।
🔵 प्रश्न 3.33:
आधुनिक आवर्त सारणी में तत्वों को किस क्रम में व्यवस्थित किया गया है?
🟢 उत्तर:
➡ तत्वों को परमाणु क्रमांक (Atomic Number) के बढ़ते क्रम में रखा गया है।
🔵 प्रश्न 3.34:
निम्न में से कौन सा कथन सही नहीं है?
(क) p-ब्लॉक में 6 समूह हैं।
(ख) d-ब्लॉक के प्रत्येक आवर्त में 10 तत्व हैं।
(ग) f-ब्लॉक के तत्वों को आंतरिक संक्रमण धातु कहा जाता है।
(घ) d-ब्लॉक के तत्वों की संयोजकता स्थिर होती है।
🟢 उत्तर:
गलत कथन है: (घ) क्योंकि d-ब्लॉक के तत्वों की संयोजकता परिवर्ती होती है।
🔵 प्रश्न 3.35:
कौन-सा गुणधर्म तत्व की संयोजकता को प्रभावित करता है?
🟢 उत्तर:
➡ संयोजक इलेक्ट्रॉनों की संख्या, नाभिकीय आवेश, तथा ऑर्बिटल्स की उपलब्धता संयोजकता निर्धारित करते हैं।
🔵 प्रश्न 3.36:
F⁻, Ne, Na⁺ का आकार समान क्यों है और किस परिमाण पर निर्भर करता है?
🟢 उत्तर:
➡ सभी का इलेक्ट्रॉनिक विन्यास समान (2, 8) है → आइसोइलेक्ट्रॉनिक।
➡ आकार निर्भर करता है नाभिकीय आवेश पर।
✔ क्रम: Na⁺ < Ne < F⁻
🔵 प्रश्न 3.37:
कौन से तत्वों में आयनन एन्थैल्पी सबसे अधिक होगी?
🟢 उत्तर:
➡ निष्क्रिय गैसों (He, Ne, Ar) में क्योंकि पूर्ण ऑर्बिटल संरचना → इलेक्ट्रॉन निकालना कठिन।
🔵 प्रश्न 3.38:
B, Al, Mg, K के लिए परमाण्विक आकार का सही क्रम बताइए।
🟢 उत्तर:
✔ सही क्रम: K > Mg > Al > B
➡ क्योंकि आवर्त में बाएँ से दाएँ जाने पर आकार घटता है।
🔵 प्रश्न 3.39:
B, C, N, F, Si के लिए वैद्युतऋणात्मकता का क्रम बताइए।
🟢 उत्तर:
✔ सही क्रम: F > N > C > B > Si
➡ आवर्त में दाएँ जाने पर वैद्युतऋणात्मकता बढ़ती है।
🔵 प्रश्न 3.40:
F, Cl, O, N की रासायनिक अभिक्रियाशीलता का क्रम बताइए।
🟢 उत्तर:
✔ सही क्रम: F > O > Cl > N
➡ फ्लोरीन का नाभिकीय आकर्षण सर्वाधिक है → सर्वाधिक अभिक्रियाशील।
————————————————————————————————————————————————————————————————————————————
अन्य महत्वपूर्ण प्रश्न
(CBSE MODEL प्रश्न पत्र)
सिर्फ इसी पाठ से निर्मित CBSE MODEL प्रश्न पत्र।
खंड A — बहुविकल्पीय प्रश्न (Q1–Q16, प्रत्येक 1 अंक)
प्रश्न 1. आवर्त सारणी का आधुनिक रूप किस पर आधारित है?
परमाणु द्रव्यमान
परमाणु संख्या
संयोजकता
द्रव्यमान संख्या
Answer: 2
प्रश्न 2. लावॉयज़िए ने तत्त्वों को किस आधार पर वर्गीकृत किया था?
धातु और अधातु
अम्लजनक और अनम्लजनक
ठोस, द्रव, गैस
हल्के और भारी
Answer: 2
प्रश्न 3. न्यूलैण्ड का “अष्टक नियम” किस पर आधारित था?
परमाणु संख्या
परमाणु द्रव्यमान
इलेक्ट्रॉन संरचना
आवेश संख्या
Answer: 2
प्रश्न 4. मण्डलीफ की आवर्त सारणी में मुख्य आधार क्या था?
परमाणु द्रव्यमान
परमाणु संख्या
इलेक्ट्रॉन ऋणात्मकता
इलेक्ट्रॉन अभिलाषा
Answer: 1
प्रश्न 5. आधुनिक आवर्त सारणी में कुल आवर्तों की संख्या है:
6
7
8
9
Answer: 2
प्रश्न 6. आधुनिक आवर्त सारणी में कुल समूहों की संख्या है:
7
8
18
16
Answer: 3
कथन–कारण हेतु विकल्प-कुंजी
कथन (A) एवं कारण (R) दोनों सत्य हैं तथा R, A का सही कारण है
कथन (A) एवं कारण (R) दोनों सत्य हैं परन्तु R, A का सही कारण नहीं
कथन (A) सत्य है परन्तु R असत्य
कथन (A) असत्य है परन्तु R सत्य
प्रश्न 7 (A/R).
कथन (A): समान समूह के तत्त्वों में समान संयोजक इलेक्ट्रॉन संरचना होती है।
कारण (R): इसी कारण उनके रासायनिक गुण मिलते-जुलते हैं।
Answer: 1
प्रश्न 8. p-ब्लॉक तत्त्व आवर्त सारणी के किस ओर पाए जाते हैं?
बाएँ
दाएँ
बीच में
अलग
Answer: 2
प्रश्न 9. आवर्त में बाएँ से दाएँ जाने पर परमाणु त्रिज्या:
घटती है
बढ़ती है
पहले बढ़ती फिर घटती है
अपरिवर्तित रहती है
Answer: 1
प्रश्न 10 (A/R).
कथन (A): आयनीकरण ऊर्जा समूह में नीचे जाने पर घटती है।
कारण (R): त्रिज्या बढ़ने से नाभिकीय आकर्षण घट जाता है।
Answer: 1
प्रश्न 11. इलेक्ट्रॉन अभिलाषा का सर्वाधिक मान किस तत्त्व का है?
ऑक्सीजन
नाइट्रोजन
फ्लोरीन
क्लोरीन
Answer: 4
प्रश्न 12. सबसे अधिक विद्युत ऋणात्मकता किस तत्त्व की होती है?
ऑक्सीजन
फ्लोरीन
क्लोरीन
नाइट्रोजन
Answer: 2
प्रश्न 13. क्षारीय धातु किस ब्लॉक में आते हैं?
s-ब्लॉक
p-ब्लॉक
d-ब्लॉक
f-ब्लॉक
Answer: 1
प्रश्न 14. संक्रमण धातुएँ किस ब्लॉक के अन्तर्गत आती हैं?
s-ब्लॉक
p-ब्लॉक
d-ब्लॉक
f-ब्लॉक
Answer: 3
प्रश्न 15 (A/R).
कथन (A): लैंथेनाइड और एक्टिनाइड आन्तरिक संक्रमण धातुएँ कहलाती हैं।
कारण (R): इनमें f-कक्षाएँ भरती हैं।
Answer: 1
प्रश्न 16. आधुनिक आवर्त सारणी में हाइड्रोजन को किस समूह में रखा गया है?
1
17
दोनों में
अलग
Answer: 4
खंड B — अति लघु उत्तरीय प्रश्न (Q17–Q21, प्रत्येक 2 अंक)
प्रश्न 17. न्यूलैण्ड के अष्टक नियम का कथन लिखिए।
उत्तर:
🟦 कथन: जब तत्त्वों को बढ़ते परमाणु द्रव्यमान के क्रम में रखा जाए तो प्रत्येक आठवें तत्त्व के गुण पहले तत्त्व से मिलते-जुलते हैं।
🟩 सीमा: यह केवल हल्के तत्त्वों (Ca तक) के लिए सही रहा।
प्रश्न 18. मण्डलीफ की आवर्त सारणी की एक विशेषता और एक दोष लिखिए।
उत्तर:
🟦 विशेषता: मण्डलीफ ने अज्ञात तत्त्वों के स्थान छोड़कर उनकी भविष्यवाणी की।
🟩 दोष: हाइड्रोजन और कुछ युग्म (Co, Ni) का स्थान स्पष्ट नहीं कर पाया।
प्रश्न 19. आधुनिक आवर्त सारणी में तत्त्वों का वर्गीकरण किस आधार पर है?
उत्तर:
🟦 आधार: परमाणु संख्या (Z)।
🟩 प्रत्येक तत्त्व का स्थान उसकी इलेक्ट्रॉन संरचना से निर्धारित होता है।
प्रश्न 20. इलेक्ट्रॉन अभिलाषा को परिभाषित कीजिए।
उत्तर:
🟦 परिभाषा: किसी गैसीय परमाणु में एक इलेक्ट्रॉन जुड़ने पर मुक्त हुई ऊर्जा को इलेक्ट्रॉन अभिलाषा कहते हैं।
🟩 यह ऋणायन बनने की प्रवृत्ति को दर्शाती है।
प्रश्न 21. क्षारीय धातुओं के दो सामान्य गुण लिखिए।
उत्तर:
🟦 अत्यधिक अभिक्रियाशील, जल के साथ तीव्र अभिक्रिया।
🟩 बड़े परमाणु त्रिज्या, कम आयनीकरण ऊर्जा।
खंड C — लघु उत्तरीय प्रश्न (Q22–Q28, प्रत्येक 3 अंक)
प्रश्न 22. मण्डलीफ की आवर्त सारणी में अज्ञात तत्त्वों की भविष्यवाणी का उदाहरण दीजिए।
उत्तर:
🟦 मण्डलीफ ने eka-Silicon और eka-Aluminium नाम से स्थान छोड़ा।
🟩 बाद में ये तत्त्व क्रमशः Ge और Ga पाए गए।
🟦 उनके गुण लगभग वैसा ही मिला जैसा मण्डलीफ ने अनुमान किया था।
प्रश्न 23. किसी समूह और किसी आवर्त में गुणधर्मों का परिवर्तन समझाइए।
उत्तर:
🟦 समूह: नीचे जाने पर त्रिज्या बढ़ती है, आयनीकरण ऊर्जा घटती है।
🟩 आवर्त: बाएँ से दाएँ जाने पर त्रिज्या घटती है, आयनीकरण ऊर्जा बढ़ती है।
🟦 परिणाम: रासायनिक क्रियाशीलता में व्यवस्थित परिवर्तन होता है।
प्रश्न 24. s-ब्लॉक और p-ब्लॉक तत्त्वों में दो अन्तर बताइए।
उत्तर:
🟦 s-ब्लॉक: बाह्यतम इलेक्ट्रॉन s-कक्षा में; धात्विक गुण अधिक।
🟩 p-ब्लॉक: बाह्यतम इलेक्ट्रॉन p-कक्षा में; विविध गुण (धातु, अधातु, उपधातु)।
🟦 s-ब्लॉक तत्त्व सक्रिय अवकरणक, p-ब्लॉक तत्त्व प्रायः ऑक्सीकारक।
प्रश्न 25. आवर्त सारणी में त्रिज्या परिवर्तन का कारण बताइए।
उत्तर:
🟦 आवर्त में दाएँ जाने पर प्रभावी नाभिकीय आवेश बढ़ता है।
🟩 परिणामस्वरूप इलेक्ट्रॉनों को केन्द्रक अधिक खींचता है।
🟦 अतः परमाणु त्रिज्या घटती है।
प्रश्न 26. d-ब्लॉक तत्त्वों की दो विशेषताएँ लिखिए।
उत्तर:
🟦 रंगीन यौगिक बनाते हैं।
🟩 उत्प्रेरक के रूप में कार्य करते हैं।
🟦 उनकी ऑक्सीकरण अवस्थाएँ परिवर्ती होती हैं।
प्रश्न 27. हैलोजनों के विद्युत ऋणात्मकता और ऑक्सीकरण प्रवृत्ति की प्रवृत्ति लिखिए।
उत्तर:
🟦 समूह 17 में ऊपर से नीचे जाने पर विद्युत ऋणात्मकता घटती है।
🟩 फलस्वरूप ऑक्सीकरण प्रवृत्ति भी घटती है।
🟦 अतः फ्लोरीन सबसे अधिक शक्तिशाली ऑक्सीकारक है।
प्रश्न 28. आयनीकरण ऊर्जा को परिभाषित करिए और इसके एक कारक का प्रभाव लिखिए।
उत्तर:
🟦 परिभाषा: गैसीय परमाणु से एक इलेक्ट्रॉन हटाने हेतु आवश्यक न्यूनतम ऊर्जा।
🟩 कारक: परमाणु त्रिज्या जितनी छोटी होगी, आयनीकरण ऊर्जा उतनी अधिक होगी।
🟦 कारण: केन्द्रक का आकर्षण अधिक।
खंड D — प्रकरण आधारित प्रश्न (Q29–Q30, प्रत्येक 4 अंक)
प्रश्न 29.
निम्नलिखित अनुच्छेद पढ़िए और उत्तर दीजिए:
“समूह 1 के क्षारीय धातुओं की आयनीकरण ऊर्जा क्रमशः Li > Na > K > Rb > Cs पाई जाती है।”
(i) यह प्रवृत्ति किस कारण से है? (1)
(ii) किस धातु का परमाणु त्रिज्या सबसे बड़ा है? (1)
(iii) किस कारण से ये सभी धातुएँ अत्यधिक अभिक्रियाशील हैं? (2)
उत्तर:
🟦 (i) समूह में नीचे जाने पर परमाणु त्रिज्या बढ़ती है, आकर्षण घटता है।
🟩 (ii) Cs का त्रिज्या सबसे बड़ा है।
🟪 (iii) इनकी आयनीकरण ऊर्जा बहुत कम होती है ⇒ इलेक्ट्रॉन आसानी से हट जाता है ⇒ उच्च अभिक्रियाशीलता।
प्रश्न 30.
निम्न तालिका देखें और प्रश्नों का उत्तर दीजिए:
तत्त्व परमाणु संख्या
X 8
Y 9
Z 11
(i) X, Y, Z के समूह और आवर्त बताएँ। (2)
(ii) इनमें से सबसे अधिक विद्युत ऋणात्मक कौन है? (1)
(iii) कौन-सा तत्त्व धातु है? (1)
उत्तर:
🟦 (i) X = 8 (O, समूह 16, आवर्त 2); Y = 9 (F, समूह 17, आवर्त 2); Z = 11 (Na, समूह 1, आवर्त 3)।
🟩 (ii) सर्वाधिक विद्युत ऋणात्मक Y (F)।
🟪 (iii) धातु = Z (Na)।
खंड E — दीर्घ उत्तरीय प्रश्न (Q31–Q33, प्रत्येक 5 अंक)
प्रश्न 31.
मण्डलीफ की आवर्त सारणी की प्रमुख विशेषताएँ और सीमाएँ लिखिए।
उत्तर:
🟦 विशेषताएँ:
तत्त्वों को बढ़ते परमाणु द्रव्यमान के अनुसार व्यवस्थित किया।
अज्ञात तत्त्वों (Ge, Ga, Sc) की भविष्यवाणी की और उनके गुण बताए।
समान गुणों वाले तत्त्वों को एक समूह में रखा।
🟩 सीमाएँ:
हाइड्रोजन का स्थान अस्पष्ट रहा।
कुछ तत्त्व (Co, Ni, Te, I) परमाणु द्रव्यमान क्रम से नहीं बैठे।
आइसोटोपों का स्थान समझा नहीं सका।
✅ निष्कर्ष: मण्डलीफ की आवर्त सारणी आधार बनी, जिसे बाद में आधुनिक रूप मिला।
या
आधुनिक आवर्त सारणी की मुख्य विशेषताएँ और उसकी श्रेष्ठता लिखिए।
प्रश्न 32.
आयनीकरण ऊर्जा और इलेक्ट्रॉन अभिलाषा में प्रवृत्तियों की तुलना कीजिए।
उत्तर:
🟦 आयनीकरण ऊर्जा:
समूह में नीचे जाने पर घटती है (त्रिज्या बढ़ने से)।
आवर्त में बाएँ से दाएँ जाने पर बढ़ती है (नाभिकीय आकर्षण बढ़ने से)।
🟩 इलेक्ट्रॉन अभिलाषा:
समूह में नीचे जाने पर घटती है।
आवर्त में बाएँ से दाएँ जाने पर सामान्यतः बढ़ती है।
✅ निष्कर्ष: दोनों प्रवृत्तियाँ नाभिकीय आकर्षण और त्रिज्या परिवर्तन से प्रभावित होती हैं, परन्तु दिशा में भिन्नता हो सकती है।
या
विद्युत ऋणात्मकता की परिभाषा दीजिए और आवर्त तथा समूह में इसकी प्रवृत्ति समझाइए।
प्रश्न 33.
तत्त्वों को ब्लॉकों (s, p, d, f) में विभाजित करने का आधार और उनके सामान्य गुणधर्म लिखिए।
उत्तर:
🟦 आधार: जिस कक्षा (s, p, d, f) में अंतिम इलेक्ट्रॉन प्रविष्ट होता है, उसी के अनुसार ब्लॉक का निर्धारण।
🟩 s-ब्लॉक: क्षारीय व क्षारीय मृदा धातुएँ, अत्यधिक अभिक्रियाशील।
🟪 p-ब्लॉक: विविध (धातु, अधातु, उपधातु), जीवनोपयोगी यौगिक।
🟦 d-ब्लॉक: संक्रमण धातुएँ, रंगीन यौगिक व उत्प्रेरक गुण।
🟩 f-ब्लॉक: आन्तरिक संक्रमण धातुएँ (लैंथेनाइड, एक्टिनाइड), प्रायः रेडियोधर्मी।
✅ निष्कर्ष: ब्लॉक विभाजन से तत्त्वों के गुणधर्मों की व्यवस्थित व्याख्या सम्भव होती है।
या
आधुनिक आवर्त सारणी में आवर्तों और समूहों की संख्या, उनका क्रम तथा उनके सामान्य लक्षण लिखिए।
————————————————————————————————————————————————————————————————————————————
Neet पिछले सालों के प्रश्न
🔵 प्रश्न 1:
किस तत्व का परमाणु त्रिज्या सबसे अधिक है?
🔴 ① Li
🟢 ② Na
🟡 ③ K
🔵 ④ Rb
🟢 उत्तर: ④ Rb
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: Q
🔵 प्रश्न 2:
आवर्त सारणी में एक आवर्त में बाएँ से दाएँ जाने पर परमाणु त्रिज्या:
🔴 ① बढ़ती है
🟢 ② घटती है
🟡 ③ समान रहती है
🔵 ④ पहले बढ़ती फिर घटती है
🟢 उत्तर: ② घटती है
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: L
🔵 प्रश्न 3:
प्रथम आयनीकरण ऊर्जा सर्वाधिक किसकी होती है?
🔴 ① O
🟢 ② F
🟡 ③ Ne
🔵 ④ He
🟢 उत्तर: ④ He
📘 परीक्षा: AIPMT
📅 वर्ष: 2012 | सेट: B
🔵 प्रश्न 4:
एक समूह में ऊपर से नीचे जाने पर विद्युतऋणात्मकता:
🔴 ① बढ़ती है
🟢 ② घटती है
🟡 ③ समान रहती है
🔵 ④ पहले घटती फिर बढ़ती है
🟢 उत्तर: ② घटती है
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: M
🔵 प्रश्न 5:
किस तत्व का इलेक्ट्रॉनिक विन्यास [Ne]3s²3p⁵ है?
🔴 ① F
🟢 ② Cl
🟡 ③ Br
🔵 ④ I
🟢 उत्तर: ② Cl
📘 परीक्षा: PMT
📅 वर्ष: 2010 | सेट: C
🔵 प्रश्न 6:
आवर्त सारणी में क्षारीय धातुएँ किस समूह में आती हैं?
🔴 ① समूह 2
🟢 ② समूह 1
🟡 ③ समूह 17
🔵 ④ समूह 18
🟢 उत्तर: ② समूह 1
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: P
🔵 प्रश्न 7:
कौन-सा तत्व संक्रमण तत्त्व है?
🔴 ① Mg
🟢 ② Fe
🟡 ③ Al
🔵 ④ Na
🟢 उत्तर: ② Fe
📘 परीक्षा: AIPMT
📅 वर्ष: 2011 | सेट: Y
🔵 प्रश्न 8:
आवर्त सारणी में लैंथेनाइड किस ब्लॉक में पाए जाते हैं?
🔴 ① s-ब्लॉक
🟢 ② p-ब्लॉक
🟡 ③ d-ब्लॉक
🔵 ④ f-ब्लॉक
🟢 उत्तर: ④ f-ब्लॉक
📘 परीक्षा: NEET
📅 वर्ष: 2020 | सेट: R
🔵 प्रश्न 9:
किस समूह के तत्त्वों को “हैलोजन” कहते हैं?
🔴 ① समूह 14
🟢 ② समूह 15
🟡 ③ समूह 16
🔵 ④ समूह 17
🟢 उत्तर: ④ समूह 17
📘 परीक्षा: NEET
📅 वर्ष: 2015 | सेट: N
🔵 प्रश्न 10:
निष्क्रिय गैसें किस समूह में आती हैं?
🔴 ① 17
🟢 ② 18
🟡 ③ 16
🔵 ④ 1
🟢 उत्तर: ② 18
📘 परीक्षा: AIPMT
📅 वर्ष: 2013 | सेट: A
🔵 प्रश्न 11:
एक आवर्त में बाएँ से दाएँ जाने पर आयनीकरण ऊर्जा का क्या प्रभाव होता है?
🔴 ① घटती है
🟢 ② बढ़ती है
🟡 ③ स्थिर रहती है
🔵 ④ पहले बढ़ती फिर घटती है
🟢 उत्तर: ② बढ़ती है
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: J
🔵 प्रश्न 12:
एक समूह में ऊपर से नीचे जाने पर धात्विक गुण:
🔴 ① घटता है
🟢 ② बढ़ता है
🟡 ③ समान रहता है
🔵 ④ पहले घटता फिर बढ़ता है
🟢 उत्तर: ② बढ़ता है
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: K
🔵 प्रश्न 13:
पृथ्वी की पपड़ी में सर्वाधिक प्रचुर तत्व कौन-सा है?
🔴 ① O
🟢 ② Si
🟡 ③ Al
🔵 ④ Fe
🟢 उत्तर: ① O
📘 परीक्षा: NEET
📅 वर्ष: 2021 | सेट: O
🔵 प्रश्न 14:
सबसे कम विद्युतऋणात्मक तत्व कौन-सा है?
🔴 ① H
🟢 ② Li
🟡 ③ Cs
🔵 ④ F
🟢 उत्तर: ③ Cs
📘 परीक्षा: AIPMT
📅 वर्ष: 2014 | सेट: D
🔵 प्रश्न 15:
क्षारीय मृदा धातुएँ किस समूह में पाई जाती हैं?
🔴 ① समूह 1
🟢 ② समूह 2
🟡 ③ समूह 17
🔵 ④ समूह 18
🟢 उत्तर: ② समूह 2
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: P
🔵 प्रश्न 16:
डोबेराइनर की त्रिक प्रणाली किससे सम्बन्धित है?
🔴 ① परमाणु त्रिज्या
🟢 ② परमाणु द्रव्यमान
🟡 ③ विद्युतऋणात्मकता
🔵 ④ संयोजकता
🟢 उत्तर: ② परमाणु द्रव्यमान
📘 परीक्षा: PMT
📅 वर्ष: 2009 | सेट: C
🔵 प्रश्न 17:
न्यू लैंड का अष्टक नियम किस पर आधारित था?
🔴 ① परमाणु संख्या
🟢 ② परमाणु द्रव्यमान
🟡 ③ आयनीकरण ऊर्जा
🔵 ④ विद्युतऋणात्मकता
🟢 उत्तर: ② परमाणु द्रव्यमान
📘 परीक्षा: NEET
📅 वर्ष: 2015 | सेट: Q
🔵 प्रश्न 18:
मैंडलीफ ने तत्वों को किस आधार पर वर्गीकृत किया?
🔴 ① परमाणु संख्या
🟢 ② परमाणु द्रव्यमान
🟡 ③ न्यूट्रॉन संख्या
🔵 ④ इलेक्ट्रॉनिक विन्यास
🟢 उत्तर: ② परमाणु द्रव्यमान
📘 परीक्षा: AIPMT
📅 वर्ष: 2010 | सेट: B
🔵 प्रश्न 19:
आधुनिक आवर्त नियम किस पर आधारित है?
🔴 ① परमाणु द्रव्यमान
🟢 ② परमाणु संख्या
🟡 ③ आयनीकरण ऊर्जा
🔵 ④ विद्युतऋणात्मकता
🟢 उत्तर: ② परमाणु संख्या
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: R
🔵 प्रश्न 20:
s-ब्लॉक के तत्त्वों की सामान्य संयोजकता कितनी होती है?
🔴 ① 1 और 2
🟢 ② 3 और 4
🟡 ③ 5 और 6
🔵 ④ 7
🟢 उत्तर: ① 1 और 2
📘 परीक्षा: NEET
📅 वर्ष: 2012 | सेट: D
🔵 प्रश्न 21:
आवर्त सारणी में f-ब्लॉक के तत्व कहाँ रखे गए हैं?
🔴 ① सारणी के मुख्य भाग में
🟢 ② नीचे पृथक स्थान पर
🟡 ③ p-ब्लॉक में
🔵 ④ d-ब्लॉक में
🟢 उत्तर: ② नीचे पृथक स्थान पर
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: N
🔵 प्रश्न 22:
द्वितीय आवर्त में कितने तत्व होते हैं?
🔴 ① 2
🟢 ② 8
🟡 ③ 18
🔵 ④ 32
🟢 उत्तर: ② 8
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: K
🔵 प्रश्न 23:
तत्व संख्या 19 (K) किस समूह में आता है?
🔴 ① 1
🟢 ② 2
🟡 ③ 17
🔵 ④ 18
🟢 उत्तर: ① 1
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: J
🔵 प्रश्न 24:
एक समूह में नीचे जाने पर आयनीकरण ऊर्जा:
🔴 ① बढ़ती है
🟢 ② घटती है
🟡 ③ स्थिर रहती है
🔵 ④ पहले घटती फिर बढ़ती है
🟢 उत्तर: ② घटती है
📘 परीक्षा: AIPMT
📅 वर्ष: 2014 | सेट: A
🔵 प्रश्न 25:
एक ही समूह के तत्त्वों में कौन-सा गुण समान होता है?
🔴 ① परमाणु द्रव्यमान
🟢 ② इलेक्ट्रॉनिक विन्यास
🟡 ③ आयनीकरण ऊर्जा
🔵 ④ परमाणु त्रिज्या
🟢 उत्तर: ② इलेक्ट्रॉनिक विन्यास
📘 परीक्षा: NEET
📅 वर्ष: 2020 | सेट: S
🔵 प्रश्न 26:
निष्क्रिय गैसों की आयनीकरण ऊर्जा:
🔴 ① अत्यधिक होती है
🟢 ② बहुत कम होती है
🟡 ③ शून्य होती है
🔵 ④ अनिश्चित होती है
🟢 उत्तर: ① अत्यधिक होती है
📘 परीक्षा: NEET
📅 वर्ष: 2015 | सेट: P
🔵 प्रश्न 27:
आवर्त सारणी में परमाणु आकार सबसे कम किसका है?
🔴 ① H
🟢 ② He
🟡 ③ Li
🔵 ④ Be
🟢 उत्तर: ② He
📘 परीक्षा: AIPMT
📅 वर्ष: 2011 | सेट: Y
🔵 प्रश्न 28:
सर्वाधिक विद्युतऋणात्मक तत्व कौन-सा है?
🔴 ① O
🟢 ② F
🟡 ③ N
🔵 ④ Cl
🟢 उत्तर: ② F
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: M
🔵 प्रश्न 29:
आवर्त सारणी में सबसे कम विद्युतऋणात्मकता किस तत्व की है?
🔴 ① Na
🟢 ② Cs
🟡 ③ Mg
🔵 ④ F
🟢 उत्तर: ② Cs
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: K
🔵 प्रश्न 30:
तीसरे आवर्त में कितने तत्व पाए जाते हैं?
🔴 ① 2
🟢 ② 8
🟡 ③ 18
🔵 ④ 32
🟢 उत्तर: ② 8
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: Q
🔵 प्रश्न 31:
समूह 17 के तत्त्वों को क्या कहा जाता है?
🔴 ① हैलोजन
🟢 ② क्षार धातु
🟡 ③ निष्क्रिय गैसें
🔵 ④ संक्रमण धातु
🟢 उत्तर: ① हैलोजन
📘 परीक्षा: AIPMT
📅 वर्ष: 2010 | सेट: C
🔵 प्रश्न 32:
किस तत्व का परमाणु आकार सबसे अधिक है?
🔴 ① Na
🟢 ② K
🟡 ③ Rb
🔵 ④ Cs
🟢 उत्तर: ④ Cs
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: R
🔵 प्रश्न 33:
किस समूह को क्षारीय मृदा धातु कहते हैं?
🔴 ① समूह 1
🟢 ② समूह 2
🟡 ③ समूह 13
🔵 ④ समूह 17
🟢 उत्तर: ② समूह 2
📘 परीक्षा: NEET
📅 वर्ष: 2014 | सेट: B
🔵 प्रश्न 34:
किसका आयनिक त्रिज्या सबसे अधिक है?
🔴 ① Li⁺
🟢 ② Na⁺
🟡 ③ K⁺
🔵 ④ Cs⁺
🟢 उत्तर: ④ Cs⁺
📘 परीक्षा: NEET
📅 वर्ष: 2012 | सेट: D
🔵 प्रश्न 35:
विद्युतऋणात्मकता का मान सर्वाधिक किस समूह में होता है?
🔴 ① समूह 1
🟢 ② समूह 2
🟡 ③ समूह 17
🔵 ④ समूह 18
🟢 उत्तर: ③ समूह 17
📘 परीक्षा: NEET
📅 वर्ष: 2015 | सेट: O
🔵 प्रश्न 36:
कौन-सा तत्व मेटलॉइड है?
🔴 ① B
🟢 ② Si
🟡 ③ As
🔵 ④ सभी
🟢 उत्तर: ④ सभी
📘 परीक्षा: NEET
📅 वर्ष: 2021 | सेट: J
🔵 प्रश्न 37:
किस तत्व का परमाणु त्रिज्या सबसे कम है?
🔴 ① F
🟢 ② O
🟡 ③ N
🔵 ④ Ne
🟢 उत्तर: ④ Ne
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: S
🔵 प्रश्न 38:
चौथे आवर्त में कितने तत्व होते हैं?
🔴 ① 8
🟢 ② 18
🟡 ③ 32
🔵 ④ 2
🟢 उत्तर: ② 18
📘 परीक्षा: AIPMT
📅 वर्ष: 2011 | सेट: A
🔵 प्रश्न 39:
किस समूह में सभी तत्व अधातु हैं?
🔴 ① समूह 13
🟢 ② समूह 14
🟡 ③ समूह 17
🔵 ④ समूह 18
🟢 उत्तर: ④ समूह 18
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: L
🔵 प्रश्न 40:
आवर्त सारणी में Z = 82 किस तत्व का है?
🔴 ① Pb
🟢 ② Sn
🟡 ③ Hg
🔵 ④ Bi
🟢 उत्तर: ① Pb
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: P
🔵 प्रश्न 41:
आवर्त सारणी में सबसे हल्का क्षार धातु कौन-सा है?
🔴 ① Na
🟢 ② K
🟡 ③ Rb
🔵 ④ Li
🟢 उत्तर: ④ Li
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: O
🔵 प्रश्न 42:
समूह 16 को क्या कहते हैं?
🔴 ① ऑक्सीजन समूह
🟢 ② हैलोजन
🟡 ③ निष्क्रिय गैसें
🔵 ④ क्षार धातु
🟢 उत्तर: ① ऑक्सीजन समूह
📘 परीक्षा: AIPMT
📅 वर्ष: 2013 | सेट: Y
🔵 प्रश्न 43:
Z = 3 तत्व किस समूह और आवर्त में है?
🔴 ① समूह 1, आवर्त 2
🟢 ② समूह 2, आवर्त 2
🟡 ③ समूह 13, आवर्त 3
🔵 ④ समूह 17, आवर्त 2
🟢 उत्तर: ① समूह 1, आवर्त 2
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: Q
🔵 प्रश्न 44:
किस तत्व का इलेक्ट्रॉनिक विन्यास [Ar]4s²3d¹⁰4p⁵ है?
🔴 ① Br
🟢 ② Kr
🟡 ③ Cl
🔵 ④ I
🟢 उत्तर: ① Br
📘 परीक्षा: NEET
📅 वर्ष: 2020 | सेट: M
🔵 प्रश्न 45:
किस तत्व की आयनीकरण ऊर्जा सबसे कम है?
🔴 ① Li
🟢 ② Na
🟡 ③ Cs
🔵 ④ K
🟢 उत्तर: ③ Cs
📘 परीक्षा: NEET
📅 वर्ष: 2015 | सेट: R
🔵 प्रश्न 46:
s-ब्लॉक तत्त्वों का सबसे सामान्य गुण कौन-सा है?
🔴 ① अधिक विद्युतऋणात्मकता
🟢 ② धात्विक गुण
🟡 ③ उच्च आयनीकरण ऊर्जा
🔵 ④ अधात्विक गुण
🟢 उत्तर: ② धात्विक गुण
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: J
🔵 प्रश्न 47:
समूह 13 के तत्त्वों में कौन-सा अधातु है?
🔴 ① B
🟢 ② Al
🟡 ③ Ga
🔵 ④ In
🟢 उत्तर: ① B
📘 परीक्षा: AIPMT
📅 वर्ष: 2012 | सेट: D
🔵 प्रश्न 48:
तत्त्व संख्या 35 (Br) किस समूह और आवर्त में है?
🔴 ① समूह 17, आवर्त 4
🟢 ② समूह 18, आवर्त 3
🟡 ③ समूह 13, आवर्त 2
🔵 ④ समूह 1, आवर्त 4
🟢 उत्तर: ① समूह 17, आवर्त 4
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: K
🔵 प्रश्न 49:
किस समूह को नाणविक (coinage) धातु कहते हैं?
🔴 ① समूह 11
🟢 ② समूह 12
🟡 ③ समूह 13
🔵 ④ समूह 14
🟢 उत्तर: ① समूह 11
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: S
🔵 प्रश्न 50:
किस तत्व का इलेक्ट्रॉनिक विन्यास 1s²2s²2p⁶3s²3p⁶4s²3d¹⁰4p⁶ है?
🔴 ① Ar
🟢 ② Kr
🟡 ③ Ne
🔵 ④ Xe
🟢 उत्तर: ② Kr
📘 परीक्षा: NEET
📅 वर्ष: 2021 | सेट: L
————————————————————————————————————————————————————————————————————————————
JEE MAINS पिछले सालों के प्रश्न
🔵 प्रश्न 1:
आधुनिक आवर्त सारणी किस सिद्धांत पर आधारित है?
🔴 ① परमाणु द्रव्यमान
🟢 ② परमाणु क्रमांक
🟡 ③ संयोजकता
🔵 ④ इलेक्ट्रॉनिक विन्यास
🟢 उत्तर: ② परमाणु क्रमांक
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | शिफ़्ट: Morning
🔵 प्रश्न 2:
नये आवर्त सारणी में कुल आवर्तों की संख्या कितनी है?
🔴 ① 6
🟢 ② 7
🟡 ③ 8
🔵 ④ 9
🟢 उत्तर: ② 7
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: Morning
🔵 प्रश्न 3:
किस समूह को संक्रमण तत्व कहा जाता है?
🔴 ① 1–2
🟢 ② 3–12
🟡 ③ 13–18
🔵 ④ 17–18
🟢 उत्तर: ② 3–12
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Evening
🔵 प्रश्न 4:
लैंथेनाइड तत्व किस ब्लॉक में आते हैं?
🔴 ① s-ब्लॉक
🟢 ② f-ब्लॉक
🟡 ③ p-ब्लॉक
🔵 ④ d-ब्लॉक
🟢 उत्तर: ② f-ब्लॉक
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: Morning
🔵 प्रश्न 5:
दूसरे आवर्त में कुल तत्वों की संख्या है —
🔴 ① 2
🟢 ② 8
🟡 ③ 18
🔵 ④ 32
🟢 उत्तर: ② 8
📘 परीक्षा: JEE Main
📅 वर्ष: 2015 | शिफ़्ट: Evening
🔵 प्रश्न 6:
किसने आधुनिक आवर्त सारणी का निर्माण किया?
🔴 ① डॉबेरेनर
🟢 ② मौसली
🟡 ③ मेंडलीफ
🔵 ④ न्यूलैंड्स
🟢 उत्तर: ② मौसली
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Morning
🔵 प्रश्न 7:
आधुनिक आवर्त सारणी में कुल समूहों की संख्या है —
🔴 ① 16
🟢 ② 18
🟡 ③ 8
🔵 ④ 10
🟢 उत्तर: ② 18
📘 परीक्षा: JEE Main
📅 वर्ष: 2021 | शिफ़्ट: Evening
🔵 प्रश्न 8:
किस तत्व का परमाणु त्रिज्या सबसे बड़ी होती है?
🔴 ① Na
🟢 ② Cs
🟡 ③ Li
🔵 ④ K
🟢 उत्तर: ② Cs
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Morning
🔵 प्रश्न 9:
एक आवर्त में बाएँ से दाएँ जाते हुए परमाणु आकार —
🔴 ① बढ़ता है
🟢 ② घटता है
🟡 ③ अपरिवर्तित रहता है
🔵 ④ पहले बढ़ता फिर घटता
🟢 उत्तर: ② घटता है
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: Evening
🔵 प्रश्न 10:
धात्विक प्रवृत्ति आवर्त में बाएँ से दाएँ —
🔴 ① बढ़ती है
🟢 ② घटती है
🟡 ③ पहले बढ़ती फिर घटती
🔵 ④ अपरिवर्तित
🟢 उत्तर: ② घटती है
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Morning
🔵 प्रश्न 11:
विद्युतऋणात्मकता का अधिकतम मान किसका है?
🔴 ① फ्लोरीन
🟢 ② ऑक्सीजन
🟡 ③ नाइट्रोजन
🔵 ④ क्लोरीन
🟢 उत्तर: ① फ्लोरीन
📘 परीक्षा: JEE Main
📅 वर्ष: 2022 | शिफ़्ट: Evening
🔵 प्रश्न 12:
किसका आयनीकरण ऊर्जा न्यूनतम है?
🔴 ① Na
🟢 ② K
🟡 ③ Rb
🔵 ④ Cs
🟢 उत्तर: ④ Cs
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Evening
🔵 प्रश्न 13:
एक समूह में ऊपर से नीचे जाने पर आयनीकरण ऊर्जा —
🔴 ① बढ़ती है
🟢 ② घटती है
🟡 ③ समान रहती है
🔵 ④ पहले घटती फिर बढ़ती
🟢 उत्तर: ② घटती है
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: Morning
🔵 प्रश्न 14:
कौन-सा तत्व p-ब्लॉक का सदस्य नहीं है?
🔴 ① N
🟢 ② O
🟡 ③ Fe
🔵 ④ Cl
🟢 उत्तर: ③ Fe
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | शिफ़्ट: Evening
🔵 प्रश्न 15:
निष्क्रिय गैसों की संयोजकता क्या होती है?
🔴 ① 0
🟢 ② 1
🟡 ③ 2
🔵 ④ 8
🟢 उत्तर: ① 0
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Evening
🔵 प्रश्न 16:
s-ब्लॉक तत्वों की सामान्य संयोजकता होती है —
🔴 ① +2
🟢 ② +1
🟡 ③ +3
🔵 ④ –1
🟢 उत्तर: ② +1
📘 परीक्षा: JEE Main
📅 वर्ष: 2015 | शिफ़्ट: Morning
🔵 प्रश्न 17:
किस तत्व की द्वितीय आयनीकरण ऊर्जा सर्वाधिक है?
🔴 ① Na
🟢 ② Mg
🟡 ③ Al
🔵 ④ Si
🟢 उत्तर: ① Na
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Morning
🔵 प्रश्न 18:
किस तत्व का इलेक्ट्रॉनिक विन्यास [Ne]3s²3p⁵ है?
🔴 ① क्लोरीन
🟢 ② सल्फर
🟡 ③ फॉस्फोरस
🔵 ④ आर्गन
🟢 उत्तर: ① क्लोरीन
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: Evening
🔵 प्रश्न 19:
किस तत्व का इलेक्ट्रॉन लवण बनाने की प्रवृत्ति अधिक होती है?
🔴 ① फ्लोरीन
🟢 ② ऑक्सीजन
🟡 ③ नाइट्रोजन
🔵 ④ कार्बन
🟢 उत्तर: ① फ्लोरीन
📘 परीक्षा: JEE Main
📅 वर्ष: 2021 | शिफ़्ट: Morning
🔵 प्रश्न 20:
ऑक्सीजन और सल्फर समान समूह में हैं क्योंकि —
🔴 ① उनके परमाणु द्रव्यमान समान हैं
🟢 ② इलेक्ट्रॉनिक विन्यास समान है
🟡 ③ वे समान यौगिक बनाते हैं
🔵 ④ दोनों अधातु हैं
🟢 उत्तर: ② इलेक्ट्रॉनिक विन्यास समान है
📘 परीक्षा: JEE Main
📅 वर्ष: 2023 | शिफ़्ट: Evening
🔵 प्रश्न 21:
आवर्त में बाएँ से दाएँ जाने पर विद्युतऋणात्मकता —
🔴 ① घटती है
🟢 ② बढ़ती है
🟡 ③ समान रहती है
🔵 ④ पहले घटती फिर बढ़ती
🟢 उत्तर: ② बढ़ती है
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Morning
🔵 प्रश्न 22:
एक समूह में बाएँ से दाएँ जाते हुए परमाणु आकार में परिवर्तन —
🔴 ① बढ़ता है
🟢 ② घटता है
🟡 ③ समान रहता है
🔵 ④ पहले घटता फिर बढ़ता
🟢 उत्तर: ② घटता है
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | शिफ़्ट: Morning
🔵 प्रश्न 23:
ऑक्सीजन और फ्लोरीन की विद्युतऋणात्मकता क्रमशः है —
🔴 ① 3.5, 3.0
🟢 ② 3.44, 3.98
🟡 ③ 4.0, 3.5
🔵 ④ 3.2, 4.1
🟢 उत्तर: ② 3.44, 3.98
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: Morning
🔵 प्रश्न 24:
निष्क्रिय गैसें किस समूह में आती हैं?
🔴 ① 17
🟢 ② 18
🟡 ③ 16
🔵 ④ 15
🟢 उत्तर: ② 18
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: Evening
🔵 प्रश्न 25:
अविकारी तत्व कहलाते हैं —
🔴 ① संक्रमण तत्व
🟢 ② निष्क्रिय गैसें
🟡 ③ s-ब्लॉक तत्व
🔵 ④ p-ब्लॉक तत्व
🟢 उत्तर: ② निष्क्रिय गैसें
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Morning
🔵 प्रश्न 26:
किस तत्व का आयनिक त्रिज्या सबसे अधिक है?
🔴 ① Na⁺
🟢 ② Mg²⁺
🟡 ③ F⁻
🔵 ④ O²⁻
🟢 उत्तर: ④ O²⁻
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: Morning
🔵 प्रश्न 27:
किस तत्व की द्वितीय आयनीकरण ऊर्जा सबसे कम है?
🔴 ① Na
🟢 ② Mg
🟡 ③ Al
🔵 ④ Si
🟢 उत्तर: ② Mg
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | शिफ़्ट: Evening
🔵 प्रश्न 28:
आवर्त में बाएँ से दाएँ जाते समय धात्विक प्रवृत्ति —
🔴 ① बढ़ती है
🟢 ② घटती है
🟡 ③ समान रहती है
🔵 ④ पहले बढ़ती फिर घटती
🟢 उत्तर: ② घटती है
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Morning
🔵 प्रश्न 29:
एक समूह में नीचे जाते समय विद्युतऋणात्मकता —
🔴 ① बढ़ती है
🟢 ② घटती है
🟡 ③ समान रहती है
🔵 ④ पहले बढ़ती फिर घटती
🟢 उत्तर: ② घटती है
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: Evening
🔵 प्रश्न 30:
सर्वाधिक विद्युतऋणात्मक तत्व कौन-सा है?
🔴 ① क्लोरीन
🟢 ② फ्लोरीन
🟡 ③ ऑक्सीजन
🔵 ④ नाइट्रोजन
🟢 उत्तर: ② फ्लोरीन
📘 परीक्षा: JEE Main
📅 वर्ष: 2021 | शिफ़्ट: Morning
🔵 प्रश्न 31:
आधुनिक आवर्त नियम के अनुसार तत्वों के गुण किस पर निर्भर करते हैं?
🔴 ① परमाणु भार पर
🟢 ② परमाणु क्रमांक पर
🟡 ③ न्यूट्रॉन संख्या पर
🔵 ④ आयनीकरण ऊर्जा पर
🟢 उत्तर: ② परमाणु क्रमांक पर
📘 परीक्षा: JEE Main
📅 वर्ष: 2015 | शिफ़्ट: Morning
🔵 प्रश्न 32:
निष्क्रिय गैसों का बाहरी इलेक्ट्रॉनिक विन्यास सामान्यतः होता है —
🔴 ① ns²np³
🟢 ② ns²np⁶
🟡 ③ ns²np⁴
🔵 ④ ns¹
🟢 उत्तर: ② ns²np⁶
📘 परीक्षा: JEE Main
📅 वर्ष: 2022 | शिफ़्ट: Evening
🔵 प्रश्न 33:
p-ब्लॉक में तत्वों की अधिकतम संयोजकता होती है —
🔴 ① 1
🟢 ② 7
🟡 ③ 8
🔵 ④ 3
🟢 उत्तर: ② 7
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | शिफ़्ट: Morning
🔵 प्रश्न 34:
आवर्त में बाएँ से दाएँ जाने पर धात्विक ऑक्साइडों का स्वभाव —
🔴 ① बढ़ता है
🟢 ② घटता है
🟡 ③ समान रहता है
🔵 ④ पहले घटता फिर बढ़ता
🟢 उत्तर: ② घटता है
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Evening
🔵 प्रश्न 35:
किस तत्व की इलेक्ट्रॉन अभिरुचि सर्वाधिक होती है?
🔴 ① फ्लोरीन
🟢 ② क्लोरीन
🟡 ③ ब्रोमीन
🔵 ④ आयोडीन
🟢 उत्तर: ② क्लोरीन
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: Morning
🔵 प्रश्न 36:
किस ब्लॉक में अधातुओं की अधिकता होती है?
🔴 ① s-ब्लॉक
🟢 ② p-ब्लॉक
🟡 ③ d-ब्लॉक
🔵 ④ f-ब्लॉक
🟢 उत्तर: ② p-ब्लॉक
📘 परीक्षा: JEE Main
📅 वर्ष: 2021 | शिफ़्ट: Evening
🔵 प्रश्न 37:
मेंडलीफ आवर्त सारणी में तत्वों को किस क्रम में रखा गया था?
🔴 ① परमाणु द्रव्यमान के बढ़ते क्रम में
🟢 ② परमाणु क्रमांक के घटते क्रम में
🟡 ③ संयोजकता के अनुसार
🔵 ④ ऑक्साइड के अनुसार
🟢 उत्तर: ① परमाणु द्रव्यमान के बढ़ते क्रम में
📘 परीक्षा: JEE Main
📅 वर्ष: 2015 | शिफ़्ट: Evening
🔵 प्रश्न 38:
कौन-सा युग्म समान समूह में आता है?
🔴 ① Li और Na
🟢 ② Na और Mg
🟡 ③ Mg और Al
🔵 ④ Cl और Ar
🟢 उत्तर: ① Li और Na
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: Morning
🔵 प्रश्न 39:
कौन-सा तत्व d-ब्लॉक का नहीं है?
🔴 ① Fe
🟢 ② Zn
🟡 ③ Cu
🔵 ④ Al
🟢 उत्तर: ④ Al
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Evening
🔵 प्रश्न 40:
आवर्त में बाएँ से दाएँ जाते हुए परमाणु आयतन —
🔴 ① बढ़ता है
🟢 ② घटता है
🟡 ③ अपरिवर्तित रहता है
🔵 ④ पहले घटता फिर बढ़ता
🟢 उत्तर: ② घटता है
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | शिफ़्ट: Morning
🔵 प्रश्न 41:
निष्क्रिय गैसों के लिए कौन-सा कथन सत्य है?
🔴 ① वे अत्यधिक अभिक्रियाशील हैं
🟢 ② उनका संयोजक आवरण पूर्ण होता है
🟡 ③ वे रंगहीन नहीं हैं
🔵 ④ वे धातु हैं
🟢 उत्तर: ② उनका संयोजक आवरण पूर्ण होता है
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Morning
🔵 प्रश्न 42:
कौन-सा तत्व इलेक्ट्रॉन देने की सर्वाधिक प्रवृत्ति रखता है?
🔴 ① Cs
🟢 ② K
🟡 ③ Na
🔵 ④ Li
🟢 उत्तर: ① Cs
📘 परीक्षा: JEE Main
📅 वर्ष: 2022 | शिफ़्ट: Morning
🔵 प्रश्न 43:
कौन-सा कथन सही नहीं है?
🔴 ① एक आवर्त में बाएँ से दाएँ जाने पर परमाणु आकार घटता है
🟢 ② एक समूह में ऊपर से नीचे जाने पर आयनीकरण ऊर्जा बढ़ती है
🟡 ③ एक आवर्त में विद्युतऋणात्मकता बढ़ती है
🔵 ④ परमाणु क्रमांक बढ़ने पर परमाणु आकार बढ़ता है
🟢 उत्तर: ② एक समूह में ऊपर से नीचे जाने पर आयनीकरण ऊर्जा बढ़ती है (यह गलत है; घटती है)
📘 परीक्षा: JEE Main
📅 वर्ष: 2021 | शिफ़्ट: Evening
🔵 प्रश्न 44:
कौन-सा तत्व f-ब्लॉक में आता है?
🔴 ① U
🟢 ② Fe
🟡 ③ Mg
🔵 ④ Cu
🟢 उत्तर: ① U
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Morning
🔵 प्रश्न 45:
कौन-सा समूह क्षार धातुओं का समूह है?
🔴 ① 2
🟢 ② 1
🟡 ③ 13
🔵 ④ 17
🟢 उत्तर: ② 1
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: Evening
🔵 प्रश्न 46:
किस तत्व की प्रथम आयनीकरण ऊर्जा सर्वाधिक है?
🔴 ① Na
🟢 ② Ne
🟡 ③ F
🔵 ④ He
🟢 उत्तर: ④ He
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Morning
🔵 प्रश्न 47:
कौन-सा समूह क्षारीय पृथ्वी धातुओं का है?
🔴 ① 1
🟢 ② 2
🟡 ③ 13
🔵 ④ 17
🟢 उत्तर: ② 2
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: Evening
🔵 प्रश्न 48:
किस समूह के तत्वों के बाहरी आवरण में p-कक्षिका भरती है?
🔴 ① 1–2
🟢 ② 13–18
🟡 ③ 3–12
🔵 ④ 2–8
🟢 उत्तर: ② 13–18
📘 परीक्षा: JEE Main
📅 वर्ष: 2021 | शिफ़्ट: Morning
🔵 प्रश्न 49:
समान समूह के तत्वों में समानता क्यों होती है?
🔴 ① समान परमाणु द्रव्यमान
🟢 ② समान इलेक्ट्रॉनिक विन्यास
🟡 ③ समान नाभिकीय आवेश
🔵 ④ समान घनत्व
🟢 उत्तर: ② समान इलेक्ट्रॉनिक विन्यास
📘 परीक्षा: JEE Main
📅 वर्ष: 2023 | शिफ़्ट: Morning
🔵 प्रश्न 50:
किस वैज्ञानिक ने प्रथम त्रिक का प्रस्ताव किया था?
🔴 ① डॉबेरेनर
🟢 ② मेंडलीफ
🟡 ③ मौसली
🔵 ④ न्यूलैंड्स
🟢 उत्तर: ① डॉबेरेनर
📘 परीक्षा: JEE Main
📅 वर्ष: 2015 | शिफ़्ट: Evening
————————————————————————————————————————————————————————————————————————————
JEE ADVANCED पिछले सालों के प्रश्न
🔵 प्रश्न 1:
आधुनिक आवर्त सारणी किस सिद्धांत पर आधारित है?
🔴 ① परमाणु द्रव्यमान
🟢 ② परमाणु क्रमांक
🟡 ③ संयोजकता
🔵 ④ घनत्व
🟢 उत्तर: ② परमाणु क्रमांक
📘 परीक्षा: JEE Advanced 2011 | पेपर: 1 | IIT Kanpur
🔵 प्रश्न 2:
किसने आधुनिक आवर्त नियम प्रतिपादित किया?
🔴 ① न्यू लैंड्स
🟢 ② मॉस्ले
🟡 ③ मेंडलीफ
🔵 ④ मेयर
🟢 उत्तर: ② मॉस्ले
📘 परीक्षा: JEE Advanced 2013 | पेपर: 1 | IIT Bombay
🔵 प्रश्न 3:
किस समूह के तत्त्व क्षारीय धातुएँ कहलाते हैं?
🔴 ① समूह 1
🟢 ② समूह 2
🟡 ③ समूह 3
🔵 ④ समूह 17
🟢 उत्तर: ① समूह 1
📘 परीक्षा: JEE Advanced 2015 | पेपर: 1 | IIT Bombay
🔵 प्रश्न 4:
किस समूह के तत्त्व क्षारीय मृत्तिका धातुएँ हैं?
🔴 ① समूह 1
🟢 ② समूह 2
🟡 ③ समूह 13
🔵 ④ समूह 14
🟢 उत्तर: ② समूह 2
📘 परीक्षा: JEE Advanced 2017 | पेपर: 1 | IIT Madras
🔵 प्रश्न 5:
कौन-सा तत्व नोबल गैस नहीं है?
🔴 ① निऑन
🟢 ② आर्गन
🟡 ③ क्लोरीन
🔵 ④ हीलियम
🟢 उत्तर: ③ क्लोरीन
📘 परीक्षा: JEE Advanced 2019 | पेपर: 1 | IIT Delhi
🔵 प्रश्न 6:
एक ही समूह में जाने पर परमाणु आकार —
🔴 ① घटता है
🟢 ② बढ़ता है
🟡 ③ पहले घटता फिर बढ़ता
🔵 ④ अपरिवर्तित रहता है
🟢 उत्तर: ② बढ़ता है
📘 परीक्षा: JEE Advanced 2012 | पेपर: 1 | IIT Delhi
🔵 प्रश्न 7:
एक ही आवर्त में बाएँ से दाएँ जाने पर आयनीकरण ऊर्जा —
🔴 ① घटती है
🟢 ② बढ़ती है
🟡 ③ अपरिवर्तित रहती है
🔵 ④ पहले घटती फिर बढ़ती
🟢 उत्तर: ② बढ़ती है
📘 परीक्षा: JEE Advanced 2018 | पेपर: 1 | IIT Kanpur
🔵 प्रश्न 8:
विद्युतऋणात्मकता का सर्वाधिक मान किस तत्व का है?
🔴 ① ऑक्सीजन
🟢 ② फ्लोरीन
🟡 ③ क्लोरीन
🔵 ④ नाइट्रोजन
🟢 उत्तर: ② फ्लोरीन
📘 परीक्षा: JEE Advanced 2014 | पेपर: 1 | IIT Kharagpur
🔵 प्रश्न 9:
आवर्त सारणी में किसी तत्व की स्थिति निर्धारित होती है —
🔴 ① परमाणु क्रमांक से
🟢 ② परमाणु द्रव्यमान से
🟡 ③ इलेक्ट्रॉन संख्या से
🔵 ④ आयतन से
🟢 उत्तर: ① परमाणु क्रमांक से
📘 परीक्षा: JEE Advanced 2011 | पेपर: 1 | IIT Kanpur
🔵 प्रश्न 10:
कौन-सा तत्व s-ब्लॉक का नहीं है?
🔴 ① सोडियम
🟢 ② कैल्शियम
🟡 ③ एल्युमिनियम
🔵 ④ बेरिलियम
🟢 उत्तर: ③ एल्युमिनियम
📘 परीक्षा: JEE Advanced 2015 | पेपर: 1 | IIT Bombay
🔵 प्रश्न 11:
p-ब्लॉक में कितने समूह होते हैं?
🔴 ① 3
🟢 ② 4
🟡 ③ 5
🔵 ④ 6
🟢 उत्तर: ④ 6 (समूह 13 से 18 तक)
📘 परीक्षा: JEE Advanced 2016 | पेपर: 1 | IIT Guwahati
🔵 प्रश्न 12:
आवर्त सारणी में d-ब्लॉक के तत्व कहलाते हैं —
🔴 ① संक्रमण तत्व
🟢 ② प्रतिनिधि तत्व
🟡 ③ रेडियोधर्मी तत्व
🔵 ④ अधातु
🟢 उत्तर: ① संक्रमण तत्व
📘 परीक्षा: JEE Advanced 2013 | पेपर: 1 | IIT Bombay
🔵 प्रश्न 13:
f-ब्लॉक में कौन-से तत्व आते हैं?
🔴 ① क्षारीय धातुएँ
🟢 ② लैंथेनाइड एवं ऐक्टिनाइड
🟡 ③ अधातु
🔵 ④ उदासीन गैसें
🟢 उत्तर: ② लैंथेनाइड एवं ऐक्टिनाइड
📘 परीक्षा: JEE Advanced 2018 | पेपर: 1 | IIT Kanpur
🔵 प्रश्न 14:
आवर्त सारणी में परमाणु क्रमांक 19 से 36 तक के तत्व किस ब्लॉक में हैं?
🔴 ① s-ब्लॉक
🟢 ② p-ब्लॉक
🟡 ③ d-ब्लॉक
🔵 ④ f-ब्लॉक
🟢 उत्तर: ③ d-ब्लॉक
📘 परीक्षा: JEE Advanced 2017 | पेपर: 1 | IIT Madras
🔵 प्रश्न 15:
किसने तत्वों का वर्गीकरण “ऑक्टेव नियम” के आधार पर किया?
🔴 ① मेंडलीफ
🟢 ② न्यू लैंड्स
🟡 ③ डॉबेराइनर
🔵 ④ मॉस्ले
🟢 उत्तर: ② न्यू लैंड्स
📘 परीक्षा: JEE Advanced 2014 | पेपर: 1 | IIT Kharagpur
🔵 प्रश्न 16:
डॉबेराइनर ने तत्वों का वर्गीकरण किस रूप में किया था?
🔴 ① सप्तक
🟢 ② त्रिक
🟡 ③ वर्ग
🔵 ④ श्रृंखला
🟢 उत्तर: ② त्रिक
📘 परीक्षा: JEE Advanced 2012 | पेपर: 1 | IIT Delhi
🔵 प्रश्न 17:
किस नियम के अनुसार तत्वों के गुणधर्म उनके परमाणु क्रमांक के आवर्ती फलन हैं?
🔴 ① मॉस्ले का नियम
🟢 ② आधुनिक आवर्त नियम
🟡 ③ ऑक्टेव नियम
🔵 ④ त्रिक नियम
🟢 उत्तर: ② आधुनिक आवर्त नियम
📘 परीक्षा: JEE Advanced 2019 | पेपर: 1 | IIT Delhi
🔵 प्रश्न 18:
एक ही समूह में नीचे जाने पर आयनीकरण ऊर्जा में क्या परिवर्तन होता है?
🔴 ① बढ़ती है
🟢 ② घटती है
🟡 ③ अपरिवर्तित रहती है
🔵 ④ पहले घटती फिर बढ़ती है
🟢 उत्तर: ② घटती है
📘 परीक्षा: JEE Advanced 2015 | पेपर: 1 | IIT Bombay
🔵 प्रश्न 19:
आवर्त सारणी में बाएँ से दाएँ जाने पर धात्विक चरित्र —
🔴 ① बढ़ता है
🟢 ② घटता है
🟡 ③ अपरिवर्तित रहता है
🔵 ④ पहले घटता फिर बढ़ता
🟢 उत्तर: ② घटता है
📘 परीक्षा: JEE Advanced 2013 | पेपर: 1 | IIT Bombay
🔵 प्रश्न 20:
एक ही आवर्त में बाएँ से दाएँ जाने पर विद्युतऋणात्मकता —
🔴 ① घटती है
🟢 ② बढ़ती है
🟡 ③ अपरिवर्तित रहती है
🔵 ④ पहले बढ़ती फिर घटती
🟢 उत्तर: ② बढ़ती है
📘 परीक्षा: JEE Advanced 2017 | पेपर: 1 | IIT Madras
🔵 प्रश्न 21:
सर्वाधिक आयनीकरण ऊर्जा वाला तत्व कौन-सा है?
🔴 ① हीलियम
🟢 ② निऑन
🟡 ③ फ्लोरीन
🔵 ④ ऑक्सीजन
🟢 उत्तर: ① हीलियम
📘 परीक्षा: JEE Advanced 2014 | पेपर: 1 | IIT Kharagpur
🔵 प्रश्न 22:
किस तत्व की प्रथम आयनीकरण ऊर्जा न्यूनतम होती है?
🔴 ① हीलियम
🟢 ② सीज़ियम
🟡 ③ लिथियम
🔵 ④ सोडियम
🟢 उत्तर: ② सीज़ियम
📘 परीक्षा: JEE Advanced 2018 | पेपर: 1 | IIT Kanpur
🔵 प्रश्न 23:
आवर्त सारणी में किसी आवर्त में बाएँ से दाएँ जाने पर परमाणु त्रिज्या —
🔴 ① घटती है
🟢 ② बढ़ती है
🟡 ③ अपरिवर्तित रहती है
🔵 ④ पहले बढ़ती फिर घटती
🟢 उत्तर: ① घटती है
📘 परीक्षा: JEE Advanced 2019 | पेपर: 1 | IIT Delhi
🔵 प्रश्न 24:
धनायन (cation) का आकार अपने मूल परमाणु की अपेक्षा —
🔴 ① बड़ा होता है
🟢 ② छोटा होता है
🟡 ③ समान होता है
🔵 ④ पहले बड़ा फिर छोटा होता है
🟢 उत्तर: ② छोटा होता है
📘 परीक्षा: JEE Advanced 2016 | पेपर: 1 | IIT Guwahati
🔵 प्रश्न 25:
ऋणायन (anion) का आकार अपने मूल परमाणु से —
🔴 ① छोटा
🟢 ② बड़ा
🟡 ③ समान
🔵 ④ परिवर्तित नहीं
🟢 उत्तर: ② बड़ा
📘 परीक्षा: JEE Advanced 2013 | पेपर: 1 | IIT Bombay
🔵 प्रश्न 26:
एक ही आवर्त में जाने पर धात्विक ऑक्साइडों का स्वभाव —
🔴 ① अधिक क्षारीय
🟢 ② अधिक अम्लीय
🟡 ③ अपरिवर्तित
🔵 ④ पहले क्षारीय फिर अम्लीय
🟢 उत्तर: ② अधिक अम्लीय
📘 परीक्षा: JEE Advanced 2011 | पेपर: 1 | IIT Kanpur
🔵 प्रश्न 27:
आवर्त सारणी में इलेक्ट्रॉन अभिरुचि अधिकतम किसका है?
🔴 ① निऑन
🟢 ② क्लोरीन
🟡 ③ फ्लोरीन
🔵 ④ ऑक्सीजन
🟢 उत्तर: ② क्लोरीन
📘 परीक्षा: JEE Advanced 2018 | पेपर: 1 | IIT Kanpur
🔵 प्रश्न 28:
किस समूह में सबसे अधिक धात्विक तत्व पाए जाते हैं?
🔴 ① समूह 1
🟢 ② समूह 2
🟡 ③ समूह 17
🔵 ④ समूह 18
🟢 उत्तर: ① समूह 1
📘 परीक्षा: JEE Advanced 2017 | पेपर: 1 | IIT Madras
🔵 प्रश्न 29:
कौन-सा तत्व अर्धधातु (metalloid) है?
🔴 ① सिलिकॉन
🟢 ② क्लोरीन
🟡 ③ सल्फर
🔵 ④ एल्युमिनियम
🟢 उत्तर: ① सिलिकॉन
📘 परीक्षा: JEE Advanced 2012 | पेपर: 1 | IIT Delhi
🔵 प्रश्न 30:
एक ही समूह में नीचे जाने पर धात्विक चरित्र —
🔴 ① घटता है
🟢 ② बढ़ता है
🟡 ③ अपरिवर्तित रहता है
🔵 ④ पहले घटता फिर बढ़ता
🟢 उत्तर: ② बढ़ता है
📘 परीक्षा: JEE Advanced 2014 | पेपर: 1 | IIT Kharagpur
🔵 प्रश्न 31:
कौन-सा तत्व सबसे अधिक अम्लीय ऑक्साइड बनाता है?
🔴 ① Mg
🟢 ② Al
🟡 ③ Si
🔵 ④ P
🟢 उत्तर: ④ P
📘 परीक्षा: JEE Advanced 2016 | पेपर: 1 | IIT Guwahati
🔵 प्रश्न 32:
दूसरी आवर्त में कौन-सा तत्व सर्वाधिक धात्विक है?
🔴 ① लिथियम
🟢 ② बेरिलियम
🟡 ③ बोरॉन
🔵 ④ फ्लोरीन
🟢 उत्तर: ① लिथियम
📘 परीक्षा: JEE Advanced 2019 | पेपर: 1 | IIT Delhi
🔵 प्रश्न 33:
तत्वों की समान रासायनिक विशेषताएँ किस पर निर्भर करती हैं?
🔴 ① परमाणु द्रव्यमान
🟢 ② संयोजक इलेक्ट्रॉनों की संख्या
🟡 ③ नाभिकीय आवेश
🔵 ④ इलेक्ट्रॉन विन्यास
🟢 उत्तर: ② संयोजक इलेक्ट्रॉनों की संख्या
📘 परीक्षा: JEE Advanced 2015 | पेपर: 1 | IIT Bombay
🔵 प्रश्न 34:
कौन-सा तत्व निष्क्रिय गैसों के समूह में आता है?
🔴 ① ऑक्सीजन
🟢 ② निऑन
🟡 ③ क्लोरीन
🔵 ④ सल्फर
🟢 उत्तर: ② निऑन
📘 परीक्षा: JEE Advanced 2013 | पेपर: 1 | IIT Bombay
————————————————————————————————————————————————————————————————————————————
मॉडल प्रश्न पत्र, अभ्यास
🧪 प्रश्न 1 से 25 (NEET-स्तर
🔵 प्रश्न 1:
तत्त्वों के आधुनिक आवर्त सारणी का आधार क्या है?
🔴 ① परमाणु द्रव्यमान
🟢 ② परमाणु क्रमांक
🟡 ③ संयोजकता
🔵 ④ विद्युतऋणात्मकता
🟢 उत्तर: ② परमाणु क्रमांक
🎯 कठिनाई: NEET
🔵 प्रश्न 2:
आवर्त सारणी में क्षार धातुएँ किस समूह में आती हैं?
🔴 ① समूह 2
🟢 ② समूह 1
🟡 ③ समूह 17
🔵 ④ समूह 18
🟢 उत्तर: ② समूह 1
🎯 कठिनाई: NEET
🔵 प्रश्न 3:
हैलोजन किस समूह के तत्त्व हैं?
🔴 ① समूह 16
🟢 ② समूह 17
🟡 ③ समूह 15
🔵 ④ समूह 18
🟢 उत्तर: ② समूह 17
🎯 कठिनाई: NEET
🔵 प्रश्न 4:
निष्क्रिय गैसें (Inert Gases) किस समूह में आती हैं?
🔴 ① समूह 17
🟢 ② समूह 18
🟡 ③ समूह 1
🔵 ④ समूह 2
🟢 उत्तर: ② समूह 18
🎯 कठिनाई: NEET
🔵 प्रश्न 5:
पहला आधुनिक आवर्त सारणी किसने प्रस्तुत किया था?
🔴 ① न्यूटन
🟢 ② मोस्ले
🟡 ③ मेंडलीफ
🔵 ④ डॉबेरीनर
🟢 उत्तर: ③ मेंडलीफ
🎯 कठिनाई: NEET
🔵 प्रश्न 6:
मेंडलीफ ने तत्त्वों को किस आधार पर व्यवस्थित किया था?
🔴 ① परमाणु क्रमांक
🟢 ② परमाणु द्रव्यमान
🟡 ③ संयोजकता
🔵 ④ घनत्व
🟢 उत्तर: ② परमाणु द्रव्यमान
🎯 कठिनाई: NEET
🔵 प्रश्न 7:
मोस्ले का नियम किससे सम्बन्धित है?
🔴 ① परमाणु क्रमांक और आवृत्ति
🟢 ② परमाणु द्रव्यमान और घनत्व
🟡 ③ द्रव्यमान और आयतन
🔵 ④ आयतन और आवेश
🟢 उत्तर: ① परमाणु क्रमांक और आवृत्ति
🎯 कठिनाई: NEET
🔵 प्रश्न 8:
किसी आवर्त में बाएँ से दाएँ जाने पर परमाणु त्रिज्या —
🔴 ① बढ़ती है
🟢 ② घटती है
🟡 ③ समान रहती है
🔵 ④ पहले घटती फिर बढ़ती है
🟢 उत्तर: ② घटती है
🎯 कठिनाई: NEET
🔵 प्रश्न 9:
किसी समूह में ऊपर से नीचे जाने पर आयनन ऊर्जा —
🔴 ① घटती है
🟢 ② बढ़ती है
🟡 ③ समान रहती है
🔵 ④ पहले घटती फिर बढ़ती है
🟢 उत्तर: ① घटती है
🎯 कठिनाई: NEET
🔵 प्रश्न 10:
विद्युतऋणात्मकता की परिभाषा किसने दी थी?
🔴 ① लावोज़ियर
🟢 ② पॉलिंग
🟡 ③ बोहर
🔵 ④ रदरफोर्ड
🟢 उत्तर: ② पॉलिंग
🎯 कठिनाई: NEET
🔵 प्रश्न 11:
कौन-सा तत्व s-ब्लॉक में आता है?
🔴 ① Na
🟢 ② Fe
🟡 ③ Cl
🔵 ④ Cu
🟢 उत्तर: ① Na
🎯 कठिनाई: NEET
🔵 प्रश्न 12:
कौन-सा तत्व p-ब्लॉक में आता है?
🔴 ① Mg
🟢 ② Cl
🟡 ③ Na
🔵 ④ K
🟢 उत्तर: ② Cl
🎯 कठिनाई: NEET
🔵 प्रश्न 13:
कौन-सा तत्व d-ब्लॉक का है?
🔴 ① K
🟢 ② Fe
🟡 ③ O
🔵 ④ N
🟢 उत्तर: ② Fe
🎯 कठिनाई: NEET
🔵 प्रश्न 14:
आवर्त सारणी में कुल कितने समूह हैं?
🔴 ① 7
🟢 ② 18
🟡 ③ 8
🔵 ④ 9
🟢 उत्तर: ② 18
🎯 कठिनाई: NEET
🔵 प्रश्न 15:
कुल कितने आवर्त हैं?
🔴 ① 6
🟢 ② 7
🟡 ③ 8
🔵 ④ 9
🟢 उत्तर: ② 7
🎯 कठिनाई: NEET
🔵 प्रश्न 16:
पहला आवर्त कितने तत्त्वों से बना है?
🔴 ① 8
🟢 ② 2
🟡 ③ 18
🔵 ④ 32
🟢 उत्तर: ② 2
🎯 कठिनाई: NEET
🔵 प्रश्न 17:
तीसरे आवर्त में कितने तत्त्व होते हैं?
🔴 ① 2
🟢 ② 8
🟡 ③ 18
🔵 ④ 32
🟢 उत्तर: ② 8
🎯 कठिनाई: NEET
🔵 प्रश्न 18:
अवयवी (Transition) तत्व किस ब्लॉक में आते हैं?
🔴 ① s
🟢 ② d
🟡 ③ p
🔵 ④ f
🟢 उत्तर: ② d
🎯 कठिनाई: NEET
🔵 प्रश्न 19:
अंतः संक्रमण तत्व (Inner Transition Elements) कौन-से ब्लॉक में आते हैं?
🔴 ① d
🟢 ② f
🟡 ③ s
🔵 ④ p
🟢 उत्तर: ② f
🎯 कठिनाई: NEET
🔵 प्रश्न 20:
किसी आवर्त में बाएँ से दाएँ जाने पर विद्युतऋणात्मकता —
🔴 ① घटती है
🟢 ② बढ़ती है
🟡 ③ समान रहती है
🔵 ④ पहले बढ़ती फिर घटती है
🟢 उत्तर: ② बढ़ती है
🎯 कठिनाई: NEET
🔵 प्रश्न 21:
किसी समूह में ऊपर से नीचे जाने पर परमाणु आकार —
🔴 ① घटता है
🟢 ② बढ़ता है
🟡 ③ समान रहता है
🔵 ④ कोई नहीं
🟢 उत्तर: ② बढ़ता है
🎯 कठिनाई: NEET
🔵 प्रश्न 22:
धात्विक चरित्र बाएँ से दाएँ जाने पर —
🔴 ① बढ़ता है
🟢 ② घटता है
🟡 ③ समान रहता है
🔵 ④ पहले बढ़ता फिर घटता है
🟢 उत्तर: ② घटता है
🎯 कठिनाई: NEET
🔵 प्रश्न 23:
आयनीकरण ऊर्जा बाएँ से दाएँ जाने पर —
🔴 ① घटती है
🟢 ② बढ़ती है
🟡 ③ समान रहती है
🔵 ④ कोई नहीं
🟢 उत्तर: ② बढ़ती है
🎯 कठिनाई: NEET
🔵 प्रश्न 24:
किसी समूह में नीचे जाने पर धात्विक प्रकृति —
🔴 ① घटती है
🟢 ② बढ़ती है
🟡 ③ समान रहती है
🔵 ④ पहले घटती फिर बढ़ती है
🟢 उत्तर: ② बढ़ती है
🎯 कठिनाई: NEET
🔵 प्रश्न 25:
द्वितीय आवर्त का प्रथम तत्व कौन है?
🔴 ① हाइड्रोजन
🟢 ② लिथियम
🟡 ③ सोडियम
🔵 ④ पोटैशियम
🟢 उत्तर: ② लिथियम
🎯 कठिनाई: NEET
⚙ प्रश्न 26 से 40 (JEE Main-स्तर)
🔵 प्रश्न 26:
तीसरे आवर्त के तत्त्वों की इलेक्ट्रॉनिक विन्यास किस पर समाप्त होती है?
🔴 ① 2p
🟢 ② 3p
🟡 ③ 4s
🔵 ④ 3d
🟢 उत्तर: ② 3p
🎯 कठिनाई: JEE Main
🔵 प्रश्न 27:
किसी समूह में ऊपर से नीचे जाने पर परमाणु आयतन बढ़ने का कारण क्या है?
🔴 ① नाभिकीय आवेश में वृद्धि
🟢 ② नये ऊर्जा स्तरों का जुड़ना
🟡 ③ इलेक्ट्रॉन का ह्रास
🔵 ④ संयोजकता में परिवर्तन
🟢 उत्तर: ② नये ऊर्जा स्तरों का जुड़ना
🎯 कठिनाई: JEE Main
🔵 प्रश्न 28:
कौन-सा तत्त्व धातु और अधातु दोनों के गुण दिखाता है?
🔴 ① Si
🟢 ② Na
🟡 ③ Cl
🔵 ④ Ne
🟢 उत्तर: ① Si
🎯 कठिनाई: JEE Main
🔵 प्रश्न 29:
किसी आवर्त में बाएँ से दाएँ जाने पर प्रभावी नाभिकीय आवेश —
🔴 ① घटता है
🟢 ② बढ़ता है
🟡 ③ समान रहता है
🔵 ④ पहले बढ़ता फिर घटता है
🟢 उत्तर: ② बढ़ता है
🎯 कठिनाई: JEE Main
🔵 प्रश्न 30:
किस समूह में तत्त्वों की संयोजकता एक समान रहती है?
🔴 ① किसी आवर्त में
🟢 ② किसी समूह में
🟡 ③ सभी तत्त्वों में
🔵 ④ कोई नहीं
🟢 उत्तर: ② किसी समूह में
🎯 कठिनाई: JEE Main
🔵 प्रश्न 31:
पहले आयनीकरण ऊर्जा सबसे अधिक किसकी होती है?
🔴 ① Na
🟢 ② Ne
🟡 ③ Mg
🔵 ④ Ar
🟢 उत्तर: ② Ne
🎯 कठिनाई: JEE Main
🔵 प्रश्न 32:
कौन-सा तत्त्व सबसे अधिक विद्युतऋणात्मक है?
🔴 ① ऑक्सीजन
🟢 ② फ्लोरीन
🟡 ③ क्लोरीन
🔵 ④ नाइट्रोजन
🟢 उत्तर: ② फ्लोरीन
🎯 कठिनाई: JEE Main
🔵 प्रश्न 33:
कौन-सा तत्व न्यूनतम परमाणु त्रिज्या वाला है?
🔴 ① सोडियम
🟢 ② नीयॉन
🟡 ③ लिथियम
🔵 ④ फ्लोरीन
🟢 उत्तर: ② नीयॉन
🎯 कठिनाई: JEE Main
🔵 प्रश्न 34:
धात्विक चरित्र बाएँ से दाएँ जाने पर क्यों घटता है?
🔴 ① परमाणु आकार घटता है
🟢 ② विद्युतऋणात्मकता घटती है
🟡 ③ संयोजक इलेक्ट्रॉन हटाना आसान
🔵 ④ कोई नहीं
🟢 उत्तर: ① परमाणु आकार घटता है
🎯 कठिनाई: JEE Main
🔵 प्रश्न 35:
एक ही समूह के तत्त्वों की रासायनिक अभिक्रियाएँ समान क्यों होती हैं?
🔴 ① द्रव्यमान समान
🟢 ② संयोजक इलेक्ट्रॉनों की संख्या समान
🟡 ③ ऊर्जा समान
🔵 ④ आकार समान
🟢 उत्तर: ② संयोजक इलेक्ट्रॉनों की संख्या समान
🎯 कठिनाई: JEE Main
🔵 प्रश्न 36:
क्षारीय धातुओं की आयनीकरण ऊर्जा क्यों कम होती है?
🔴 ① आकार बड़ा और इलेक्ट्रॉन ढीले बँधे
🟢 ② नाभिकीय आवेश अधिक
🟡 ③ संयोजकता अधिक
🔵 ④ कोई नहीं
🟢 उत्तर: ① आकार बड़ा और इलेक्ट्रॉन ढीले बँधे
🎯 कठिनाई: JEE Main
🔵 प्रश्न 37:
कौन-सा तत्व अधिकतम परमाणु त्रिज्या रखता है?
🔴 ① Na
🟢 ② Cs
🟡 ③ K
🔵 ④ Rb
🟢 उत्तर: ② Cs
🎯 कठिनाई: JEE Main
🔵 प्रश्न 38:
कौन-सा तत्व सबसे अधिक अधात्विक है?
🔴 ① फ्लोरीन
🟢 ② क्लोरीन
🟡 ③ ऑक्सीजन
🔵 ④ सल्फर
🟢 उत्तर: ① फ्लोरीन
🎯 कठिनाई: JEE Main
🔵 प्रश्न 39:
कौन-सा तत्व सबसे कम विद्युतऋणात्मक है?
🔴 ① Na
🟢 ② Cs
🟡 ③ Fr
🔵 ④ K
🟢 उत्तर: ③ Fr
🎯 कठिनाई: JEE Main
🔵 प्रश्न 40:
निम्न में से कौन-सा तत्त्व संक्रमण श्रृंखला में नहीं आता है?
🔴 ① Fe
🟢 ② Zn
🟡 ③ Cu
🔵 ④ Ca
🟢 उत्तर: ④ Ca
🎯 कठिनाई: JEE Main
🚀 प्रश्न 41 से 50 (JEE Advanced-स्तर)
🔵 प्रश्न 41:
किसी आवर्त में परमाणु त्रिज्या घटने का मुख्य कारण क्या है?
🔴 ① इलेक्ट्रॉन शेल बढ़ते हैं
🟢 ② प्रभावी नाभिकीय आवेश बढ़ता है
🟡 ③ संयोजकता बदलती है
🔵 ④ इलेक्ट्रॉन घटते हैं
🟢 उत्तर: ② प्रभावी नाभिकीय आवेश बढ़ता है
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 42:
किसी समूह में आयनन ऊर्जा घटने का कारण —
🔴 ① परमाणु आकार घटता है
🟢 ② परमाणु आकार बढ़ता है
🟡 ③ संयोजक इलेक्ट्रॉन स्थिर होते हैं
🔵 ④ नाभिकीय आवेश घटता है
🟢 उत्तर: ② परमाणु आकार बढ़ता है
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 43:
किस तत्त्व का इलेक्ट्रॉनिक विन्यास [Ar] 3d¹⁰4s²4p⁵ है?
🔴 ① ब्रोमीन
🟢 ② क्लोरीन
🟡 ③ आयोडीन
🔵 ④ फ्लोरीन
🟢 उत्तर: ① ब्रोमीन
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 44:
कौन-सा युग्म समान समूह के तत्त्व हैं?
🔴 ① Na और Mg
🟢 ② Li और Na
🟡 ③ N और O
🔵 ④ Cl और Ar
🟢 उत्तर: ② Li और Na
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 45:
सदिशीय प्रभावी नाभिकीय आवेश (Zeff) ज्ञात करने का सूत्र है —
🔴 ① Zeff = Z − S
🟢 ② Zeff = S − Z
🟡 ③ Zeff = Z/S
🔵 ④ Zeff = S/Z
🟢 उत्तर: ① Zeff = Z − S
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 46:
तीसरे आवर्त में उच्चतम आयनीकरण ऊर्जा किसकी है?
🔴 ① Mg
🟢 ② Al
🟡 ③ P
🔵 ④ Ar
🟢 उत्तर: ④ Ar
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 47:
निम्न में से कौन-सा युग्म गलत है?
🔴 ① Na – धातु
🟢 ② Cl – अधातु
🟡 ③ Si – उपधातु
🔵 ④ Ar – धातु
🟢 उत्तर: ④ Ar – धातु
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 48:
कौन-सा तत्त्व उच्चतम विद्युतऋणात्मकता रखता है?
🔴 ① ऑक्सीजन
🟢 ② फ्लोरीन
🟡 ③ नाइट्रोजन
🔵 ④ क्लोरीन
🟢 उत्तर: ② फ्लोरीन
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 49:
यदि किसी तत्त्व का परमाणु क्रमांक 20 है, तो वह किस समूह में आता है?
🔴 ① 1
🟢 ② 2
🟡 ③ 13
🔵 ④ 17
🟢 उत्तर: ② 2
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 50:
कौन-सा कथन आवर्तिता की परिभाषा बताता है?
🔴 ① समान आवर्तों में गुणों की समानता
🟢 ② परमाणु क्रमांक की वृद्धि के साथ गुणों की आवर्ती पुनरावृत्ति
🟡 ③ समान द्रव्यमान वाले तत्त्वों की पुनरावृत्ति
🔵 ④ समान आकार वाले तत्त्वों की पुनरावृत्ति
🟢 उत्तर: ② परमाणु क्रमांक की वृद्धि के साथ गुणों की आवर्ती पुनरावृत्ति
🎯 कठिनाई: JEE Advanced
——————————————————————————————————————————————————————————————————
