Class 11 : Chemistry (In Hindi) – Lesson 2.परमाणु की संरचना
पाठ का विश्लेषण एवं विवेचन
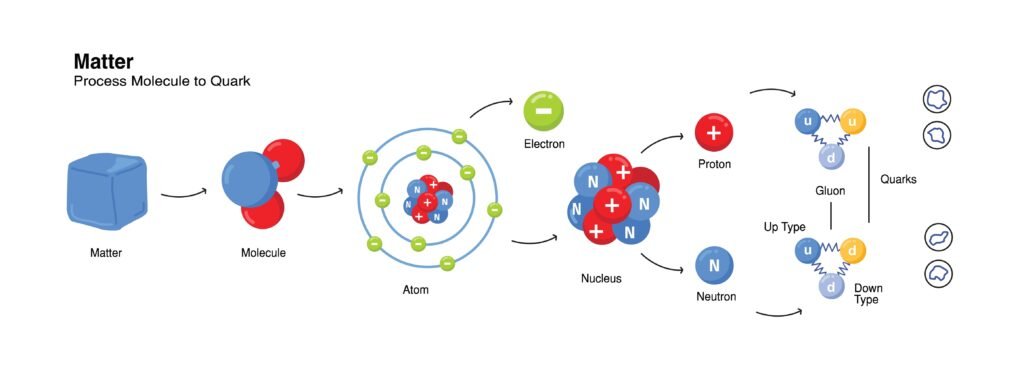
परमाणु वह सूक्ष्मतम इकाई है जो किसी भी तत्व के सभी रासायनिक गुणों को सुरक्षित रखती है। 🌟 प्राचीन समय से ही वैज्ञानिक यह जानना चाहते थे कि पदार्थ किससे बना है। धीरे-धीरे अनेक प्रयोगों और सिद्धान्तों से स्पष्ट हुआ कि परमाणु का भी एक जटिल आंतरिक ढाँचा होता है। ✨ परमाणु की संरचना का अध्ययन भौतिक रसायन का आधार है क्योंकि इसी से तत्वों के गुण, अणुओं का निर्माण, रासायनिक बन्धन, तथा आवर्त सारणी में तत्वों की स्थिति का निर्धारण होता है।
🟢 डॉल्टन का परमाणु सिद्धान्त
📍 जॉन डॉल्टन ने 1803 में परमाणु सिद्धान्त दिया।
✏ मुख्य बिन्दु:
पदार्थ छोटे-छोटे अविभाज्य परमाणुओं से बने होते हैं।
एक ही तत्व के सभी परमाणु द्रव्यमान और गुणों में समान होते हैं।
यौगिक विभिन्न तत्वों के निश्चित अनुपात में संयोजन से बनते हैं।
रासायनिक अभिक्रियाओं में केवल परमाणुओं का पुनर्विन्यास होता है, उनका निर्माण या विनाश नहीं।
💡 यद्यपि यह सिद्धान्त पूर्णतः सही नहीं था (क्योंकि अब हम जानते हैं कि परमाणु भी विभाज्य है और समस्थानिक होते हैं), परन्तु इसने वैज्ञानिक सोच की नींव रखी।
🔴 इलेक्ट्रॉन की खोज
📍 जे. जे. थॉमसन ने 1897 में कैथोड किरण नलिका प्रयोग द्वारा इलेक्ट्रॉन की खोज की।
✨ निष्कर्ष:
इलेक्ट्रॉन ऋण आवेशित कण हैं।
इनका द्रव्यमान अत्यन्त सूक्ष्म होता है (9.1 × 10⁻³¹ kg)।
इनका आवेश –1.602 × 10⁻¹⁹ C होता है।
➡ इस खोज से यह स्पष्ट हुआ कि परमाणु अविभाज्य नहीं है।
🟡 प्रोटॉन और नाभिक की खोज
📍 गोल्डस्टीन ने एनोड किरणों (धनायन किरणें) से प्रोटॉन का संकेत दिया।
📍 1911 में रदरफोर्ड ने अपने प्रसिद्ध स्वर्ण पत्तिका प्रयोग से परमाणु के नाभिकीय मॉडल का प्रतिपादन किया।
🌟 स्वर्ण पत्तिका प्रयोग
अल्फा कणों की बौछार पतली स्वर्ण पत्तिका पर की गई।
अधिकांश कण सीधे निकल गये, कुछ थोड़े कोण पर विचलित हुए, और बहुत ही कम कण लगभग सीधे प्रत्यावर्तित हुए।
✔ निष्कर्ष:
परमाणु का अधिकतर भाग रिक्त है।
सम्पूर्ण धन आवेश तथा द्रव्यमान परमाणु के अति सूक्ष्म, घने नाभिक में केन्द्रित है।
इलेक्ट्रॉन नाभिक के चारों ओर घूमते हैं।

🔵 रदरफोर्ड मॉडल की सीमाएँ
✏ शास्त्रीय भौतिकी के अनुसार गतिमान इलेक्ट्रॉन निरन्तर ऊर्जा विकिरणित करते और अंततः नाभिक में गिर जाते। परन्तु वास्तविकता में ऐसा नहीं होता।
👉 इसलिए यह मॉडल स्थायित्व को समझा नहीं सका।

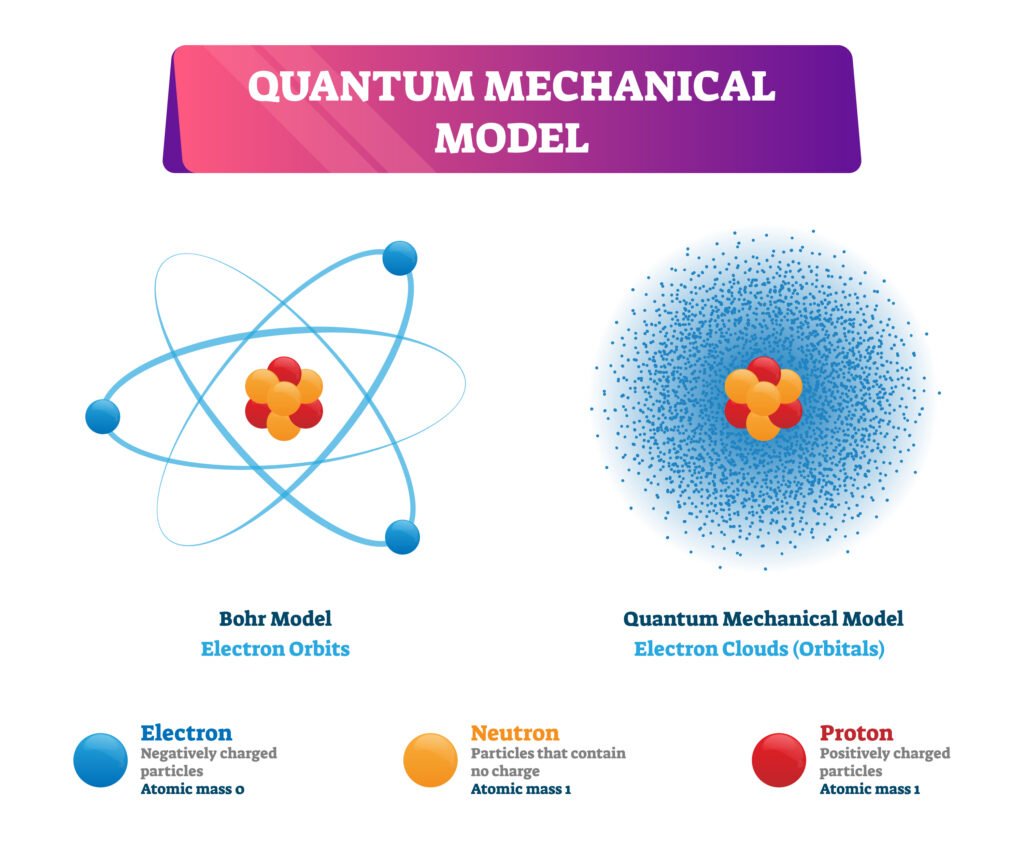
🟢 बोहर का परमाणु मॉडल (1913)
🌟 नील्स बोहर ने क्वांटम सिद्धान्त का प्रयोग करते हुए हाइड्रोजन परमाणु के लिए नया मॉडल प्रस्तुत किया।
मुख्य postulats:
इलेक्ट्रॉन नाभिक के चारों ओर निश्चित वृत्ताकार कक्षाओं (ऊर्जा स्तरों) में घूमते हैं।
प्रत्येक कक्षा की ऊर्जा निश्चित होती है।
जब तक इलेक्ट्रॉन किसी कक्षा में रहता है, वह ऊर्जा का विकिरण या अवशोषण नहीं करता।
ऊर्जा का उत्सर्जन/अवशोषण केवल तब होता है जब इलेक्ट्रॉन एक कक्षा से दूसरी में जाता है।
➡ ΔE = E₂ – E₁ = hν
📍 यह मॉडल हाइड्रोजन के वर्णक्रम को सफलतापूर्वक समझा पाया।
🔴 बोहर मॉडल की सीमाएँ
यह केवल एक-इलेक्ट्रॉन तंत्र (H, He⁺, Li²⁺) को ही समझा पाया।
बहु-इलेक्ट्रॉन परमाणुओं की जटिलता को नहीं समझा सका।
स्पेक्ट्रा में सूक्ष्म रेखाओं का कारण नहीं समझा सका।
🟡 क्वांटम यांत्रिक मॉडल
💡 आधुनिक परमाणु संरचना का आधार क्वांटम यांत्रिकी है।
👉 श्रॉडिंगर ने 1926 में तरंग समीकरण दिया।
🔵 परमाणु कक्षीय (Atomic Orbital)
📍 यह वह क्षेत्र है जहाँ इलेक्ट्रॉन के मिलने की सम्भावना सर्वाधिक होती है।
🌟 प्रमुख क्वांटम संख्याएँ:
मुख्य क्वांटम संख्या (n) – ऊर्जा स्तर बताती है।
आज़िमुथल क्वांटम संख्या (l) – कक्षीय का आकार।
चुंबकीय क्वांटम संख्या (m) – कक्षीय का उन्मुखन।
स्पिन क्वांटम संख्या (s) – इलेक्ट्रॉन का आंतरिक घूर्णन।
🟢 पौली का बहिष्करण सिद्धान्त
✏ किसी भी परमाणु में दो इलेक्ट्रॉन के सभी चार क्वांटम संख्याएँ समान नहीं हो सकतीं।
🔴 हंड का अधिकतम गुणनफल नियम
📍 किसी उपकक्षीय में इलेक्ट्रॉनों का भराव इस प्रकार होता है कि अधिकतम असमिश्रित इलेक्ट्रॉन उपस्थित रहें।
🟡 ऑउफबाउ नियम
📍 इलेक्ट्रॉनों का भराव न्यूनतम ऊर्जा स्तर से प्रारम्भ होकर क्रमशः उच्च स्तरों में होता है।
✨ क्रम: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s …
🔵 परमाणु की संरचना का महत्व
✔ रासायनिक बन्धन की व्याख्या।
✔ आवर्त सारणी में स्थिति का निर्धारण।
✔ तत्वों के गुणधर्मों का पूर्वानुमान।
✔ स्पेक्ट्रा और प्रकाश-विद्युत प्रभाव की समझ।
🔹 II. पाठ सारांश
📌 परमाणु अविभाज्य नहीं है; इसमें इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन पाए जाते हैं।
📌 इलेक्ट्रॉन की खोज थॉमसन ने कैथोड किरण नलिका से की।
📌 रदरफोर्ड ने स्वर्ण पत्तिका प्रयोग से नाभिक की उपस्थिति सिद्ध की।
📌 बोहर ने हाइड्रोजन के वर्णक्रम को समझाने हेतु कक्षाओं का मॉडल दिया।
📌 आधुनिक क्वांटम यांत्रिक मॉडल में इलेक्ट्रॉनों की स्थिति को तरंग समीकरण द्वारा सम्भावना के रूप में समझा गया।
📌 क्वांटम संख्याएँ n, l, m, s इलेक्ट्रॉनों की स्थिति और गुण बताते हैं।
📌 पौली का बहिष्करण सिद्धान्त, हंड का नियम और ऑउफबाउ सिद्धान्त इलेक्ट्रॉनों के भराव के प्रमुख नियम हैं।
📌 इस संरचना से तत्वों के गुण, आवर्त सारणी का स्वरूप और रासायनिक अभिक्रियाएँ समझी जाती हैं।
🔹 III. त्वरित पुनरावलोकन
📝
✔ परमाणु तीन मुख्य कणों से बना है – इलेक्ट्रॉन, प्रोटॉन, न्यूट्रॉन।
✔ रदरफोर्ड ने नाभिकीय मॉडल दिया, बोहर ने स्थायी कक्षाओं की अवधारणा दी।
✔ आधुनिक क्वांटम यांत्रिक मॉडल में इलेक्ट्रॉन को निश्चित पथ पर नहीं, बल्कि कक्षीय क्षेत्र में सम्भावना रूप में माना जाता है।
✔ क्वांटम संख्याएँ तथा इलेक्ट्रॉनों के भराव नियम (पौली, हंड, ऑउफबाउ) परमाणु की संरचना समझने में सहायक हैं।
✔ यही संरचना रसायन विज्ञान की समस्त शाखाओं की नींव है।
————————————————————————————————————————————————————————————————————————————
पाठ्यपुस्त के प्रश्न
🔵 प्रश्न 2.1:
एक ग्राम द्रव्यमान में इलेक्ट्रॉनों की संख्या का परिकलन कीजिए।
(ii) एक ग्राम इलेक्ट्रॉनों के द्रव्यमान और आवेश का परिकलन कीजिए।
🟢 उत्तर:
✳ (i) 1 मोल इलेक्ट्रॉन का द्रव्यमान = 1 ग्राम।
➡ 1 मोल में इलेक्ट्रॉनों की संख्या = एवोगैड्रो संख्या = 6.022 × 10²³।
✔ अतः 1 ग्राम में 6.022 × 10²³ इलेक्ट्रॉन होंगे।
✳ (ii) 1 इलेक्ट्रॉन का आवेश = 1.602 × 10⁻¹⁹ C
➡ कुल आवेश = 6.022 × 10²³ × 1.602 × 10⁻¹⁹ = 9.65 × 10⁴ C
➡ अतः कुल आवेश = 96500 कुलॉम्ब ✔
🔵 प्रश्न 2.2:
7 mg ¹⁴C में उपस्थित न्यूक्लियॉनों की संख्या का परिकलन कीजिए।
(न्यूक्लॉन का द्रव्यमान = 1.675 × 10⁻²⁷ kg मान लीजिए।)
🟢 उत्तर:
➡ ¹⁴C की द्रव्यमान संख्या = 14 ⇒ प्रत्येक परमाणु में 14 न्यूक्लियॉन।
➡ मोल = (7 × 10⁻³) / 14 = 5 × 10⁻⁴ mol
➡ कुल परमाणु = 5 × 10⁻⁴ × 6.022 × 10²³ = 3.011 × 10²⁰
➡ कुल न्यूक्लियॉन = 3.011 × 10²⁰ × 14 = 4.215 × 10²¹ न्यूक्लियॉन ✔
🔵 प्रश्न 2.3:
निम्नलिखित में उपस्थित न्यूट्रॉनों और प्रोटॉनों की संख्या ज्ञात कीजिए —
¹³₆C, ²⁴₁₂Mg, ⁵⁶₂₆Fe, ⁸⁸₃₈Sr
🟢 उत्तर:
परमाणु प्रोटॉन (Z) न्यूट्रॉन (A−Z)
¹³₆C 6 7
²⁴₁₂Mg 12 12
⁵⁶₂₆Fe 26 30
⁸⁸₃₈Sr 38 50
🔵 प्रश्न 2.4:
नीचे दिए गए परमाणु प्रतीकों (A) और परमाणु संख्या (Z) वाले परमाणुओं का पूर्ण प्रतीक लिखिए —
(i) Z = 17, A = 35
(ii) Z = 92, A = 233
(iii) Z = 4, A = 9
🟢 उत्तर:
(i) ³⁵₁₇Cl
(ii) ²³³₉₂U
(iii) ⁹₄Be ✔
🔵 प्रश्न 2.5:
सोडियम दीप द्वारा उत्सर्जित पीले प्रकाश की तरंग-दैर्ध्य (λ) 580 nm है।
इसकी आवृत्ति (ν) और ऊर्जा (E) का परिकलन कीजिए।
🟢 उत्तर:
➡ λ = 580 nm = 5.80 × 10⁻⁷ m
➡ ν = c / λ = 3 × 10⁸ / 5.80 × 10⁻⁷ = 5.17 × 10¹⁴ Hz
➡ E = hν = 6.626 × 10⁻³⁴ × 5.17 × 10¹⁴ = 3.43 × 10⁻¹⁹ J
✔ अतः आवृत्ति = 5.17 × 10¹⁴ Hz, ऊर्जा = 3.43 × 10⁻¹⁹ J
🔵 प्रश्न 2.6:
प्रत्येक फोटॉन की ऊर्जा ज्ञात कीजिए यदि प्रकाश की आवृत्ति 3 × 10¹⁵ Hz है।
🟢 उत्तर:
E = hν
= 6.626 × 10⁻³⁴ × 3 × 10¹⁵
= 1.9878 × 10⁻¹⁸ J = 1.99 × 10⁻¹⁸ J ✔
🔵 प्रश्न 2.7:
2.0 × 10⁸ Hz आवृत्ति वाले प्रकाश की तरंग-दैर्ध्य का परिकलन कीजिए।
🟢 उत्तर:
λ = c / ν = 3 × 10⁸ / 2 × 10⁸ = 1.5 m ✔
🔵 प्रश्न 2.8:
ऐसा प्रकाश जिसकी तरंग-दैर्ध्य 4000 pm है, फोटॉन की ऊर्जा ज्ञात कीजिए।
🟢 उत्तर:
λ = 4000 pm = 4 × 10⁻⁹ m
E = hc/λ = (6.626 × 10⁻³⁴ × 3 × 10⁸) / 4 × 10⁻⁹
= 4.97 × 10⁻¹⁷ J ✔
🔵 प्रश्न 2.9:
4 × 10⁷ m⁻¹ तरंग-संख्या वाले फोटॉन की ऊर्जा ज्ञात कीजिए।
🟢 उत्तर:
E = hcν̅
= 6.626 × 10⁻³⁴ × 3 × 10⁸ × 4 × 10⁷
= 7.95 × 10⁻¹⁸ J ✔
🔵 प्रश्न 2.10:
सोडियम परमाणु के आयनीकरण के लिए 242 nm तरंग-दैर्ध्य की आवश्यकता होती है।
सोडियम की आयनीकरण ऊर्जा (kJ mol⁻¹) में ज्ञात कीजिए।
🟢 उत्तर:
E = hc/λ = 6.626 × 10⁻³⁴ × 3 × 10⁸ / 2.42 × 10⁻⁷
= 8.21 × 10⁻¹⁹ J प्रति फोटॉन
E प्रति मोल = 8.21 × 10⁻¹⁹ × 6.022 × 10²³ = 494 kJ mol⁻¹ ✔
🔵 प्रश्न 2.11:
25°C पर एक विकिरण जिसकी तरंग-दैर्ध्य 0.57 μm है, उसकी ऊर्जा ज्ञात कीजिए।
🟢 उत्तर:
λ = 0.57 μm = 5.7 × 10⁻⁷ m
E = hc/λ = 6.626 × 10⁻³⁴ × 3 × 10⁸ / 5.7 × 10⁻⁷ = 3.49 × 10⁻¹⁹ J ✔
🔵 प्रश्न 2.12:
6800 Å तरंगदैर्ध्य पर विकिरण से एक धातु पर इलेक्ट्रॉन उत्सर्जित होते हैं।
इस विकिरण की सीमा आवृत्ति (ν₀) और कार्य फल (W₀) ज्ञात कीजिए।
🟢 उत्तर:
λ = 6800 Å = 6.8 × 10⁻⁷ m
ν₀ = c / λ = 3 × 10⁸ / 6.8 × 10⁻⁷ = 4.41 × 10¹⁴ Hz
E = hν₀ = 6.626 × 10⁻³⁴ × 4.41 × 10¹⁴ = 2.92 × 10⁻¹⁹ J
✔ कार्यफल (W₀) = 2.92 × 10⁻¹⁹ J, सीमा आवृत्ति (ν₀) = 4.41 × 10¹⁴ Hz
🔵 प्रश्न 2.13:
जब हाइड्रोजन परमाणु के n = 4 ऊर्जा स्तर से n = 2 ऊर्जा स्तर में इलेक्ट्रॉन जाता है, तो किस तरंग-दैर्ध्य का प्रकाश उत्सर्जित होगा?
🟢 उत्तर:
✴ सूत्र:
1/λ = R (1/n₁² – 1/n₂²)
जहाँ R = 1.097 × 10⁷ m⁻¹, n₁ = 2, n₂ = 4
➡ 1/λ = 1.097 × 10⁷ (1/2² – 1/4²)
➡ 1/λ = 1.097 × 10⁷ (1/4 – 1/16) = 1.097 × 10⁷ × (3/16)
➡ λ = 4.87 × 10⁻⁷ m = 487 nm
✔ यह दृश्य प्रकाश क्षेत्र में आता है (Balmer series)।
🔵 प्रश्न 2.14:
यदि इलेक्ट्रॉन n = 5 स्तर से उत्सर्जित हो, तो हाइड्रोजन परमाणु के आयनीकरण के लिए कितनी ऊर्जा की आवश्यकता होगी?
🟢 उत्तर:
✴ ऊर्जा स्तर: Eₙ = –2.18 × 10⁻¹⁸ × (1/n²) J
E₅ = –2.18 × 10⁻¹⁸ × (1/25) = –8.72 × 10⁻²⁰ J
आयनीकरण ऊर्जा = 0 – (–8.72 × 10⁻²⁰) = 8.72 × 10⁻²⁰ J
✔ अतः 8.72 × 10⁻²⁰ J/atom ऊर्जा की आवश्यकता होगी।
🔵 प्रश्न 2.15:
n = 6 से n = 2 पर जाने पर किस श्रृंखला का प्रकाश उत्सर्जन होगा?
🟢 उत्तर:
✴ जब इलेक्ट्रॉन n = 2 पर आता है → Balmer श्रृंखला
अतः यह Balmer श्रृंखला का विकिरण है जो दृश्य क्षेत्र में आता है।
🔵 प्रश्न 2.16:
हाइड्रोजन परमाणु के प्रथम कक्षीय स्तर की ऊर्जा –2.18 × 10⁻¹⁸ J atom⁻¹ है, पाँचवें कक्षीय स्तर की ऊर्जा ज्ञात कीजिए।
🟢 उत्तर:
Eₙ = –2.18 × 10⁻¹⁸ × (1/n²)
E₅ = –2.18 × 10⁻¹⁸ × (1/25)
E₅ = –8.72 × 10⁻²⁰ J/atom
✔ पाँचवें स्तर की ऊर्जा –8.72 × 10⁻²⁰ J होगी।
🔵 प्रश्न 2.17:
हाइड्रोजन परमाणु के पाँचवें कक्षीय स्तर की त्रिज्या ज्ञात कीजिए।
🟢 उत्तर:
✴ rₙ = n² × a₀, जहाँ a₀ = 0.529 Å
r₅ = 5² × 0.529 = 25 × 0.529 = 13.23 Å
✔ त्रिज्या = 13.23 Å
🔵 प्रश्न 2.18:
हाइड्रोजन परमाणु में इलेक्ट्रॉन का प्रथम कक्षीय स्तर से दूसरे कक्षीय स्तर तक जाने से होने वाले ऊर्जा परिवर्तन का मान ज्ञात करें।
🟢 उत्तर:
ΔE = E₂ – E₁
E₁ = –2.18 × 10⁻¹⁸, E₂ = –2.18 × 10⁻¹⁸ × 1/4 = –5.45 × 10⁻¹⁹
ΔE = –5.45 × 10⁻¹⁹ – (–2.18 × 10⁻¹⁸) = 1.635 × 10⁻¹⁸ J
✔ ऊर्जा अवशोषित होती है।
🔵 प्रश्न 2.19:
हाइड्रोजन परमाणु के इलेक्ट्रॉन का ऊर्जा स्तर Eₙ = –2.18 × 10⁻¹⁸ × (1/n²) दिया है।
n = 2 से n = ∞ पर जाने में आवश्यक ऊर्जा ज्ञात कीजिए।
🟢 उत्तर:
E₂ = –5.45 × 10⁻¹⁹ J
E∞ = 0
ΔE = 0 – (–5.45 × 10⁻¹⁹) = 5.45 × 10⁻¹⁹ J/atom
✔ यह आयनीकरण ऊर्जा है।
🔵 प्रश्न 2.20:
2.05 × 10⁷ m/s वेग वाले इलेक्ट्रॉन की तरंग दैर्ध्य ज्ञात कीजिए।
🟢 उत्तर:
✴ de Broglie सूत्र: λ = h / mv
h = 6.626 × 10⁻³⁴, m = 9.11 × 10⁻³¹, v = 2.05 × 10⁷
λ = 6.626 × 10⁻³⁴ / (9.11 × 10⁻³¹ × 2.05 × 10⁷)
λ = 3.54 × 10⁻¹¹ m
✔ तरंग दैर्ध्य = 3.54 × 10⁻¹¹ m
🔵 प्रश्न 2.21:
किसी कण का द्रव्यमान 9.1 × 10⁻³¹ kg है तथा वेग 3.0 × 10⁵ m/s है, इसकी तरंग दैर्ध्य ज्ञात कीजिए।
🟢 उत्तर:
λ = h / mv
λ = 6.626 × 10⁻³⁴ / (9.1 × 10⁻³¹ × 3.0 × 10⁵)
λ = 2.43 × 10⁻⁹ m
🔵 प्रश्न 2.22:
निम्न में से किस सम-आवेशीय श्रेणी में इलेक्ट्रॉनों की समान संख्या है:
Na⁺, K⁺, Mg²⁺, Ca²⁺, S²⁻, Ar
🟢 उत्तर:
Na⁺ = 10 e⁻
Mg²⁺ = 10 e⁻
Al³⁺ = 10 e⁻
O²⁻ = 10 e⁻
F⁻ = 10 e⁻
✔ Na⁺, Mg²⁺, O²⁻, F⁻ → समआवेशीय
🔵 प्रश्न 2.23:
निम्न आयनों की इलेक्ट्रॉनिक विन्यास लिखिए:
(i) H⁻, (ii) Na⁺, (iii) O²⁻, (iv) F⁻
🟢 उत्तर:
(i) H⁻ → 1s²
(ii) Na⁺ → 1s² 2s² 2p⁶
(iii) O²⁻ → 1s² 2s² 2p⁶
(iv) F⁻ → 1s² 2s² 2p⁶
🔵 प्रश्न 2.24:
किस तत्व का परमाणु त्रिज्या सबसे अधिक होगा?
H, He, Li, Be, B
🟢 उत्तर:
परमाणु त्रिज्या बाएँ से दाएँ घटती है।
अतः H < Li > Be
✔ सबसे अधिक त्रिज्या Li की होगी।
🔵 प्रश्न 2.25:
किसी तत्व का द्रव्यमान संख्या 31 तथा उसमें 15 इलेक्ट्रॉन हैं।
इस तत्व का परमाणु प्रतीक लिखिए।
🟢 उत्तर:
➡ इलेक्ट्रॉनों की संख्या = प्रोटॉनों की संख्या = परमाणु संख्या (Z) = 15
➡ द्रव्यमान संख्या (A) = 31
✔ प्रतीक = ³¹₁₅P (फॉस्फोरस)
🔵 प्रश्न 2.26:
निम्न में से किस युग्म में समआवेशीय प्रजातियाँ (isoelectronic species) हैं —
(i) Na⁺, Mg²⁺, Al³⁺
(ii) O²⁻, F⁻, Ne
(iii) N³⁻, O²⁻, F⁻
🟢 उत्तर:
✴ प्रत्येक का इलेक्ट्रॉन संख्या निकालें —
(i) Na⁺ → 10 e⁻, Mg²⁺ → 10 e⁻, Al³⁺ → 10 e⁻ → ✔ समआवेशीय
(ii) O²⁻ → 10 e⁻, F⁻ → 10 e⁻, Ne → 10 e⁻ → ✔ समआवेशीय
(iii) N³⁻ → 10 e⁻, O²⁻ → 10 e⁻, F⁻ → 10 e⁻ → ✔ समआवेशीय
💡 निष्कर्ष: तीनों युग्म समआवेशीय हैं।
🔵 प्रश्न 2.27:
निम्न में से किसका परमाणु त्रिज्या सबसे अधिक होगी —
N³⁻, O²⁻, F⁻, Na⁺, Mg²⁺
🟢 उत्तर:
✔ सभी समआवेशीय (10 e⁻), परंतु Z बढ़ने पर आकर्षण बढ़ता है → त्रिज्या घटती है।
➡ क्रम: N³⁻ > O²⁻ > F⁻ > Na⁺ > Mg²⁺
✔ अतः सबसे बड़ी त्रिज्या N³⁻ की है।
🔵 प्रश्न 2.28:
एक इलेक्ट्रॉन की अधिकतम चार क्वांटम संख्याओं का समूह क्या हो सकता है?
🟢 उत्तर:
✔ चार क्वांटम संख्याएँ:
n = प्रमुख क्वांटम संख्या
l = आज़ीमुथल
m = चुंबकीय
s = स्पिन
💡 उदाहरण: 2s इलेक्ट्रॉन
n = 2, l = 0, m = 0, s = +½
📌 नियम:
n = 1, 2, 3, …
l = 0 से (n–1)
m = –l से +l
s = ±½
🔵 प्रश्न 2.29:
Pauli अपवर्जन सिद्धांत का कथन कीजिए।
🟢 उत्तर:
✔ Pauli अपवर्जन सिद्धांत:
“एक ही परमाणु में कोई दो इलेक्ट्रॉन चारों क्वांटम संख्याओं का समान समूह नहीं रख सकते।”
➡ एक कक्ष (orbital) में अधिकतम 2 इलेक्ट्रॉन हो सकते हैं, जिनके स्पिन विपरीत होंगे।
💡 उदाहरण: 1s² में दो इलेक्ट्रॉन — एक का s = +½, दूसरे का s = –½
🔵 प्रश्न 2.30:
Hund का अधिकतम गुणकता सिद्धांत लिखिए।
🟢 उत्तर:
✔ Hund’s Rule:
“किसी उपकक्ष (subshell) के समान ऊर्जा वाले कक्षों में इलेक्ट्रॉन यथासंभव एक-एक पहले प्रवेश करेंगे, फिर युग्मित होंगे।”
💡 उद्देश्य: प्रतिकर्षण न्यूनतम और स्थिरता अधिकतम।
उदाहरण: p³ = ↑ ↑ ↑
🔵 प्रश्न 2.31:
Aufbau सिद्धांत का कथन लिखिए।
🟢 उत्तर:
✔ Aufbau सिद्धांत:
“परमाणु में इलेक्ट्रॉन न्यूनतम ऊर्जा वाले कक्षों में पहले भरते हैं, फिर उच्च ऊर्जा वाले में।”
➡ क्रम: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s …
🔵 प्रश्न 2.32:
( n + l ) नियम की व्याख्या कीजिए।
🟢 उत्तर:
✔ (n + l) नियम:
कक्ष की ऊर्जा n + l के मान पर निर्भर करती है।
➡ यदि दो कक्षों के (n + l) मान समान हों, तो जिसका n कम, वह पहले भरेगा।
उदाहरण:
4s (n + l = 4 + 0 = 4)
3d (n + l = 3 + 2 = 5)
➡ 4s पहले भरेगा।
🔵 प्रश्न 2.33:
1 से 30 तक के परमाणुओं के लिए इलेक्ट्रॉनिक विन्यास लिखने के सामान्य नियम बताइए।
🟢 उत्तर:
✴ नियम:
1️⃣ Aufbau सिद्धांत
2️⃣ Pauli अपवर्जन सिद्धांत
3️⃣ Hund का नियम
4️⃣ क्रम: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹⁰ 4p⁶ …
💡 उदाहरण:
Z = 20 (Ca): 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² ✔
🔵 प्रश्न 2.34:
कौन-सा इलेक्ट्रॉनिक विन्यास संभव नहीं है?
(a) 1s² 2s² 2p⁶ 3s² 3p⁶ 3d² 4s²
(b) 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d²
🟢 उत्तर:
✔ नियम अनुसार 4s पहले भरता है, फिर 3d।
अतः (b) सही, (a) असंभव।
🔵 प्रश्न 2.35:
Cr (Z = 24) और Cu (Z = 29) का वास्तविक विन्यास क्या है?
🟢 उत्तर:
➡ अपेक्षित:
Cr: [Ar] 3d⁴ 4s²
Cu: [Ar] 3d⁹ 4s²
➡ वास्तविक:
Cr: [Ar] 3d⁵ 4s¹ (अर्ध-भरे उपकक्ष की स्थिरता)
Cu: [Ar] 3d¹⁰ 4s¹ (पूर्ण उपकक्ष स्थिरता) ✔
🔵 प्रश्न 2.36:
Ni²⁺ आयन का इलेक्ट्रॉनिक विन्यास लिखिए। (Z = 28)
🟢 उत्तर:
Ni: [Ar] 3d⁸ 4s²
Ni²⁺: 2 इलेक्ट्रॉन 4s से हटेंगे → [Ar] 3d⁸ ✔
🔵 प्रश्न 2.37:
निम्नलिखित इलेक्ट्रॉनिक विन्यासों में से कौन-सा संभव नहीं है और क्यों?
(a) 1s² 2s² 2p⁶ 3s² 3p⁶ 3d¹⁰ 4s² 4p¹
(b) 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁵ 4p¹
(c) 1s² 2s² 2p⁶ 3s² 3p⁶ 3d¹² 4s² 4p¹
🟢 उत्तर:
✔ (a) संभव है → तत्व Ga (Z = 31) का विन्यास
✔ (b) संभव है → तत्व Mn (Z = 25) में 3d⁵ भरा है
❌ (c) असंभव है क्योंकि 3d उपकक्ष में अधिकतम 10 इलेक्ट्रॉन ही आ सकते हैं।
अतः (c) Pauli अपवर्जन सिद्धांत का उल्लंघन करता है।
🔵 प्रश्न 2.38:
निम्नलिखित तत्वों के लिए क्वांटम संख्याओं का समूह लिखिए:
(i) 19वाँ इलेक्ट्रॉन (K)
(ii) 24वाँ इलेक्ट्रॉन (Cr)
(iii) 29वाँ इलेक्ट्रॉन (Cu)
🟢 उत्तर:
(i) K (Z = 19) → विन्यास: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹
19वाँ इलेक्ट्रॉन: 4s¹
➡ n = 4, l = 0, m = 0, s = +½
(ii) Cr (Z = 24) → [Ar] 3d⁵ 4s¹
24वाँ इलेक्ट्रॉन: 3d⁵
➡ n = 3, l = 2, m = +2, s = +½
(iii) Cu (Z = 29) → [Ar] 3d¹⁰ 4s¹
29वाँ इलेक्ट्रॉन: 3d¹⁰
➡ n = 3, l = 2, m = +2, s = –½
🔵 प्रश्न 2.39:
हाइड्रोजन परमाणु के किसी कक्षीय स्तर की ऊर्जा ज्ञात करने का सूत्र लिखिए और E₁, E₂ तथा E₃ की गणना कीजिए।
🟢 उत्तर:
✴ सूत्र: Eₙ = –2.18 × 10⁻¹⁸ × (1/n²) J
➡ E₁ = –2.18 × 10⁻¹⁸ × (1/1²) = –2.18 × 10⁻¹⁸ J
➡ E₂ = –2.18 × 10⁻¹⁸ × (1/4) = –5.45 × 10⁻¹⁹ J
➡ E₃ = –2.18 × 10⁻¹⁸ × (1/9) = –2.42 × 10⁻¹⁹ J
✔ E₁ < E₂ < E₃ (ऊर्जा घटती है, n बढ़ने पर)
🔵 प्रश्न 2.40:
किसी इलेक्ट्रॉन के लिए तरंग संख्या (wavenumber) और ऊर्जा के बीच सम्बन्ध लिखिए।
🟢 उत्तर:
✔ तरंग संख्या (ν̅) = 1/λ
✔ ऊर्जा (E) = hcν̅
जहाँ
h = प्लैंक स्थिरांक,
c = प्रकाश का वेग
💡 यह सम्बन्ध बताता है कि तरंग संख्या बढ़ने पर ऊर्जा भी बढ़ती है।
🔵 प्रश्न 2.41:
यदि किसी परमाणु में n = 3 हो, तो कितने कक्ष होंगे और कुल कितने इलेक्ट्रॉन समा सकते हैं?
🟢 उत्तर:
✴ n = 3
➡ उपकक्ष = l = 0, 1, 2 ⇒ 3s, 3p, 3d
➡ कक्षों की संख्या = s(1) + p(3) + d(5) = 9 कक्ष
➡ कुल इलेक्ट्रॉन = 2 × 9 = 18 इलेक्ट्रॉन ✔
🔵 प्रश्न 2.42:
यदि n = 4 हो, तो उपकक्षों के नाम लिखिए और प्रत्येक में अधिकतम इलेक्ट्रॉनों की संख्या बताइए।
🟢 उत्तर:
n = 4 ⇒ l = 0, 1, 2, 3
➡ उपकक्ष: 4s, 4p, 4d, 4f
➡ अधिकतम इलेक्ट्रॉन:
4s → 2
4p → 6
4d → 10
4f → 14
✔ कुल = 2 + 6 + 10 + 14 = 32 इलेक्ट्रॉन
🔵 प्रश्न 2.43:
l = 2 के लिए कितने कक्ष होंगे और उनका प्रकार क्या होगा?
🟢 उत्तर:
✔ l = 2 ⇒ d उपकक्ष
➡ m = –2, –1, 0, +1, +2
➡ कक्षों की संख्या = 5
➡ प्रकार: dxy, dyz, dzx, dx²–y², dz² ✔
🔵 प्रश्न 2.44:
यदि n = 4 और l = 2 हो, तो कितने इलेक्ट्रॉन रखे जा सकते हैं?
🟢 उत्तर:
n = 4, l = 2 ⇒ 4d उपकक्ष
➡ कक्ष = 5
➡ प्रत्येक में 2 इलेक्ट्रॉन ⇒ 5 × 2 = 10 इलेक्ट्रॉन ✔
🔵 प्रश्न 2.45:
किसी परमाणु में कुल कितने कक्ष होंगे यदि n = 4 है?
🟢 उत्तर:
n = 4
➡ उपकक्ष: 4s (1), 4p (3), 4d (5), 4f (7)
➡ कुल कक्ष = 1 + 3 + 5 + 7 = 16 कक्ष ✔
🔵 प्रश्न 2.46:
किसी कक्ष में n = 3, l = 1 हो, तो यह कौन-सा उपकक्ष है?
उसमें कितने कक्ष होंगे और अधिकतम कितने इलेक्ट्रॉन रखे जा सकते हैं?
🟢 उत्तर:
✔ n = 3, l = 1 ⇒ उपकक्ष = 3p
➡ l = 1 ⇒ m = –1, 0, +1 ⇒ 3 कक्ष
➡ प्रत्येक कक्ष में 2 इलेक्ट्रॉन ⇒ 3 × 2 = 6 इलेक्ट्रॉन
✔ अतः 3p उपकक्ष में 3 कक्ष और 6 इलेक्ट्रॉन समा सकते हैं।
🔵 प्रश्न 2.47:
किसी परमाणु में n = 3 के लिए कुल कितने इलेक्ट्रॉन रखे जा सकते हैं?
🟢 उत्तर:
✔ n = 3 ⇒ उपकक्ष: 3s, 3p, 3d
➡ इलेक्ट्रॉन: s(2) + p(6) + d(10) = 18 इलेक्ट्रॉन
✔ अतः n = 3 में अधिकतम 18 इलेक्ट्रॉन समा सकते हैं।
🔵 प्रश्न 2.48:
किसी परमाणु के लिए यदि n = 2, l = 1, तो यह कौन-सा उपकक्ष है और कितने कक्ष होंगे?
🟢 उत्तर:
✔ n = 2, l = 1 ⇒ 2p उपकक्ष
➡ m = –1, 0, +1 ⇒ 3 कक्ष
➡ प्रत्येक में 2 इलेक्ट्रॉन ⇒ 6 इलेक्ट्रॉन कुल
✔ अतः 2p में 3 कक्ष और 6 इलेक्ट्रॉन समा सकते हैं।
🔵 प्रश्न 2.49:
किसी कक्ष के लिए चार क्वांटम संख्याएँ (n, l, m, s) लिखिए।
🟢 उत्तर:
✴ उदाहरण: 3p कक्ष
➡ n = 3, l = 1, m = 0, s = +½
✔ यह एक विशिष्ट कक्ष का समूह है।
💡 याद रखें:
n = प्रमुख
l = आज़ीमुथल
m = चुंबकीय
s = स्पिन क्वांटम संख्या
🔵 प्रश्न 2.50:
Pauli अपवर्जन सिद्धांत का महत्व बताइए।
🟢 उत्तर:
✔ यह सिद्धांत बताता है कि किसी परमाणु में कोई दो इलेक्ट्रॉन चारों क्वांटम संख्याओं में समान नहीं हो सकते।
➡ प्रत्येक कक्ष में अधिकतम 2 इलेक्ट्रॉन और उनके स्पिन विपरीत होंगे।
💡 इससे इलेक्ट्रॉनिक विन्यास निर्धारित करना संभव होता है।
🔵 प्रश्न 2.51:
Hund का अधिकतम गुणकता सिद्धांत किसे प्रभावित करता है?
🟢 उत्तर:
✔ यह सिद्धांत उपकक्ष में इलेक्ट्रॉनों की व्यवस्था को प्रभावित करता है।
➡ समान ऊर्जा वाले कक्ष पहले एक-एक इलेक्ट्रॉन से भरते हैं, फिर युग्मित होते हैं।
💡 उदाहरण: p³ → ↑ ↑ ↑ (प्रत्येक कक्ष में एक इलेक्ट्रॉन)
🔵 प्रश्न 2.52:
Aufbau सिद्धांत के अनुसार 21वें इलेक्ट्रॉन का स्थान बताइए।
🟢 उत्तर:
✔ इलेक्ट्रॉन भरने का क्रम: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹
➡ 21वाँ इलेक्ट्रॉन 3d उपकक्ष में जाएगा।
✔ अतः 21वाँ इलेक्ट्रॉन = 3d¹ (Sc – स्कैन्डियम)
🔵 प्रश्न 2.53:
( n + l ) नियम के अनुसार किस कक्ष की ऊर्जा कम होगी — 4p या 5s?
🟢 उत्तर:
✔ 4p: n + l = 4 + 1 = 5
✔ 5s: n + l = 5 + 0 = 5
➡ दोनों के (n + l) समान, पर 4p का n कम ⇒ ऊर्जा कम
✔ अतः 4p पहले भरेगा।
🔵 प्रश्न 2.54:
किसी परमाणु में कुल 16 इलेक्ट्रॉन हैं।
उसका इलेक्ट्रॉनिक विन्यास लिखिए।
🟢 उत्तर:
✔ Z = 16 (S – सल्फर)
➡ विन्यास: 1s² 2s² 2p⁶ 3s² 3p⁴ ✔
🔵 प्रश्न 2.55:
यदि किसी परमाणु का विन्यास [Ne] 3s² 3p⁵ है, तो यह कौन-सा तत्व है?
🟢 उत्तर:
✔ [Ne] = 10 इलेक्ट्रॉन + 3s² (2) + 3p⁵ (5) = 17
➡ Z = 17 → Cl (क्लोरीन)
✔ तत्व: क्लोरीन
🔵 प्रश्न 2.56:
किसी परमाणु में n = 4 और l = 3 है।
कुल कितने कक्ष होंगे और अधिकतम कितने इलेक्ट्रॉन रखे जा सकते हैं?
🟢 उत्तर:
✔ n = 4, l = 3 ⇒ उपकक्ष = 4f
➡ f उपकक्ष में m = –3, –2, –1, 0, +1, +2, +3 ⇒ 7 कक्ष
➡ प्रत्येक कक्ष में 2 इलेक्ट्रॉन ⇒ 7 × 2 = 14 इलेक्ट्रॉन
✔ अतः 4f उपकक्ष में 7 कक्ष और 14 इलेक्ट्रॉन समा सकते हैं।
🔵 प्रश्न 2.57:
किसी परमाणु का इलेक्ट्रॉनिक विन्यास 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁵ है।
इस परमाणु का नाम बताइए।
🟢 उत्तर:
✔ कुल इलेक्ट्रॉन = 2 + 2 + 6 + 2 + 6 + 2 + 5 = 25
➡ परमाणु संख्या Z = 25 → Mn (मैंगनीज़)
✔ तत्व: मैंगनीज़
🔵 प्रश्न 2.58:
किसी परमाणु के लिए n = 3 और l = 2 हो, तो
(i) उपकक्ष का नाम बताइए
(ii) कितने कक्ष होंगे
(iii) अधिकतम कितने इलेक्ट्रॉन रखे जा सकते हैं
🟢 उत्तर:
✔ n = 3, l = 2 ⇒ उपकक्ष = 3d
➡ (i) नाम = 3d
➡ (ii) कक्ष = 5
➡ (iii) इलेक्ट्रॉन = 5 × 2 = 10 इलेक्ट्रॉन ✔
🔵 प्रश्न 2.59:
हाइड्रोजन परमाणु के किसी कक्षीय स्तर में ऊर्जा का सूत्र लिखिए।
🟢 उत्तर:
✔ सूत्र:
Eₙ = –2.18 × 10⁻¹⁸ × (1/n²) J
जहाँ n = मुख्य क्वांटम संख्या
💡 ऊर्जा ऋणात्मक होती है, जो बंधन की स्थिरता दर्शाती है।
🔵 प्रश्न 2.60:
n = 3 के लिए ऊर्जा का मान ज्ञात कीजिए।
🟢 उत्तर:
✔ सूत्र: Eₙ = –2.18 × 10⁻¹⁸ × (1/n²)
➡ E₃ = –2.18 × 10⁻¹⁸ × (1/9)
➡ E₃ = –2.42 × 10⁻¹⁹ J ✔
🔵 प्रश्न 2.61:
n = 2 से n = 1 पर संक्रमण के लिए ऊर्जा परिवर्तन ज्ञात कीजिए।
🟢 उत्तर:
✔ ΔE = E₂ – E₁
E₁ = –2.18 × 10⁻¹⁸, E₂ = –5.45 × 10⁻¹⁹
➡ ΔE = (–5.45 × 10⁻¹⁹) – (–2.18 × 10⁻¹⁸)
➡ ΔE = 1.63 × 10⁻¹⁸ J
✔ यह ऊर्जा उत्सर्जित होगी।
🔵 प्रश्न 2.62:
n = 3 से n = 2 पर संक्रमण की ऊर्जा ज्ञात कीजिए।
🟢 उत्तर:
E₃ = –2.42 × 10⁻¹⁹ J
E₂ = –5.45 × 10⁻¹⁹ J
ΔE = E₂ – E₃ = (–5.45) – (–2.42) × 10⁻¹⁹
➡ ΔE = 3.03 × 10⁻¹⁹ J ✔
🔵 प्रश्न 2.63:
यदि ΔE = 3.03 × 10⁻¹⁹ J हो, तो उत्सर्जित प्रकाश की तरंगदैर्ध्य ज्ञात कीजिए।
🟢 उत्तर:
✔ सूत्र: E = hc/λ
➡ λ = hc/E
h = 6.626 × 10⁻³⁴ J·s, c = 3 × 10⁸ m/s
λ = (6.626 × 10⁻³⁴ × 3 × 10⁸) / 3.03 × 10⁻¹⁹
➡ λ = 6.56 × 10⁻⁷ m = 656 nm
✔ यह Balmer श्रृंखला की रेखा है।
🔵 प्रश्न 2.64:
Balmer श्रृंखला में कौन-कौन से संक्रमण आते हैं?
🟢 उत्तर:
✔ Balmer श्रृंखला: n₂ = 2 पर अंत होने वाले संक्रमण
➡ n₁ = 3, 4, 5, … से n₂ = 2
✔ ये संक्रमण दृश्य क्षेत्र (Visible region) में आते हैं।
🔵 प्रश्न 2.65:
Lyman श्रृंखला के संक्रमण बताइए।
🟢 उत्तर:
✔ Lyman श्रृंखला: n₂ = 1 पर अंत होने वाले संक्रमण
➡ n₁ = 2, 3, 4, … से n₂ = 1
✔ ये संक्रमण पराबैंगनी (Ultraviolet) क्षेत्र में होते हैं।
🔵 प्रश्न 2.66:
Paschen श्रृंखला किस क्षेत्र में आती है?
🟢 उत्तर:
✔ Paschen श्रृंखला: n₂ = 3 पर अंत
➡ संक्रमण: n₁ = 4, 5, 6… से n₂ = 3
✔ यह अवरक्त (Infrared) क्षेत्र में आती है।
🔵 प्रश्न 2.67:
Bohr मॉडल की दो सीमाएँ बताइए।
🟢 उत्तर:
1️⃣ यह केवल हाइड्रोजन जैसे एक इलेक्ट्रॉन वाले परमाणुओं के लिए उपयुक्त है।
2️⃣ यह Zeeman प्रभाव और Fine structure को नहीं समझा पाता।
💡 इसके स्थान पर क्वांटम यांत्रिक मॉडल विकसित किया गया।
————————————————————————————————————————————————————————————————————————————
अन्य महत्वपूर्ण प्रश्न
(CBSE MODEL प्रश्न पत्र)
सिर्फ इसी पाठ से निर्मित CBSE MODEL प्रश्न पत्र।
खंड A — बहुविकल्पीय प्रश्न (Q1–Q16, प्रत्येक 1 अंक)
प्रश्न 1. इलेक्ट्रॉन की खोज किसने की थी?
गोल्डस्टीन
मिलिकन
जे. जे. थॉमसन
रदरफोर्ड
Answer: 3
प्रश्न 2. प्रोटॉन की खोज किसने की थी?
गोल्डस्टीन
चैडविक
रदरफोर्ड
डाल्टन
Answer: 1
प्रश्न 3. न्यूट्रॉन की खोज किसने की थी?
बोहर
चैडविक
डाल्टन
जे. जे. थॉमसन
Answer: 2
प्रश्न 4. रदरफोर्ड के स्वर्ण पर्ण प्रयोग से क्या निष्कर्ष निकला?
परमाणु अविभाज्य है
परमाणु में केन्द्रक होता है
इलेक्ट्रॉन वृत्ताकार पथ पर घूमते हैं
इलेक्ट्रॉन व तरंग एकसमान हैं
Answer: 2
प्रश्न 5. परमाणु संख्या Z = 17 वाले तत्व में प्रोटॉनों की संख्या कितनी होगी?
35
17
18
16
Answer: 2
प्रश्न 6. द्रव्यमान संख्या A = 40 तथा Z = 20 वाले परमाणु में न्यूट्रॉनों की संख्या कितनी होगी?
20
40
60
10
Answer: 1
कथन–कारण हेतु विकल्प-कुंजी
कथन (A) एवं कारण (R) दोनों सत्य हैं तथा R, A का सही कारण है
कथन (A) एवं कारण (R) दोनों सत्य हैं परन्तु R, A का सही कारण नहीं
कथन (A) सत्य है परन्तु R असत्य
कथन (A) असत्य है परन्तु R सत्य
प्रश्न 7 (A/R).
कथन (A): रदरफोर्ड मॉडल में इलेक्ट्रॉन केन्द्रक के चारों ओर परिक्रमा करते हैं।
कारण (R): इलेक्ट्रॉनों पर विद्युत आकर्षण बल केन्द्राभिमुख बल का कार्य करता है।
Answer: 1
प्रश्न 8. हाइड्रोजन परमाणु के लिए बोहर कक्ष का त्रिज्या n पर किसके अनुपाती है?
n²
n
1/n
1/n²
Answer: 1
प्रश्न 9. हाइड्रोजन परमाणु में इलेक्ट्रॉन की ऊर्जा किसके अनुपाती होती है?
n²
1/n²
1/n
n
Answer: 2
प्रश्न 10 (A/R).
कथन (A): किसी इलेक्ट्रॉन का क्वांटम संख्याओं का सेट अद्वितीय होता है।
कारण (R): पॉली का अपवर्जन सिद्धान्त लागू होता है।
Answer: 1
प्रश्न 11. इलेक्ट्रॉन के लिए “चुंबकीय क्वांटम संख्या” (m) बताती है:
ऊर्जा
कक्षा का आकार
कक्षा का स्थानाभिन्यास
इलेक्ट्रॉन का स्पिन
Answer: 3
प्रश्न 12. d-कक्षा की अधिकतम इलेक्ट्रॉनों की संख्या कितनी हो सकती है?
14
2
6
10
Answer: 4
प्रश्न 13. s-कक्षा की आकृति क्या होती है?
गोलाकार
डम्बल
डबल डम्बल
गोल + डम्बल
Answer: 1
प्रश्न 14. प = 3 (मुख्य क्वांटम संख्या) के लिए अधिकतम इलेक्ट्रॉनों की संख्या कितनी होगी?
2
8
18
32
Answer: 3
प्रश्न 15 (A/R).
कथन (A): इलेक्ट्रॉनों का युग्मन पहले अकेली कक्षाओं को भरने के बाद होता है।
कारण (R): हुंड का अधिकतम गुणकता नियम लागू होता है।
Answer: 1
प्रश्न 16. ऑर्बिटल आरेख में 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹ की संरचना किस तत्व की है?
पोटैशियम
कैल्शियम
स्कैन्डियम
टाइटेनियम
Answer: 3
खंड B — अति लघु उत्तरीय प्रश्न (Q17–Q21, प्रत्येक 2 अंक)
प्रश्न 17. पॉली अपवर्जन सिद्धान्त का कथन लिखिए।
उत्तर:
🟦 किसी परमाणु में दो इलेक्ट्रॉनों के चारों क्वांटम संख्याओं का समूह समान नहीं हो सकता।
🟩 परिणामतः प्रत्येक कक्षा में अधिकतम 2 इलेक्ट्रॉन विपरीत स्पिन सहित ही रह सकते हैं।
प्रश्न 18. बोहर मॉडल की एक सीमा बताइए।
उत्तर:
🟦 यह केवल एक इलेक्ट्रॉन वाले परमाणु या आयन (H, He⁺, Li²⁺) के लिए ही सही है।
🟩 बहु-इलेक्ट्रॉनी परमाणुओं की रेखा स्पेक्ट्रा की व्याख्या करने में असफल।
प्रश्न 19. हाइजेनबर्ग के अनिश्चितता सिद्धान्त का गणितीय रूप लिखिए।
उत्तर:
➤ सूत्र: Δx·Δp ≥ h/(4π)
🟩 इसका अर्थ है — किसी कण की स्थिति (Δx) और संवेग (Δp) को एक साथ असीम शुद्धता से ज्ञात नहीं किया जा सकता।
प्रश्न 20. p-कक्षा का अधिकतम क्वांटम अवस्थाओं की संख्या बताइए।
उत्तर:
🟦 l = 1 ⇒ m = −1, 0, +1 (तीन अवस्थाएँ)।
🟩 प्रत्येक में 2 इलेक्ट्रॉन ⇒ कुल 6 इलेक्ट्रॉन।
प्रश्न 21. इलेक्ट्रॉन स्पिन क्वांटम संख्या (s) के सम्भव मान लिखिए।
उत्तर:
🟦 s = +1/2 (घड़ी की दिशा)।
🟩 s = −1/2 (विपरीत दिशा)।
खंड C — लघु उत्तरीय प्रश्न (Q22–Q28, प्रत्येक 3 अंक)
प्रश्न 22. रदरफोर्ड के स्वर्ण पर्ण प्रयोग से प्राप्त मुख्य निष्कर्ष लिखिए।
उत्तर:
🟦 अधिकांश कण सीधे निकल गए ⇒ परमाणु में रिक्त स्थान अधिक।
🟦 कुछ कण मुड़े ⇒ धन आवेश केन्द्र में सघन।
🟦 बहुत कम कण परावर्तित ⇒ केन्द्रक का आकार बहुत छोटा है।
प्रश्न 23. किसी परमाणु में 19 प्रोटॉन, 20 न्यूट्रॉन, 19 इलेक्ट्रॉन हों तो परमाणु संख्या व द्रव्यमान संख्या लिखिए।
उत्तर:
🟦 परमाणु संख्या Z = प्रोटॉन संख्या = 19।
🟩 द्रव्यमान संख्या A = प्रोटॉन + न्यूट्रॉन = 19+20 = 39।
प्रश्न 24. n = 2 के लिए सम्भावित कक्षाओं का नाम लिखिए और उनकी अधिकतम इलेक्ट्रॉनों की संख्या बताइए।
उत्तर:
🟦 n = 2 ⇒ l = 0,1 ⇒ 2s, 2p कक्षाएँ।
🟦 2s में 2 इलेक्ट्रॉन, 2p में 6 इलेक्ट्रॉन।
🟩 कुल = 8 इलेक्ट्रॉन।
प्रश्न 25. 2p⁴ की इलेक्ट्रॉन संरचना के लिए ऑर्बिटल आरेख बनाइए (पाठ्य-रूप में)।
उत्तर:
🟦 2p कक्षाएँ: तीन बॉक्स (m = −1, 0, +1)।
🟦 इलेक्ट्रॉन भरना: ↑↓ , ↑ , ↑
🟩 निष्कर्ष: दो कक्षाएँ आधी भरी, एक पूरी भरी।
प्रश्न 26. हाइड्रोजन परमाणु में पहले कक्ष (n=1) की ऊर्जा (J में) ज्ञात करें। (h = 6.626×10⁻³⁴ J·s, R_H = 2.18×10⁻¹⁸ J)
उत्तर:
🧮 E₁ = −R_H (1/n²) = −2.18×10⁻¹⁸ × 1/1²
✅ E₁ = −2.18×10⁻¹⁸ J
प्रश्न 27. क्वांटम संख्याओं के चार प्रकार और उनका महत्व लिखिए।
उत्तर:
🟦 n (मुख्य): ऊर्जा स्तर और आकार बताता है।
🟪 l (कोणीय): कक्षा का आकार।
🟩 m (चुंबकीय): कक्षा का स्थानाभिन्यास।
🟦 s (स्पिन): इलेक्ट्रॉन का घूर्णन गुण।
प्रश्न 28. डी-ब्रॉग्ली तरंगदैर्घ्य का सूत्र लिखिए और 1 mg द्रव्यमान वाले कण (वेग = 1 m s⁻¹) हेतु λ ज्ञात करें। (h = 6.626×10⁻³⁴ J·s)
उत्तर:
➤ सूत्र: λ = h/(mv)
➤ प्रतिस्थापन: h = 6.626×10⁻³⁴, m = 1×10⁻⁶ kg, v = 1 m s⁻¹
λ = 6.626×10⁻³⁴ / 1×10⁻⁶ = 6.626×10⁻²⁸ m
✅ इतना छोटा कि अवलोकनीय नहीं।
खंड D — प्रकरण आधारित प्रश्न (Q29–Q30, प्रत्येक 4 अंक)
प्रश्न 29.
एक विद्यार्थी ने हाइड्रोजन परमाणु का स्पेक्ट्रम देखा। उसे लाइमन, बाल्मर तथा पास्चेन श्रेणियाँ मिलीं।
(i) लाइमन श्रेणी का संक्रमण किस ऊर्जा स्तर पर समाप्त होता है? (1)
(ii) बाल्मर श्रेणी दृश्य क्षेत्र में क्यों आती है? (1)
(iii) n=3 से n=2 संक्रमण की ऊर्जा (J) ज्ञात करें यदि R_H = 2.18 × 10⁻¹⁸ J हो। (2)
उत्तर:
🟦 (i) लाइमन श्रेणी सभी संक्रमण n=1 पर समाप्त होते हैं।
🟩 (ii) बाल्मर संक्रमण n=2 पर समाप्त होते हैं; इनका ΔE दृश्य प्रकाश के फोटॉनों के तुल्य होता है।
🧮 (iii) ΔE = R_H (1/n₁² − 1/n₂²) = 2.18×10⁻¹⁸ (1/2² − 1/3²)
= 2.18×10⁻¹⁸ (1/4 − 1/9) = 2.18×10⁻¹⁸ × (5/36)
= 3.03×10⁻¹⁹ J
✅ उत्तर: 3.03×10⁻¹⁹ J
प्रश्न 30.
किसी तत्व X की इलेक्ट्रॉन संरचना [Ne] 3s² 3p⁵ है।
(i) X की परमाणु संख्या लिखिए। (1)
(ii) इसका समूह और आवर्त कौन-सा है? (1)
(iii) इसका एक स्थिर ऋणायन बनने पर संरचना लिखिए और स्थायित्व का कारण बताइए। (2)
उत्तर:
🟦 (i) Ne + 2 + 5 = 17 ⇒ Z = 17।
🟩 (ii) समूह 17 (हैलोजन), आवर्त 3।
🟪 (iii) X⁻ : [Ne] 3s² 3p⁶ = आर्गन जैसी संरचना।
✅ कारण: पूर्ण अष्टक संरचना ⇒ अधिक स्थिर।
खंड E — दीर्घ उत्तरीय प्रश्न (Q31–Q33, प्रत्येक 5 अंक)
प्रश्न 31.
हाइजेनबर्ग के अनिश्चितता सिद्धान्त का विवरण दीजिए। इसके गणितीय रूप और महत्व समझाइए।
उत्तर:
🟦 कथन: किसी सूक्ष्म कण की स्थिति और संवेग को एक साथ असीम शुद्धता से नहीं जाना जा सकता।
🧮 गणितीय रूप: Δx·Δp ≥ h/(4π)
🟩 महत्व:
इलेक्ट्रॉन की सटीक कक्षा (orbit) नहीं बताई जा सकती।
इसके कारण “संभाव्यता बादल” या ऑर्बिटल की संकल्पना आई।
✅ निष्कर्ष: आधुनिक परमाणु मॉडल, तरंग यांत्रिकी पर आधारित है।
या
“डी-ब्रॉग्ली तरंग सिद्धान्त” की व्याख्या कीजिए तथा यह बोहर मॉडल से कैसे संगत बैठता है, लिखिए।
प्रश्न 32.
हाइड्रोजन परमाणु में पहले कक्ष (n=1) से दूसरे कक्ष (n=2) में इलेक्ट्रॉन जाने हेतु आवश्यक ऊर्जा (eV में) ज्ञात कीजिए। (R_H = 2.18×10⁻¹⁸ J, 1 eV = 1.602×10⁻¹⁹ J)
उत्तर:
🧮 ΔE = R_H (1/1² − 1/2²) = 2.18×10⁻¹⁸ (1 − 1/4) = 2.18×10⁻¹⁸ × 3/4
= 1.635×10⁻¹⁸ J
➡ eV में: 1.635×10⁻¹⁸ / 1.602×10⁻¹⁹ ≈ 10.2 eV
✅ उत्तर: 10.2 eV
या
बाल्मर श्रेणी की व्याख्या कीजिए तथा इसका दृश्य प्रकाश क्षेत्र से सम्बन्ध स्पष्ट कीजिए।
प्रश्न 33.
क्वांटम संख्याओं के चार प्रकार समझाइए। प्रत्येक का महत्व लिखिए और उदाहरण दीजिए।
उत्तर:
🟦 n (मुख्य): कक्ष की ऊर्जा और आकार बताता है। उदाहरण: n=2 ⇒ दूसरा ऊर्जा स्तर।
🟪 l (कोणीय): कक्षा का आकार बताता है। l=0 ⇒ s (गोलाकार), l=1 ⇒ p (डम्बल)।
🟩 m (चुंबकीय): कक्षा का स्थानाभिन्यास। उदाहरण: p के लिए −1,0,+1।
🟦 s (स्पिन): इलेक्ट्रॉन का आन्तरिक घूर्णन गुण (±1/2)।
✅ महत्व: इन्हीं चार संख्याओं से किसी भी इलेक्ट्रॉन की अवस्था पूर्णतः निर्दिष्ट होती है।
या
हुंड के अधिकतम गुणकता नियम तथा पॉली अपवर्जन सिद्धान्त का कथन करिए और परमाणु की इलेक्ट्रॉन संरचना में उनका प्रयोग बताइए।
————————————————————————————————————————————————————————————————————————————
Neet पिछले सालों के प्रश्न
🔵 प्रश्न 1:
हाइड्रोजन परमाणु के बोहर मॉडल में इलेक्ट्रॉन किस ऊर्जा स्तर से किस स्तर पर जाने पर लाइमन श्रेणी की रेखाएँ उत्पन्न होती हैं?
🔴 ① n = 2 → n = 1
🟢 ② n = 3 → n = 1
🟡 ③ n = ∞ → n = 1
🔵 ④ सभी सही हैं
🟢 उत्तर: ④ सभी सही हैं
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: M
🔵 प्रश्न 2:
इलेक्ट्रॉन की तरंगदैर्घ्य (λ) डी-ब्रॉग्ली समीकरण द्वारा दी जाती है:
🔴 ① λ = h/mv
🟢 ② λ = mv/h
🟡 ③ λ = h²/mv
🔵 ④ λ = hv/m
🟢 उत्तर: ① λ = h/mv
📘 परीक्षा: AIPMT
📅 वर्ष: 2015 | सेट: X
🔵 प्रश्न 3:
इलेक्ट्रॉन का क्वाण्टम संख्या n = 3, l = 2, m = 0 किस कक्ष को निरूपित करता है?
🔴 ① 3s
🟢 ② 3p
🟡 ③ 3d
🔵 ④ 4d
🟢 उत्तर: ③ 3d
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: Q
🔵 प्रश्न 4:
अफबाउ सिद्धांत के अनुसार कौन-सा कक्ष सबसे पहले भरेगा?
🔴 ① 4s
🟢 ② 3d
🟡 ③ 4p
🔵 ④ 5s
🟢 उत्तर: ① 4s
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: L
🔵 प्रश्न 5:
हाइड्रोजन परमाणु में इलेक्ट्रॉन का कोणीय संवेग क्वांटाइज़्ड होता है और दिया जाता है:
🔴 ① nh/π
🟢 ② nh/2π
🟡 ③ h/2π
🔵 ④ mv²r
🟢 उत्तर: ② nh/2π
📘 परीक्षा: PMT
📅 वर्ष: 2010 | सेट: C
🔵 प्रश्न 6:
किसी भी कक्ष में इलेक्ट्रॉनों की अधिकतम संख्या क्या होती है?
🔴 ① 2n²
🟢 ② n²
🟡 ③ 4n²
🔵 ④ 2n
🟢 उत्तर: ① 2n²
📘 परीक्षा: NEET
📅 वर्ष: 2020 | सेट: P
🔵 प्रश्न 7:
पॉली अपवर्जन नियम क्या बताता है?
🔴 ① किसी कक्ष में अधिकतम 4 इलेक्ट्रॉन हो सकते हैं
🟢 ② किसी भी दो इलेक्ट्रॉन के सभी 4 क्वांटम संख्याएँ समान नहीं हो सकतीं
🟡 ③ इलेक्ट्रॉन का संवेग स्थिर है
🔵 ④ इलेक्ट्रॉनों का आवेश धनात्मक है
🟢 उत्तर: ② किसी भी दो इलेक्ट्रॉन के सभी 4 क्वांटम संख्याएँ समान नहीं हो सकतीं
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: K
🔵 प्रश्न 8:
हाइड्रोजन परमाणु में n = 2 स्तर की ऊर्जा कितनी होती है?
🔴 ① -13.6 eV
🟢 ② -3.4 eV
🟡 ③ -1.51 eV
🔵 ④ -0.85 eV
🟢 उत्तर: ② -3.4 eV
📘 परीक्षा: AIPMT
📅 वर्ष: 2012 | सेट: B
🔵 प्रश्न 9:
ऑफबाउ सिद्धांत का क्रम कौन-सा है?
🔴 ① 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p
🟢 ② 1s → 2p → 2s → 3s → 3p
🟡 ③ 1s → 2s → 3p → 2p
🔵 ④ 1s → 3s → 2p
🟢 उत्तर: ① 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p
📘 परीक्षा: NEET
📅 वर्ष: 2021 | सेट: N
🔵 प्रश्न 10:
हाइजेनबर्ग का अनिश्चितता सिद्धांत कहता है:
🔴 ① Δx · Δp ≥ h
🟢 ② Δx · Δp ≥ h/4π
🟡 ③ Δx · Δp ≤ h/2π
🔵 ④ Δx = Δp
🟢 उत्तर: ② Δx · Δp ≥ h/4π
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: S
🔵 प्रश्न 11:
प्रोटॉन का द्रव्यमान लगभग कितना होता है?
🔴 ① 1.66 × 10⁻²⁴ g
🟢 ② 9.11 × 10⁻²⁸ g
🟡 ③ 1.67 × 10⁻²⁷ kg
🔵 ④ दोनों ① और ③
🟢 उत्तर: ④ दोनों ① और ③
📘 परीक्षा: PMT
📅 वर्ष: 2008 | सेट: A
🔵 प्रश्न 12:
किसी तत्व की परमाणु संख्या किसके बराबर होती है?
🔴 ① इलेक्ट्रॉनों की संख्या
🟢 ② प्रोटॉनों की संख्या
🟡 ③ न्यूट्रॉनों की संख्या
🔵 ④ प्रोटॉनों + न्यूट्रॉनों की संख्या
🟢 उत्तर: ② प्रोटॉनों की संख्या
📘 परीक्षा: NEET
📅 वर्ष: 2020 | सेट: L
🔵 प्रश्न 13:
प्रथम आयनीकरण ऊर्जा सर्वाधिक किसकी होती है?
🔴 ① Na
🟢 ② He
🟡 ③ F
🔵 ④ Ne
🟢 उत्तर: ② He
📘 परीक्षा: AIPMT
📅 वर्ष: 2011 | सेट: Z
🔵 प्रश्न 14:
किसी भी कक्ष में चुंबकीय क्वांटम संख्या (m) के संभावित मान कितने होते हैं?
🔴 ① 2l + 1
🟢 ② l + 1
🟡 ③ 2n + 1
🔵 ④ n²
🟢 उत्तर: ① 2l + 1
📘 परीक्षा: NEET
📅 वर्ष: 2015 | सेट: Q
🔵 प्रश्न 15:
n = 3 स्तर में कितने कक्ष उपस्थित होते हैं?
🔴 ① 9
🟢 ② 3
🟡 ③ 18
🔵 ④ 5
🟢 उत्तर: ① 9
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: P
🔵 प्रश्न 16:
जब इलेक्ट्रॉन n = 3 से n = 2 पर जाता है तो कौन-सी श्रेणी की रेखा प्राप्त होती है?
🔴 ① लाइमन
🟢 ② बाल्मर
🟡 ③ पास्चेन
🔵 ④ ब्रैकेट
🟢 उत्तर: ② बाल्मर
📘 परीक्षा: AIPMT
📅 वर्ष: 2010 | सेट: B
🔵 प्रश्न 17:
2p कक्ष की आकृति कैसी होती है?
🔴 ① गोलाकार
🟢 ② डम्बल आकार
🟡 ③ द्विगुणित
🔵 ④ अनियमित
🟢 उत्तर: ② डम्बल आकार
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: J
🔵 प्रश्न 18:
आइसोटोप किसे कहते हैं?
🔴 ① समान प्रोटॉन संख्या और अलग न्यूट्रॉन संख्या वाले परमाणु
🟢 ② समान न्यूट्रॉन और अलग प्रोटॉन वाले परमाणु
🟡 ③ समान द्रव्यमान संख्या वाले परमाणु
🔵 ④ समान इलेक्ट्रॉनिक विन्यास वाले
🟢 उत्तर: ① समान प्रोटॉन संख्या और अलग न्यूट्रॉन संख्या वाले परमाणु
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: R
🔵 प्रश्न 19:
लैटस समीकरण में कोणीय क्वांटम संख्या l का मान s कक्ष के लिए क्या होता है?
🔴 ① 1
🟢 ② 0
🟡 ③ 2
🔵 ④ 3
🟢 उत्तर: ② 0
📘 परीक्षा: NEET
📅 वर्ष: 2021 | सेट: N
🔵 प्रश्न 20:
हाइड्रोजन परमाणु के बोहर मॉडल के अनुसार इलेक्ट्रॉन किस पथ में घूमता है?
🔴 ① दीर्घवृत्ताकार
🟢 ② वृत्ताकार
🟡 ③ परवलयाकार
🔵 ④ सीधी रेखा
🟢 उत्तर: ② वृत्ताकार
📘 परीक्षा: AIPMT
📅 वर्ष: 2012 | सेट: D
🔵 प्रश्न 21:
Z = 17 (Cl) परमाणु का बाह्यतम इलेक्ट्रॉन किस कक्ष में होगा?
🔴 ① 3p⁵
🟢 ② 3s²
🟡 ③ 2p⁶
🔵 ④ 4s²
🟢 उत्तर: ① 3p⁵
📘 परीक्षा: NEET
📅 वर्ष: 2015 | सेट: M
🔵 प्रश्न 22:
प्लैंक का समीकरण है:
🔴 ① E = mc²
🟢 ② E = hν
🟡 ③ E = h/λ
🔵 ④ E = nh/2π
🟢 उत्तर: ② E = hν
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: T
🔵 प्रश्न 23:
इलेक्ट्रॉन की खोज किसने की थी?
🔴 ① गोल्डस्टीन
🟢 ② जे. जे. थॉमसन
🟡 ③ चैडविक
🔵 ④ रदरफोर्ड
🟢 उत्तर: ② जे. जे. थॉमसन
📘 परीक्षा: PMT
📅 वर्ष: 2009 | सेट: B
🔵 प्रश्न 24:
न्यूट्रॉन की खोज किसने की थी?
🔴 ① रदरफोर्ड
🟢 ② चैडविक
🟡 ③ गोल्डस्टीन
🔵 ④ बोहर
🟢 उत्तर: ② चैडविक
📘 परीक्षा: AIPMT
📅 वर्ष: 2011 | सेट: Y
🔵 प्रश्न 25:
रदरफोर्ड के प्रकीर्णन प्रयोग से क्या पता चला?
🔴 ① इलेक्ट्रॉनों का द्रव्यमान
🟢 ② परमाणु का नाभिक केंद्र में स्थित है
🟡 ③ प्रोटॉनों की खोज हुई
🔵 ④ इलेक्ट्रॉन तरंग है
🟢 उत्तर: ② परमाणु का नाभिक केंद्र में स्थित है
📘 परीक्षा: NEET
📅 वर्ष: 2020 | सेट: K
🔵 प्रश्न 26:
नाभिकीय आवेश (Z) का मान किसके बराबर होता है?
🔴 ① न्यूट्रॉनों की संख्या
🟢 ② प्रोटॉनों की संख्या
🟡 ③ इलेक्ट्रॉनों की संख्या
🔵 ④ A – Z
🟢 उत्तर: ② प्रोटॉनों की संख्या
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: M
🔵 प्रश्न 27:
किसी कक्ष में इलेक्ट्रॉनों की अधिकतम संख्या क्या होती है?
🔴 ① 4l + 2
🟢 ② 2l + 1
🟡 ③ 2n²
🔵 ④ 2n + 1
🟢 उत्तर: ① 4l + 2
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: Q
🔵 प्रश्न 28:
आइसोबार किसे कहते हैं?
🔴 ① समान A, भिन्न Z वाले परमाणु
🟢 ② समान Z, भिन्न N वाले परमाणु
🟡 ③ समान इलेक्ट्रॉनिक विन्यास वाले
🔵 ④ समान द्रव्यमान वाले तत्व
🟢 उत्तर: ① समान A, भिन्न Z वाले परमाणु
📘 परीक्षा: AIPMT
📅 वर्ष: 2014 | सेट: B
🔵 प्रश्न 29:
n = 4 शेल में कितने इलेक्ट्रॉन समा सकते हैं?
🔴 ① 8
🟢 ② 18
🟡 ③ 32
🔵 ④ 16
🟢 उत्तर: ③ 32
📘 परीक्षा: NEET
📅 वर्ष: 2020 | सेट: P
🔵 प्रश्न 30:
आइंस्टीन का फोटो-विद्युत समीकरण है:
🔴 ① E = mc²
🟢 ② hν = W + ½mv²
🟡 ③ λ = h/mv
🔵 ④ Δx · Δp ≥ h/4π
🟢 उत्तर: ② hν = W + ½mv²
📘 परीक्षा: AIPMT
📅 वर्ष: 2010 | सेट: A
🔵 प्रश्न 31:
कौन-सा नियम इलेक्ट्रॉनों के कक्षीय वितरण को न्यूनतम ऊर्जा सिद्धांत पर बताता है?
🔴 ① पाउली नियम
🟢 ② हंड नियम
🟡 ③ ऑफबाउ सिद्धांत
🔵 ④ प्लैंक सिद्धांत
🟢 उत्तर: ③ ऑफबाउ सिद्धांत
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: N
🔵 प्रश्न 32:
हंड का अधिकतम गुणनफल सिद्धांत क्या बताता है?
🔴 ① उपकक्षों का क्रम
🟢 ② इलेक्ट्रॉनों का एकल रूप में भरना
🟡 ③ इलेक्ट्रॉनों का युग्मन
🔵 ④ न्यूट्रॉनों की स्थिरता
🟢 उत्तर: ② इलेक्ट्रॉनों का एकल रूप में भरना
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: K
🔵 प्रश्न 33:
हाइड्रोजन परमाणु का ग्राउंड स्टेट ऊर्जा स्तर कितना होता है?
🔴 ① -13.6 eV
🟢 ② -3.4 eV
🟡 ③ -1.51 eV
🔵 ④ -0.85 eV
🟢 उत्तर: ① -13.6 eV
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: S
🔵 प्रश्न 34:
स्पेक्ट्रल रेखाएँ किसके कारण बनती हैं?
🔴 ① इलेक्ट्रॉनों का नाभिक में गिरना
🟢 ② इलेक्ट्रॉनों का ऊर्जा स्तर बदलना
🟡 ③ प्रोटॉनों का स्थानांतरण
🔵 ④ न्यूट्रॉनों का उत्सर्जन
🟢 उत्तर: ② इलेक्ट्रॉनों का ऊर्जा स्तर बदलना
📘 परीक्षा: PMT
📅 वर्ष: 2009 | सेट: C
🔵 प्रश्न 35:
n = 3, l = 1 उपकक्ष में कितने इलेक्ट्रॉन आ सकते हैं?
🔴 ① 6
🟢 ② 3
🟡 ③ 2
🔵 ④ 10
🟢 उत्तर: ① 6
📘 परीक्षा: NEET
📅 वर्ष: 2020 | सेट: O
🔵 प्रश्न 36:
बोहर मॉडल किस परमाणु के लिए पूरी तरह सफल है?
🔴 ① हाइड्रोजन और हाइड्रोजन जैसे आयन
🟢 ② सभी बहु-इलेक्ट्रॉन परमाणु
🟡 ③ निष्क्रिय गैसें
🔵 ④ क्षारीय धातुएँ
🟢 उत्तर: ① हाइड्रोजन और हाइड्रोजन जैसे आयन
📘 परीक्षा: AIPMT
📅 वर्ष: 2012 | सेट: Y
🔵 प्रश्न 37:
रदरफोर्ड मॉडल में इलेक्ट्रॉन नाभिक की परिक्रमा क्यों नहीं कर पाते?
🔴 ① ऊर्जा उत्सर्जित नहीं करते
🟢 ② ऊर्जा निरंतर उत्सर्जित करते और गिर जाते
🟡 ③ प्रोटॉनों से प्रतिकर्षित होते
🔵 ④ न्यूट्रॉनों से टकराते
🟢 उत्तर: ② ऊर्जा निरंतर उत्सर्जित करते और गिर जाते
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: J
🔵 प्रश्न 38:
2s कक्ष और 2p कक्ष में क्या अंतर है?
🔴 ① ऊर्जा समान है
🟢 ② आकार व आकृति अलग है
🟡 ③ दोनों गोलाकार हैं
🔵 ④ कोई अंतर नहीं
🟢 उत्तर: ② आकार व आकृति अलग है
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: R
🔵 प्रश्न 39:
आइसोटोन किसे कहते हैं?
🔴 ① समान प्रोटॉन संख्या
🟢 ② समान न्यूट्रॉन संख्या
🟡 ③ समान द्रव्यमान संख्या
🔵 ④ समान इलेक्ट्रॉन संख्या
🟢 उत्तर: ② समान न्यूट्रॉन संख्या
📘 परीक्षा: AIPMT
📅 वर्ष: 2011 | सेट: B
🔵 प्रश्न 40:
किसी कक्ष के लिए कक्षा-आकार क्वांटम संख्या l = 2 किस कक्ष को निरूपित करता है?
🔴 ① s
🟢 ② p
🟡 ③ d
🔵 ④ f
🟢 उत्तर: ③ d
📘 परीक्षा: NEET
📅 वर्ष: 2015 | सेट: M
🔵 प्रश्न 41:
मैक्स प्लैंक ने किस घटना को समझाने के लिए क्वांटम सिद्धांत दिया?
🔴 ① फोटोविद्युत प्रभाव
🟢 ② कृष्णिका विकिरण
🟡 ③ परमाणु स्पेक्ट्रा
🔵 ④ अनिश्चितता सिद्धांत
🟢 उत्तर: ② कृष्णिका विकिरण
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: N
🔵 प्रश्न 42:
यदि किसी इलेक्ट्रॉन के क्वांटम संख्याएँ n = 2, l = 0 हों, तो वह किस कक्ष में होगा?
🔴 ① 2p
🟢 ② 2s
🟡 ③ 1s
🔵 ④ 3s
🟢 उत्तर: ② 2s
📘 परीक्षा: AIPMT
📅 वर्ष: 2010 | सेट: C
🔵 प्रश्न 43:
इलेक्ट्रॉन का द्रव्यमान लगभग कितना होता है?
🔴 ① 9.11 × 10⁻²⁸ g
🟢 ② 1.67 × 10⁻²⁷ g
🟡 ③ 1.66 × 10⁻²⁴ g
🔵 ④ 1 amu
🟢 उत्तर: ① 9.11 × 10⁻²⁸ g
📘 परीक्षा: NEET
📅 वर्ष: 2017 | सेट: O
🔵 प्रश्न 44:
बोहर मॉडल का मुख्य दोष क्या था?
🔴 ① बहु-इलेक्ट्रॉन परमाणुओं को समझा नहीं सका
🟢 ② हाइड्रोजन स्पेक्ट्रा गलत बताया
🟡 ③ क्वांटम संख्याओं की व्याख्या नहीं की
🔵 ④ इलेक्ट्रॉन का आवेश नहीं बताया
🟢 उत्तर: ① बहु-इलेक्ट्रॉन परमाणुओं को समझा नहीं सका
📘 परीक्षा: NEET
📅 वर्ष: 2021 | सेट: J
🔵 प्रश्न 45:
2p कक्ष के लिए चुंबकीय क्वांटम संख्या (m) के कितने मान संभव हैं?
🔴 ① 1
🟢 ② 2
🟡 ③ 3
🔵 ④ 4
🟢 उत्तर: ③ 3
📘 परीक्षा: NEET
📅 वर्ष: 2020 | सेट: L
🔵 प्रश्न 46:
स्पिन क्वांटम संख्या (s) के कितने मान संभव हैं?
🔴 ① 1
🟢 ② 2 (+½, –½)
🟡 ③ 3
🔵 ④ 4
🟢 उत्तर: ② 2 (+½, –½)
📘 परीक्षा: AIPMT
📅 वर्ष: 2013 | सेट: D
🔵 प्रश्न 47:
कौन-सा परमाणु कक्ष गोलाकार होता है?
🔴 ① s
🟢 ② p
🟡 ③ d
🔵 ④ f
🟢 उत्तर: ① s
📘 परीक्षा: NEET
📅 वर्ष: 2016 | सेट: S
🔵 प्रश्न 48:
बोहर मॉडल के अनुसार किसी इलेक्ट्रॉन का ऊर्जा स्तर किस पर निर्भर करता है?
🔴 ① n
🟢 ② l
🟡 ③ m
🔵 ④ s
🟢 उत्तर: ① n
📘 परीक्षा: NEET
📅 वर्ष: 2018 | सेट: R
🔵 प्रश्न 49:
इलेक्ट्रॉन की स्थिर तरंग प्रकृति किसने प्रस्तावित की थी?
🔴 ① डी-ब्रॉग्ली
🟢 ② हाइजेनबर्ग
🟡 ③ श्रोडिंगर
🔵 ④ रदरफोर्ड
🟢 उत्तर: ① डी-ब्रॉग्ली
📘 परीक्षा: NEET
📅 वर्ष: 2015 | सेट: K
🔵 प्रश्न 50:
श्रोडिंगर समीकरण से क्या प्राप्त होता है?
🔴 ① इलेक्ट्रॉन का द्रव्यमान
🟢 ② इलेक्ट्रॉन के कक्ष की तरंग फलन
🟡 ③ नाभिक का आवेश
🔵 ④ प्रोटॉन का आकार
🟢 उत्तर: ② इलेक्ट्रॉन के कक्ष की तरंग फलन
📘 परीक्षा: NEET
📅 वर्ष: 2019 | सेट: P
————————————————————————————————————————————————————————————————————————————
JEE MAINS पिछले सालों के प्रश्न
🔵 प्रश्न 1:
हाइड्रोजन परमाणु के लिए इलेक्ट्रॉन की ऊर्जा किस पर निर्भर करती है?
🔴 ① कक्षीय त्रिज्या
🟢 ② प्रधान क्वांटम संख्या (n)
🟡 ③ चुम्बकीय क्वांटम संख्या (m)
🔵 ④ स्पिन क्वांटम संख्या
🟢 उत्तर: ② प्रधान क्वांटम संख्या (n)
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Morning
🔵 प्रश्न 2:
प्लैंक ने विकिरण के उत्सर्जन को समझाने के लिए कौन-सा सिद्धांत दिया?
🔴 ① ऊर्जा का निरंतर उत्सर्जन
🟢 ② ऊर्जा का असतत उत्सर्जन
🟡 ③ तरंग-कण द्वैतता
🔵 ④ अनिश्चितता सिद्धांत
🟢 उत्तर: ② ऊर्जा का असतत उत्सर्जन
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: Evening
🔵 प्रश्न 3:
डी ब्रॉगली समीकरण λ = h/mv में ‘λ’ का अर्थ है —
🔴 ① ऊर्जा
🟢 ② तरंगदैर्घ्य
🟡 ③ संवेग
🔵 ④ आवृत्ति
🟢 उत्तर: ② तरंगदैर्घ्य
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: Morning
🔵 प्रश्न 4:
इलेक्ट्रॉन के स्पिन क्वांटम संख्या के सम्भव मान हैं —
🔴 ① +1, –1
🟢 ② +1/2, –1/2
🟡 ③ +2, –2
🔵 ④ 0, +1
🟢 उत्तर: ② +1/2, –1/2
📘 परीक्षा: JEE Main
📅 वर्ष: 2015 | शिफ़्ट: Evening
🔵 प्रश्न 5:
हाइड्रोजन परमाणु में इलेक्ट्रॉन की ऊर्जा (E) और n के बीच सम्बन्ध है —
🔴 ① E ∝ n²
🟢 ② E ∝ 1/n²
🟡 ③ E ∝ n
🔵 ④ E ∝ 1/n
🟢 उत्तर: ② E ∝ 1/n²
📘 परीक्षा: JEE Main
📅 वर्ष: 2021 | शिफ़्ट: Morning
🔵 प्रश्न 6:
बोर मॉडल में, इलेक्ट्रॉन का कोणीय संवेग (mvr) = ?
🔴 ① nh/π
🟢 ② nh/2π
🟡 ③ 2π/nh
🔵 ④ h/n
🟢 उत्तर: ② nh/2π
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | शिफ़्ट: Morning
🔵 प्रश्न 7:
n = 3 स्तर में इलेक्ट्रॉन की अधिकतम सम्भावित संख्या है —
🔴 ① 18
🟢 ② 8
🟡 ③ 32
🔵 ④ 2
🟢 उत्तर: ① 18
📘 परीक्षा: JEE Main
📅 वर्ष: 2023 | शिफ़्ट: Evening
🔵 प्रश्न 8:
अज़ीमुथल क्वांटम संख्या (l) का मान n = 4 के लिए क्या हो सकता है?
🔴 ① केवल 3
🟢 ② 0, 1, 2, 3
🟡 ③ 1, 2, 3, 4
🔵 ④ केवल 0
🟢 उत्तर: ② 0, 1, 2, 3
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Evening
🔵 प्रश्न 9:
n = 3 और l = 2 के लिए कक्षिकाओं की संख्या क्या होगी?
🔴 ① 3
🟢 ② 5
🟡 ③ 7
🔵 ④ 9
🟢 उत्तर: ② 5
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Morning
🔵 प्रश्न 10:
यदि किसी इलेक्ट्रॉन के लिए n = 2 और l = 1 है, तो वह किस उपकक्षा में होगा?
🔴 ① 2s
🟢 ② 2p
🟡 ③ 2d
🔵 ④ 3p
🟢 उत्तर: ② 2p
📘 परीक्षा: JEE Main
📅 वर्ष: 2015 | शिफ़्ट: Morning
🔵 प्रश्न 11:
n = 4 स्तर में कुल कक्षिकाओं की संख्या होगी —
🔴 ① 8
🟢 ② 16
🟡 ③ 32
🔵 ④ 64
🟢 उत्तर: ② 16
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: Evening
🔵 प्रश्न 12:
हाइजेनबर्ग अनिश्चितता सिद्धांत के अनुसार यदि Δx घटता है, तो —
🔴 ① Δp घटेगा
🟢 ② Δp बढ़ेगा
🟡 ③ Δp अपरिवर्तित रहेगा
🔵 ④ ΔxΔp = 0
🟢 उत्तर: ② Δp बढ़ेगा
📘 परीक्षा: JEE Main
📅 वर्ष: 2022 | शिफ़्ट: Morning
🔵 प्रश्न 13:
1 mol फोटॉन की ऊर्जा (E) = ?
🔴 ① hc/λ
🟢 ② Nhc/λ
🟡 ③ hcλ
🔵 ④ hλ/N
🟢 उत्तर: ② Nhc/λ
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | शिफ़्ट: Evening
🔵 प्रश्न 14:
हाइड्रोजन स्पेक्ट्रम में बाल्मर श्रेणी किस क्षेत्र में आती है?
🔴 ① पराबैंगनी
🟢 ② दृश्य
🟡 ③ अवरक्त
🔵 ④ माइक्रोवेव
🟢 उत्तर: ② दृश्य
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Morning
🔵 प्रश्न 15:
पैशेन श्रेणी का न्यूनतम n मान क्या है?
🔴 ① 2
🟢 ② 3
🟡 ③ 4
🔵 ④ 5
🟢 उत्तर: ② 3
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Evening
🔵 प्रश्न 16:
यदि λ = 400 nm है, तो प्रति फोटॉन ऊर्जा E = ?
(E = hc/λ, h = 6.626×10⁻³⁴ J·s, c = 3×10⁸ m/s)
🔴 ① 3.1×10⁻¹⁹ J
🟢 ② 4.97×10⁻¹⁹ J
🟡 ③ 2.0×10⁻²⁰ J
🔵 ④ 1.5×10⁻¹⁸ J
🟢 उत्तर: ② 4.97×10⁻¹⁹ J
📘 परीक्षा: JEE Main
📅 वर्ष: 2021 | शिफ़्ट: Evening
🔵 प्रश्न 17:
यदि इलेक्ट्रॉन को n = 3 से n = 1 पर लाया जाए, तो कौन-सी श्रेणी बनती है?
🔴 ① लाइमन
🟢 ② बाल्मर
🟡 ③ पैशेन
🔵 ④ ब्रैकेट
🟢 उत्तर: ① लाइमन
📘 परीक्षा: JEE Main
📅 वर्ष: 2015 | शिफ़्ट: Morning
🔵 प्रश्न 18:
हाइड्रोजन परमाणु में ΔE = 0 का अर्थ है —
🔴 ① उत्सर्जन
🟢 ② कोई संक्रमण नहीं
🟡 ③ अवशोषण
🔵 ④ आयनीकरण
🟢 उत्तर: ② कोई संक्रमण नहीं
📘 परीक्षा: JEE Main
📅 वर्ष: 2023 | शिफ़्ट: Morning
🔵 प्रश्न 19:
हाइड्रोजन परमाणु में एक इलेक्ट्रॉन का अधिकतम क्वांटम संख्या संयोजन क्या हो सकता है?
🔴 ① n=1, l=1, m=0
🟢 ② n=2, l=1, m=+1
🟡 ③ n=3, l=2, m=+2
🔵 ④ n=2, l=0, m=1
🟢 उत्तर: ③ n=3, l=2, m=+2
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: Evening
🔵 प्रश्न 20:
ΔE = hv का सम्बन्ध किसने दिया?
🔴 ① रदरफोर्ड
🟢 ② प्लैंक
🟡 ③ डी ब्रॉगली
🔵 ④ बोर
🟢 उत्तर: ② प्लैंक
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | शिफ़्ट: Morning
🔵 प्रश्न 21:
यदि किसी कण की गति आधी कर दी जाए, तो उसकी डी ब्रॉगली तरंगदैर्घ्य —
🔴 ① आधी
🟢 ② दोगुनी
🟡 ③ समान
🔵 ④ चार गुना
🟢 उत्तर: ② दोगुनी
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Morning
🔵 प्रश्न 22:
rₙ ∝ n² संबंध किस मॉडल का है?
🔴 ① प्लैंक
🟢 ② बोर
🟡 ③ रदरफोर्ड
🔵 ④ श्रॉडिंगर
🟢 उत्तर: ② बोर
📘 परीक्षा: JEE Main
📅 वर्ष: 2015 | शिफ़्ट: Evening
🔵 प्रश्न 23:
ΔE = 13.6(1/n₁² – 1/n₂²) eV सूत्र किसने दिया?
🔴 ① रदरफोर्ड
🟢 ② बोर
🟡 ③ डी ब्रॉगली
🔵 ④ श्रॉडिंगर
🟢 उत्तर: ② बोर
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: Morning
🔵 प्रश्न 24:
इलेक्ट्रॉन की उपस्थिति की सम्भावना किस सिद्धांत से सम्बद्ध है?
🔴 ① तरंग-कण द्वैतता
🟢 ② श्रॉडिंगर तरंग समीकरण
🟡 ③ अनिश्चितता सिद्धांत
🔵 ④ क्वांटम संख्या
🟢 उत्तर: ② श्रॉडिंगर तरंग समीकरण
📘 परीक्षा: JEE Main
📅 वर्ष: 2021 | शिफ़्ट: Morning
🔵 प्रश्न 25:
हाइड्रोजन स्पेक्ट्रम में लाइमन श्रेणी किस क्षेत्र में आती है?
🔴 ① अवरक्त
🟢 ② पराबैंगनी
🟡 ③ दृश्य
🔵 ④ माइक्रोवेव
🟢 उत्तर: ② पराबैंगनी
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Evening
🔵 प्रश्न 26:
हाइड्रोजन परमाणु की किसी कक्षा में इलेक्ट्रॉन की त्रिज्या किसके समानुपाती होती है?
🔴 ① n
🟢 ② n²
🟡 ③ 1/n
🔵 ④ 1/n²
🟢 उत्तर: ② n²
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: Morning
🔵 प्रश्न 27:
इलेक्ट्रॉनिक विन्यास 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹ वाले परमाणु का अंतिम इलेक्ट्रॉन किस कक्षा में है?
🔴 ① 3d
🟢 ② 4s
🟡 ③ 3p
🔵 ④ 4p
🟢 उत्तर: ② 4s
📘 परीक्षा: JEE Main
📅 वर्ष: 2021 | शिफ़्ट: Evening
🔵 प्रश्न 28:
कौन-सा क्वांटम संख्या संयोजन असम्भव है?
🔴 ① n=2, l=1, m=0
🟢 ② n=3, l=2, m=+3
🟡 ③ n=1, l=0, m=0
🔵 ④ n=4, l=3, m=–2
🟢 उत्तर: ② n=3, l=2, m=+3
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: Morning
🔵 प्रश्न 29:
हाइड्रोजन परमाणु की आयनीकरण ऊर्जा है —
🔴 ① –13.6 eV
🟢 ② +13.6 eV
🟡 ③ –27.2 eV
🔵 ④ +27.2 eV
🟢 उत्तर: ② +13.6 eV
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | शिफ़्ट: Evening
🔵 प्रश्न 30:
यदि किसी इलेक्ट्रॉन का n = 3 से n = 2 में संक्रमण होता है, तो किस श्रेणी का विकिरण उत्सर्जित होगा?
🔴 ① लाइमन
🟢 ② बाल्मर
🟡 ③ पैशेन
🔵 ④ ब्रैकेट
🟢 उत्तर: ② बाल्मर
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Morning
🔵 प्रश्न 31:
इलेक्ट्रॉन का संवेग p = mv है। डी ब्रॉगली समीकरण से λ = ?
🔴 ① h/p
🟢 ② p/h
🟡 ③ hp
🔵 ④ h²/p
🟢 उत्तर: ① h/p
📘 परीक्षा: JEE Main
📅 वर्ष: 2022 | शिफ़्ट: Morning
🔵 प्रश्न 32:
हाइड्रोजन परमाणु के लिए Eₙ = –13.6/n² eV समीकरण में E₃ का मान क्या होगा?
🔴 ① –4.53 eV
🟢 ② –1.51 eV
🟡 ③ –0.85 eV
🔵 ④ –13.6 eV
🟢 उत्तर: ② –1.51 eV
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Morning
🔵 प्रश्न 33:
यदि किसी कक्षा में l = 2 है, तो उसका नाम क्या होगा?
🔴 ① s
🟢 ② p
🟡 ③ d
🔵 ④ f
🟢 उत्तर: ③ d
📘 परीक्षा: JEE Main
📅 वर्ष: 2015 | शिफ़्ट: Evening
🔵 प्रश्न 34:
कक्षिका में अधिकतम इलेक्ट्रॉनों की संख्या = ?
🔴 ① 2l
🟢 ② 2l + 1
🟡 ③ 4l + 2
🔵 ④ 2n²
🟢 उत्तर: ③ 4l + 2
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | शिफ़्ट: Morning
🔵 प्रश्न 35:
1s² 2s² 2p⁶ 3s² 3p¹ का तत्व कौन-सा है?
🔴 ① सिलिकॉन
🟢 ② एलुमिनियम
🟡 ③ सोडियम
🔵 ④ मैग्नीशियम
🟢 उत्तर: ② एलुमिनियम
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Evening
🔵 प्रश्न 36:
श्रॉडिंगर समीकरण ψ² किसका प्रतिनिधित्व करता है?
🔴 ① इलेक्ट्रॉन की ऊर्जा
🟢 ② इलेक्ट्रॉन की सम्भावना घनत्व
🟡 ③ इलेक्ट्रॉन का द्रव्यमान
🔵 ④ इलेक्ट्रॉन का वेग
🟢 उत्तर: ② इलेक्ट्रॉन की सम्भावना घनत्व
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: Morning
🔵 प्रश्न 37:
बोर के अनुसार, कक्षा में इलेक्ट्रॉन के लिए केन्द्राभिक बल किसके बराबर होता है?
🔴 ① स्थिर बल
🟢 ② विद्युतस्थैतिक बल
🟡 ③ गुरुत्वीय बल
🔵 ④ चुम्बकीय बल
🟢 उत्तर: ② विद्युतस्थैतिक बल
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: Evening
🔵 प्रश्न 38:
n = 2 और l = 1 के लिए सम्भव m मानों की संख्या है —
🔴 ① 2
🟢 ② 3
🟡 ③ 5
🔵 ④ 1
🟢 उत्तर: ② 3
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | शिफ़्ट: Evening
🔵 प्रश्न 39:
इलेक्ट्रॉन की उपस्थिति का क्षेत्र कहलाता है —
🔴 ① पथ
🟢 ② कक्षिका
🟡 ③ स्तर
🔵 ④ नाभिक
🟢 उत्तर: ② कक्षिका
📘 परीक्षा: JEE Main
📅 वर्ष: 2023 | शिफ़्ट: Morning
🔵 प्रश्न 40:
यदि किसी तत्व का इलेक्ट्रॉनिक विन्यास 1s² 2s² 2p⁶ 3s² 3p⁵ है, तो वह कौन-सा तत्व है?
🔴 ① क्लोरीन
🟢 ② सल्फर
🟡 ③ सोडियम
🔵 ④ आर्गन
🟢 उत्तर: ① क्लोरीन
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Evening
🔵 प्रश्न 41:
रदरफोर्ड मॉडल असफल रहा क्योंकि —
🔴 ① यह इलेक्ट्रॉन के ऊर्जा स्तर नहीं समझा सका
🟢 ② यह नाभिक का आकार नहीं बताता
🟡 ③ यह स्थिरता नहीं समझाता
🔵 ④ यह इलेक्ट्रॉन की गति नहीं बताता
🟢 उत्तर: ③ यह स्थिरता नहीं समझाता
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: Morning
🔵 प्रश्न 42:
यदि n = 4, l = 3 है, तो इस उपकक्षा का नाम है —
🔴 ① 4p
🟢 ② 4f
🟡 ③ 4d
🔵 ④ 3f
🟢 उत्तर: ② 4f
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Morning
🔵 प्रश्न 43:
2p कक्षा में नोड्स की संख्या कितनी होती है?
🔴 ① 0
🟢 ② 1
🟡 ③ 2
🔵 ④ 3
🟢 उत्तर: ② 1
📘 परीक्षा: JEE Main
📅 वर्ष: 2021 | शिफ़्ट: Evening
🔵 प्रश्न 44:
यदि किसी इलेक्ट्रॉन के लिए n = 2 और m = 0 है, तो l का मान क्या होगा?
🔴 ① 1
🟢 ② 0 या 1
🟡 ③ केवल 0
🔵 ④ 2
🟢 उत्तर: ② 0 या 1
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: Evening
🔵 प्रश्न 45:
डी ब्रॉगली तरंगदैर्घ्य λ ∝ 1/√V किसके लिए सही है?
🔴 ① इलेक्ट्रॉन
🟢 ② प्रोटॉन
🟡 ③ सामान्य कण
🔵 ④ सभी गतिमान कण
🟢 उत्तर: ④ सभी गतिमान कण
📘 परीक्षा: JEE Main
📅 वर्ष: 2016 | शिफ़्ट: Morning
🔵 प्रश्न 46:
हाइड्रोजन स्पेक्ट्रम में किस श्रेणी की तरंगदैर्घ्य सबसे अधिक होती है?
🔴 ① लाइमन
🟢 ② बाल्मर
🟡 ③ पैशेन
🔵 ④ ब्रैकेट
🟢 उत्तर: ③ पैशेन
📘 परीक्षा: JEE Main
📅 वर्ष: 2018 | शिफ़्ट: Morning
🔵 प्रश्न 47:
यदि इलेक्ट्रॉन की डी ब्रॉगली तरंगदैर्घ्य λ = h/√(2mE) है, तो E बढ़ाने पर λ —
🔴 ① बढ़ता है
🟢 ② घटता है
🟡 ③ समान रहता है
🔵 ④ पहले बढ़ता फिर घटता
🟢 उत्तर: ② घटता है
📘 परीक्षा: JEE Main
📅 वर्ष: 2020 | शिफ़्ट: Evening
🔵 प्रश्न 48:
फोटॉन की ऊर्जा E = hv का मान किस पर निर्भर करता है?
🔴 ① तरंगदैर्घ्य
🟢 ② आवृत्ति
🟡 ③ दोनों
🔵 ④ किसी पर नहीं
🟢 उत्तर: ② आवृत्ति
📘 परीक्षा: JEE Main
📅 वर्ष: 2023 | शिफ़्ट: Morning
🔵 प्रश्न 49:
कौन-सा सिद्धांत दो इलेक्ट्रॉनों के समान क्वांटम संख्याएँ होने से रोकता है?
🔴 ① हाइजेनबर्ग सिद्धांत
🟢 ② पॉली अपवर्जन सिद्धांत
🟡 ③ हंड का नियम
🔵 ④ डी ब्रॉगली सिद्धांत
🟢 उत्तर: ② पॉली अपवर्जन सिद्धांत
📘 परीक्षा: JEE Main
📅 वर्ष: 2019 | शिफ़्ट: Evening
🔵 प्रश्न 50:
हंड का अधिकतम गुणकता नियम कहता है —
🔴 ① उपकक्षा में इलेक्ट्रॉन जोड़े बनाते हैं
🟢 ② उपकक्षा में अधिकतम समान स्पिन वाले इलेक्ट्रॉन पहले आते हैं
🟡 ③ ऊर्जा न्यूनतम होती है
🔵 ④ स्थायित्व कम होता है
🟢 उत्तर: ② उपकक्षा में अधिकतम समान स्पिन वाले इलेक्ट्रॉन पहले आते हैं
📘 परीक्षा: JEE Main
📅 वर्ष: 2017 | शिफ़्ट: Morning
————————————————————————————————————————————————————————————————————————————
JEE ADVANCED पिछले सालों के प्रश्न
🔵 प्रश्न 1:
किस वैज्ञानिक ने इलेक्ट्रॉन की खोज की?
🔴 ① गोल्डस्टीन
🟢 ② जे. जे. थॉमसन
🟡 ③ चैडविक
🔵 ④ रदरफोर्ड
🟢 उत्तर: ② जे. जे. थॉमसन
📘 परीक्षा: JEE Advanced | 📅 वर्ष: 2012 | पेपर: 1 | आयोजित: IIT Delhi
🔵 प्रश्न 2:
रदरफोर्ड के प्रयोग से परमाणु के किस भाग का पता चला?
🔴 ① इलेक्ट्रॉन
🟢 ② नाभिक
🟡 ③ प्रोटॉन
🔵 ④ न्यूट्रॉन
🟢 उत्तर: ② नाभिक
📘 परीक्षा: JEE Advanced 2014 | पेपर 1 | IIT Kharagpur
🔵 प्रश्न 3:
बोहर के अनुसार इलेक्ट्रॉन की कक्षा में कोणीय संवेग (L) का मान होता है —
🔴 ① nh
🟢 ② nh/2π
🟡 ③ n²h/2π
🔵 ④ h/2πn
🟢 उत्तर: ② nh/2π
📘 परीक्षा: JEE Advanced 2017 | पेपर 1 | IIT Madras
🔵 प्रश्न 4:
हाइड्रोजन-सदृश आयन में ऊर्जा स्तर E ∝ ?
🔴 ① 1/n
🟢 ② 1/n²
🟡 ③ n²
🔵 ④ n
🟢 उत्तर: ② 1/n²
📘 परीक्षा: JEE Advanced 2018 | पेपर 1 | IIT Kanpur
🔵 प्रश्न 5:
डे-ब्रॉग्ली तरंगदैर्घ्य (λ) का सूत्र है —
🔴 ① λ = mv/h
🟢 ② λ = h/mv
🟡 ③ λ = h²/mv
🔵 ④ λ = mv²/h
🟢 उत्तर: ② λ = h/mv
📘 परीक्षा: JEE Advanced 2013 | पेपर 1 | IIT Bombay
🔵 प्रश्न 6:
इलेक्ट्रॉन का आवेश-द्रव्यमान अनुपात (e/m) किसने मापा?
🔴 ① मिलिकन
🟢 ② थॉमसन
🟡 ③ रदरफोर्ड
🔵 ④ बोहर
🟢 उत्तर: ② थॉमसन
📘 परीक्षा: JEE Advanced 2016 | पेपर 1 | IIT Guwahati
🔵 प्रश्न 7:
मिलिकन के तेल-बूंद प्रयोग से किसका मान ज्ञात हुआ?
🔴 ① प्रोटॉन का द्रव्यमान
🟢 ② इलेक्ट्रॉन का आवेश
🟡 ③ न्यूट्रॉन का द्रव्यमान
🔵 ④ इलेक्ट्रॉन की ऊर्जा
🟢 उत्तर: ② इलेक्ट्रॉन का आवेश
📘 परीक्षा: JEE Advanced 2015 | पेपर 1 | IIT Bombay
🔵 प्रश्न 8:
हाइड्रोजन में Lyman शृंखला का वर्णक्रमीय क्षेत्र कौन-सा है?
🔴 ① दृश्य
🟢 ② पराबैंगनी
🟡 ③ अवरक्त
🔵 ④ माइक्रोवेव
🟢 उत्तर: ② पराबैंगनी
📘 परीक्षा: JEE Advanced 2011 | पेपर 1 | IIT Kanpur
🔵 प्रश्न 9:
Balmer शृंखला में इलेक्ट्रॉन का संक्रमण n₂ → n₁ के लिए होता है —
🔴 ① 2 → 1
🟢 ② 3 → 2
🟡 ③ 4 → 2
🔵 ④ 5 → 2
🟢 उत्तर: ③ 4 → 2 (और आगे के सभी → 2 )
📘 परीक्षा: JEE Advanced 2018 | पेपर 1 | IIT Kanpur
🔵 प्रश्न 10:
राइडबर्ग नियतांक (R) का मान लगभग कितना है?
🔴 ① 1.09×10⁶ m⁻¹
🟢 ② 1.097×10⁷ m⁻¹
🟡 ③ 3.00×10⁸ m⁻¹
🔵 ④ 6.626×10⁻³⁴ m⁻¹
🟢 उत्तर: ② 1.097×10⁷ m⁻¹
📘 परीक्षा: JEE Advanced 2019 | पेपर 1 | IIT Delhi
🔵 प्रश्न 11:
किसने अनिश्चितता सिद्धांत (Uncertainty Principle) दिया?
🔴 ① श्रोडिंगर
🟢 ② हाइजेनबर्ग
🟡 ③ बोहर
🔵 ④ डे-ब्रॉग्ली
🟢 उत्तर: ② हाइजेनबर्ग
📘 परीक्षा: JEE Advanced 2017 | पेपर 1 | IIT Madras
🔵 प्रश्न 12:
कौन-सा क्वांटम संख्या इलेक्ट्रॉन की कक्षा के आकार को दर्शाती है?
🔴 ① मुख्य (n)
🟢 ② कोणीय (l)
🟡 ③ चुंबकीय (m)
🔵 ④ स्पिन (s)
🟢 उत्तर: ② कोणीय (l)
📘 परीक्षा: JEE Advanced 2013 | पेपर 1 | IIT Bombay
🔵 प्रश्न 13:
Pauli अपवर्जन सिद्धांत के अनुसार —
🔴 ① एक परमाणु में सभी इलेक्ट्रॉन समान हो सकते हैं
🟢 ② कोई दो इलेक्ट्रॉन समान चार क्वांटम संख्याएँ नहीं रख सकते
🟡 ③ सभी इलेक्ट्रॉन एक ही ऊर्जा स्तर में रहते हैं
🔵 ④ n = l = m = s
🟢 उत्तर: ②
📘 परीक्षा: JEE Advanced 2012 | पेपर 1 | IIT Delhi
🔵 प्रश्न 14:
कौन-सा क्वांटम संख्या इलेक्ट्रॉन की ऊर्जा मुख्य रूप से निर्धारित करती है?
🔴 ① l
🟢 ② n
🟡 ③ m
🔵 ④ s
🟢 उत्तर: ② n
📘 परीक्षा: JEE Advanced 2015 | पेपर 1 | IIT Bombay
🔵 प्रश्न 15:
2p कक्षा में अधिकतम कितने इलेक्ट्रॉन समा सकते हैं?
🔴 ① 2
🟢 ② 4
🟡 ③ 6
🔵 ④ 8
🟢 उत्तर: ③ 6
📘 परीक्षा: JEE Advanced 2014 | पेपर 1 | IIT Kharagpur
🔵 प्रश्न 16:
n = 3 के लिए l के सम्भव मान क्या होंगे?
🔴 ① 0 केवल
🟢 ② 0, 1, 2
🟡 ③ 1 और 2
🔵 ④ 2 केवल
🟢 उत्तर: ② 0, 1, 2
📘 परीक्षा: JEE Advanced 2011 | पेपर 1 | IIT Kanpur
🔵 प्रश्न 17:
हाइड्रोजन के उत्सर्जन स्पेक्ट्रम में n₂ = 3 → n₁ = 2 संक्रमण किस शृंखला का है?
🔴 ① Balmer
🟢 ② Paschen
🟡 ③ Lyman
🔵 ④ Brackett
🟢 उत्तर: ① Balmer
📘 परीक्षा: JEE Advanced 2019 | पेपर 1 | IIT Delhi
🔵 प्रश्न 18:
यदि किसी इलेक्ट्रॉन की तरंगदैर्घ्य 1 Å है, तो उसका संवेग (p) होगा —
🔴 ① 6.626×10⁻³⁴ kg·m/s
🟢 ② 6.626×10⁻²⁴ kg·m/s
🟡 ③ 6.626×10⁻²⁷ kg·m/s
🔵 ④ 6.626×10⁻²⁹ kg·m/s
🟢 उत्तर: ② 6.626×10⁻²⁴ kg·m/s
📘 परीक्षा: JEE Advanced 2013 | पेपर: 1 | IIT Bombay
🔵 प्रश्न 19:
यदि किसी इलेक्ट्रॉन का संवेग बढ़ता है तो उसकी तरंगदैर्घ्य —
🔴 ① बढ़ती है
🟢 ② घटती है
🟡 ③ अपरिवर्तित रहती है
🔵 ④ पहले बढ़ती फिर घटती है
🟢 उत्तर: ② घटती है
📘 परीक्षा: JEE Advanced 2015 | पेपर: 1 | IIT Bombay
🔵 प्रश्न 20:
किसी परमाणु के लिए 4p उपखण्ड में इलेक्ट्रॉनों की अधिकतम संख्या क्या है?
🔴 ① 2
🟢 ② 4
🟡 ③ 6
🔵 ④ 10
🟢 उत्तर: ③ 6
📘 परीक्षा: JEE Advanced 2016 | पेपर: 1 | IIT Guwahati
🔵 प्रश्न 21:
हाइजेनबर्ग के अनिश्चितता सिद्धांत के अनुसार Δx × Δp ≥ ?
🔴 ① h
🟢 ② h/4π
🟡 ③ h/2π
🔵 ④ h²/4π
🟢 उत्तर: ② h/4π
📘 परीक्षा: JEE Advanced 2011 | पेपर: 1 | IIT Kanpur
🔵 प्रश्न 22:
n = 3, l = 2 के लिए कक्षा का नाम क्या होगा?
🔴 ① 3p
🟢 ② 3d
🟡 ③ 3s
🔵 ④ 2p
🟢 उत्तर: ② 3d
📘 परीक्षा: JEE Advanced 2017 | पेपर: 1 | IIT Madras
🔵 प्रश्न 23:
n = 4 के लिए कुल कक्षाओं की संख्या कितनी होगी?
🔴 ① 8
🟢 ② 16
🟡 ③ 32
🔵 ④ 64
🟢 उत्तर: ② 16
📘 परीक्षा: JEE Advanced 2014 | पेपर: 1 | IIT Kharagpur
🔵 प्रश्न 24:
किसने तरंग समीकरण (Wave Equation) दिया?
🔴 ① श्रोडिंगर
🟢 ② हाइजेनबर्ग
🟡 ③ बोहर
🔵 ④ डे-ब्रॉग्ली
🟢 उत्तर: ① श्रोडिंगर
📘 परीक्षा: JEE Advanced 2018 | पेपर: 1 | IIT Kanpur
🔵 प्रश्न 25:
इलेक्ट्रॉन का कौन-सा क्वांटम संख्या उसके घूर्णन (spin) को दर्शाता है?
🔴 ① n
🟢 ② s
🟡 ③ l
🔵 ④ m
🟢 उत्तर: ② s
📘 परीक्षा: JEE Advanced 2019 | पेपर: 1 | IIT Delhi
🔵 प्रश्न 26:
हंड का अधिकतम गुणनफल सिद्धांत (Hund’s Rule of Maximum Multiplicity) किससे सम्बन्धित है?
🔴 ① इलेक्ट्रॉन के द्रव्यमान से
🟢 ② इलेक्ट्रॉन के स्पिन से
🟡 ③ इलेक्ट्रॉन के आवेश से
🔵 ④ इलेक्ट्रॉन के संवेग से
🟢 उत्तर: ② इलेक्ट्रॉन के स्पिन से
📘 परीक्षा: JEE Advanced 2015 | पेपर: 1 | IIT Bombay
🔵 प्रश्न 27:
n = 2 स्तर में कुल कितने इलेक्ट्रॉन हो सकते हैं?
🔴 ① 2
🟢 ② 4
🟡 ③ 8
🔵 ④ 18
🟢 उत्तर: ③ 8
📘 परीक्षा: JEE Advanced 2013 | पेपर: 1 | IIT Bombay
🔵 प्रश्न 28:
n = 2, l = 1 के लिए सम्भव m के मान कितने हैं?
🔴 ① 1
🟢 ② 3
🟡 ③ 5
🔵 ④ 2
🟢 उत्तर: ② 3
📘 परीक्षा: JEE Advanced 2014 | पेपर: 1 | IIT Kharagpur
🔵 प्रश्न 29:
1s² 2s² 2p³ का इलेक्ट्रॉन विन्यास किस तत्व का है?
🔴 ① बोरोन
🟢 ② नाइट्रोजन
🟡 ③ ऑक्सीजन
🔵 ④ फ्लोरीन
🟢 उत्तर: ② नाइट्रोजन
📘 परीक्षा: JEE Advanced 2017 | पेपर: 1 | IIT Madras
🔵 प्रश्न 30:
किस उपखण्ड में इलेक्ट्रॉन बादलों का आकार डम्बल (dumbbell) जैसा होता है?
🔴 ① s
🟢 ② p
🟡 ③ d
🔵 ④ f
🟢 उत्तर: ② p
📘 परीक्षा: JEE Advanced 2011 | पेपर: 1 | IIT Kanpur
🔵 प्रश्न 31:
n = 3, l = 2, m = 0 से कौन-सी कक्षा सूचित होती है?
🔴 ① 3dₓᵧ
🟢 ② 3d_z²
🟡 ③ 3dₓz
🔵 ④ 3p_z
🟢 उत्तर: ② 3d_z²
📘 परीक्षा: JEE Advanced 2012 | पेपर: 1 | IIT Delhi
🔵 प्रश्न 32:
किस उपखण्ड में अधिकतम 14 इलेक्ट्रॉन समा सकते हैं?
🔴 ① s
🟢 ② p
🟡 ③ d
🔵 ④ f
🟢 उत्तर: ④ f
📘 परीक्षा: JEE Advanced 2016 | पेपर: 1 | IIT Guwahati
🔵 प्रश्न 33:
कौन-सा क्वांटम संख्या इलेक्ट्रॉन की कक्षा की अभिविन्यास (orientation) को दर्शाता है?
🔴 ① n
🟢 ② m
🟡 ③ l
🔵 ④ s
🟢 उत्तर: ② m
📘 परीक्षा: JEE Advanced 2018 | पेपर: 1 | IIT Kanpur
🔵 प्रश्न 34:
1 मोल फोटॉन की ऊर्जा E = hν से दी जाती है। इसे प्रति मोल रूप में कैसे लिखा जा सकता है?
🔴 ① E = hν/Nₐ
🟢 ② E = Nₐhν
🟡 ③ E = hν×λ
🔵 ④ E = hc/λNₐ
🟢 उत्तर: ② E = Nₐhν
📘 परीक्षा: JEE Advanced 2019 | पेपर: 1 | IIT Delhi
————————————————————————————————————————————————————————————————————————————
मॉडल प्रश्न पत्र, अभ्यास
🧪 प्रश्न 1 से 25 (NEET-स्तर)
🔵 प्रश्न 1:
इलेक्ट्रॉन की खोज किस वैज्ञानिक ने की थी?
🔴 ① गोल्डस्टीन
🟢 ② थॉमसन
🟡 ③ रदरफोर्ड
🔵 ④ चाडविक
🟢 उत्तर: ② थॉमसन
🎯 कठिनाई: NEET
🔵 प्रश्न 2:
प्रोटॉन की खोज किसने की?
🔴 ① मिलिकन
🟢 ② गोल्डस्टीन
🟡 ③ रदरफोर्ड
🔵 ④ थॉमसन
🟢 उत्तर: ② गोल्डस्टीन
🎯 कठिनाई: NEET
🔵 प्रश्न 3:
न्यूट्रॉन की खोज किस वैज्ञानिक ने की थी?
🔴 ① बोहर
🟢 ② चाडविक
🟡 ③ मिलिकन
🔵 ④ रदरफोर्ड
🟢 उत्तर: ② चाडविक
🎯 कठिनाई: NEET
🔵 प्रश्न 4:
थॉमसन के परमाणु मॉडल को क्या कहा जाता है?
🔴 ① तरबूज मॉडल
🟢 ② प्लम पुडिंग मॉडल
🟡 ③ ग्रह मॉडल
🔵 ④ अंडाकार मॉडल
🟢 उत्तर: ② प्लम पुडिंग मॉडल
🎯 कठिनाई: NEET
🔵 प्रश्न 5:
रदरफोर्ड ने अपने प्रयोग में किसका उपयोग किया था?
🔴 ① बीटा कण
🟢 ② अल्फा कण
🟡 ③ गामा किरणें
🔵 ④ इलेक्ट्रॉन
🟢 उत्तर: ② अल्फा कण
🎯 कठिनाई: NEET
🔵 प्रश्न 6:
रदरफोर्ड के प्रयोग से यह निष्कर्ष निकला कि —
🔴 ① सम्पूर्ण द्रव्यमान इलेक्ट्रॉन में है
🟢 ② परमाणु का अधिकांश भाग रिक्त है
🟡 ③ नाभिक का कोई अस्तित्व नहीं
🔵 ④ इलेक्ट्रॉन केन्द्र में स्थित हैं
🟢 उत्तर: ② परमाणु का अधिकांश भाग रिक्त है
🎯 कठिनाई: NEET
🔵 प्रश्न 7:
रदरफोर्ड के अनुसार, नाभिक में कौन-कौन से कण होते हैं?
🔴 ① केवल इलेक्ट्रॉन
🟢 ② प्रोटॉन और न्यूट्रॉन
🟡 ③ केवल प्रोटॉन
🔵 ④ केवल न्यूट्रॉन
🟢 उत्तर: ② प्रोटॉन और न्यूट्रॉन
🎯 कठिनाई: NEET
🔵 प्रश्न 8:
बोहर ने परमाणु की स्थिरता समझाने के लिए कौन-सा नियम दिया?
🔴 ① ऊर्जा संरक्षण नियम
🟢 ② कोणीय संवेग का परिमाणीकरण
🟡 ③ द्रव्यमान संरक्षण
🔵 ④ गतिज ऊर्जा सिद्धांत
🟢 उत्तर: ② कोणीय संवेग का परिमाणीकरण
🎯 कठिनाई: NEET
🔵 प्रश्न 9:
बोहर के अनुसार इलेक्ट्रॉन की ऊर्जा अवस्था को क्या कहा जाता है?
🔴 ① कक्षा
🟢 ② कक्षीय ऊर्जा स्तर
🟡 ③ परिमाण स्तर
🔵 ④ कक्षीय दूरी
🟢 उत्तर: ② कक्षीय ऊर्जा स्तर
🎯 कठिनाई: NEET
🔵 प्रश्न 10:
इलेक्ट्रॉन का आवेश होता है —
🔴 ① +1.602 × 10⁻¹⁹ C
🟢 ② −1.602 × 10⁻¹⁹ C
🟡 ③ 0
🔵 ④ 9.1 × 10⁻³¹ C
🟢 उत्तर: ② −1.602 × 10⁻¹⁹ C
🎯 कठिनाई: NEET
🔵 प्रश्न 11:
इलेक्ट्रॉन का द्रव्यमान लगभग —
🔴 ① 9.1 × 10⁻³¹ kg
🟢 ② 1.67 × 10⁻²⁷ kg
🟡 ③ 1.008 amu
🔵 ④ 1.0 g
🟢 उत्तर: ① 9.1 × 10⁻³¹ kg
🎯 कठिनाई: NEET
🔵 प्रश्न 12:
हाइड्रोजन परमाणु में इलेक्ट्रॉन की ऊर्जा अवस्था का सूत्र —
🔴 ① E = −13.6/n² eV
🟢 ② E = −13.6n² eV
🟡 ③ E = −2.18 × 10⁻¹⁸ × n
🔵 ④ E = 13.6n eV
🟢 उत्तर: ① E = −13.6/n² eV
🎯 कठिनाई: NEET
🔵 प्रश्न 13:
किसी परमाणु में इलेक्ट्रॉन की गति के कारण कौन-सी ऊर्जा होती है?
🔴 ① स्थितिज
🟢 ② गतिज
🟡 ③ रासायनिक
🔵 ④ नाभिकीय
🟢 उत्तर: ② गतिज
🎯 कठिनाई: NEET
🔵 प्रश्न 14:
किसी इलेक्ट्रॉन का मुख्य क्वांटम संख्या ‘n’ क्या बताती है?
🔴 ① कक्षा का आकार
🟢 ② ऊर्जा स्तर
🟡 ③ अभिविन्यास
🔵 ④ स्पिन दिशा
🟢 उत्तर: ② ऊर्जा स्तर
🎯 कठिनाई: NEET
🔵 प्रश्न 15:
क्वांटम संख्या का कुल कितने प्रकार होते हैं?
🔴 ① 2
🟢 ② 3
🟡 ③ 4
🔵 ④ 5
🟢 उत्तर: ③ 4
🎯 कठिनाई: NEET
🔵 प्रश्न 16:
स्पिन क्वांटम संख्या के कितने सम्भव मान होते हैं?
🔴 ① 2
🟢 ② 1
🟡 ③ 4
🔵 ④ 0
🟢 उत्तर: ① 2
🎯 कठिनाई: NEET
🔵 प्रश्न 17:
अफबाऊ सिद्धांत के अनुसार इलेक्ट्रॉन सबसे पहले किस कक्षा को भरता है?
🔴 ① उच्चतम ऊर्जा
🟢 ② न्यूनतम ऊर्जा
🟡 ③ मध्यम ऊर्जा
🔵 ④ कोई नहीं
🟢 उत्तर: ② न्यूनतम ऊर्जा
🎯 कठिनाई: NEET
🔵 प्रश्न 18:
पाउली अपवर्जन सिद्धांत किस पर आधारित है?
🔴 ① ऊर्जा संरक्षण
🟢 ② दो इलेक्ट्रॉन समान चार क्वांटम संख्याएँ नहीं रख सकते
🟡 ③ इलेक्ट्रॉन की घूर्णन गति
🔵 ④ रासायनिक बन्धन
🟢 उत्तर: ② दो इलेक्ट्रॉन समान चार क्वांटम संख्याएँ नहीं रख सकते
🎯 कठिनाई: NEET
🔵 प्रश्न 19:
हुंड के नियम के अनुसार इलेक्ट्रॉन कक्षाएँ भरते हैं —
🔴 ① पहले जोड़ी में
🟢 ② पहले एक-एक कर
🟡 ③ ऊर्जा स्तर के आधार पर
🔵 ④ कोई नहीं
🟢 उत्तर: ② पहले एक-एक कर
🎯 कठिनाई: NEET
🔵 प्रश्न 20:
n = 3 होने पर अधिकतम इलेक्ट्रॉनों की संख्या होगी —
🔴 ① 9
🟢 ② 18
🟡 ③ 8
🔵 ④ 32
🟢 उत्तर: ② 18
🎯 कठिनाई: NEET
🔵 प्रश्न 21:
p-कक्षा में अधिकतम कितने इलेक्ट्रॉन समा सकते हैं?
🔴 ① 2
🟢 ② 4
🟡 ③ 6
🔵 ④ 10
🟢 उत्तर: ③ 6
🎯 कठिनाई: NEET
🔵 प्रश्न 22:
d-कक्षा में अधिकतम इलेक्ट्रॉनों की संख्या —
🔴 ① 10
🟢 ② 14
🟡 ③ 6
🔵 ④ 8
🟢 उत्तर: ① 10
🎯 कठिनाई: NEET
🔵 प्रश्न 23:
हाइड्रोजन स्पेक्ट्रम का लाइमन शृंखला किस क्षेत्र में होती है?
🔴 ① दृश्य
🟢 ② पराबैंगनी
🟡 ③ अवरक्त
🔵 ④ एक्स-किरण
🟢 उत्तर: ② पराबैंगनी
🎯 कठिनाई: NEET
🔵 प्रश्न 24:
पाशेन शृंखला किस क्षेत्र में होती है?
🔴 ① पराबैंगनी
🟢 ② दृश्य
🟡 ③ अवरक्त
🔵 ④ गामा
🟢 उत्तर: ③ अवरक्त
🎯 कठिनाई: NEET
🔵 प्रश्न 25:
हाइड्रोजन की बाल्मर शृंखला किस n से प्रारम्भ होती है?
🔴 ① n = 1
🟢 ② n = 2
🟡 ③ n = 3
🔵 ④ n = 4
🟢 उत्तर: ② n = 2
🎯 कठिनाई: NEET
⚙ प्रश्न 26 से 40 (JEE Main-स्तर)
🔵 प्रश्न 26:
रदरफोर्ड के परमाणु मॉडल की प्रमुख त्रुटि क्या थी?
🔴 ① नाभिक का आकार
🟢 ② इलेक्ट्रॉन की स्थिरता का अभाव
🟡 ③ प्रोटॉन का अस्तित्व नहीं
🔵 ④ न्यूट्रॉन की स्थिति
🟢 उत्तर: ② इलेक्ट्रॉन की स्थिरता का अभाव
🎯 कठिनाई: JEE Main
🔵 प्रश्न 27:
बोहर मॉडल के अनुसार हाइड्रोजन परमाणु में इलेक्ट्रॉन की गति की त्रिज्या का अनुपात (r₁:r₂:r₃) क्या होगा?
🔴 ① 1:2:3
🟢 ② 1:4:9
🟡 ③ 1:8:27
🔵 ④ 1:16:81
🟢 उत्तर: ① 1:2:3
🎯 कठिनाई: JEE Main
🔵 प्रश्न 28:
बोहर मॉडल के अनुसार हाइड्रोजन परमाणु में कोणीय संवेग = ?
🔴 ① nh/2π
🟢 ② h/2πn
🟡 ③ h/n
🔵 ④ n/h
🟢 उत्तर: ① nh/2π
🎯 कठिनाई: JEE Main
🔵 प्रश्न 29:
किसी परमाणु में n = 4, l = 2 के लिए अधिकतम इलेक्ट्रॉनों की संख्या —
🔴 ① 4
🟢 ② 10
🟡 ③ 14
🔵 ④ 6
🟢 उत्तर: ② 10
🎯 कठिनाई: JEE Main
🔵 प्रश्न 30:
यदि किसी इलेक्ट्रॉन की ऊर्जा −3.4 eV है, तो वह किस कक्षा में होगा?
🔴 ① n = 1
🟢 ② n = 2
🟡 ③ n = 3
🔵 ④ n = 4
🟢 उत्तर: ② n = 2
🎯 कठिनाई: JEE Main
🔵 प्रश्न 31:
हाइड्रोजन के लाइमन शृंखला की सबसे कम तरंगदैर्घ्य किस संक्रमण से होती है?
🔴 ① n = 2 → 1
🟢 ② n = ∞ → 1
🟡 ③ n = 3 → 1
🔵 ④ n = 4 → 1
🟢 उत्तर: ② n = ∞ → 1
🎯 कठिनाई: JEE Main
🔵 प्रश्न 32:
1s²2s²2p⁶3s²3p⁵ के लिए तत्व कौन-सा है?
🔴 ① ऑक्सीजन
🟢 ② फ्लोरीन
🟡 ③ क्लोरीन
🔵 ④ सोडियम
🟢 उत्तर: ③ क्लोरीन
🎯 कठिनाई: JEE Main
🔵 प्रश्न 33:
किसी परमाणु में 3 मुख्य क्वांटम स्तर होने पर अधिकतम इलेक्ट्रॉनों की संख्या —
🔴 ① 9
🟢 ② 18
🟡 ③ 32
🔵 ④ 2
🟢 उत्तर: ② 18
🎯 कठिनाई: JEE Main
🔵 प्रश्न 34:
हाइड्रोजन परमाणु में इलेक्ट्रॉन के ऊर्जा स्तरों का अनुपात (E₁:E₂:E₃) —
🔴 ① 1:4:9
🟢 ② 1:1/4:1/9
🟡 ③ −1:−4:−9
🔵 ④ −1:−1/4:−1/9
🟢 उत्तर: ④ −1:−1/4:−1/9
🎯 कठिनाई: JEE Main
🔵 प्रश्न 35:
किसी इलेक्ट्रॉन की तरंगदैर्घ्य λ = h/mv किस सिद्धांत से सम्बंधित है?
🔴 ① रदरफोर्ड
🟢 ② डी-ब्रॉइ
🟡 ③ श्रोडिंगर
🔵 ④ बोहर
🟢 उत्तर: ② डी-ब्रॉइ
🎯 कठिनाई: JEE Main
🔵 प्रश्न 36:
श्रोडिंगर तरंग समीकरण किसका वर्णन करता है?
🔴 ① इलेक्ट्रॉन की स्थिति और गति
🟢 ② इलेक्ट्रॉन का तरंगीय स्वभाव
🟡 ③ प्रोटॉन की गति
🔵 ④ परमाणु द्रव्यमान
🟢 उत्तर: ② इलेक्ट्रॉन का तरंगीय स्वभाव
🎯 कठिनाई: JEE Main
🔵 प्रश्न 37:
किसी परमाणु में d-कक्षा के लिए l का मान होगा —
🔴 ① 0
🟢 ② 1
🟡 ③ 2
🔵 ④ 3
🟢 उत्तर: ③ 2
🎯 कठिनाई: JEE Main
🔵 प्रश्न 38:
क्वांटम संख्या n = 2 के लिए सम्भव कक्षाओं की संख्या —
🔴 ① 2
🟢 ② 4
🟡 ③ 8
🔵 ④ 16
🟢 उत्तर: ② 4
🎯 कठिनाई: JEE Main
🔵 प्रश्न 39:
1 mol फोटॉन की ऊर्जा ज्ञात करने का सूत्र —
🔴 ① E = hc/λ
🟢 ② E = Nhc/λ
🟡 ③ E = λ/hc
🔵 ④ E = hcλ
🟢 उत्तर: ② E = Nhc/λ
🎯 कठिनाई: JEE Main
🔵 प्रश्न 40:
यदि λ = 400 nm है, तो फोटॉन की ऊर्जा लगभग कितनी होगी? (h = 6.63×10⁻³⁴ J·s, c = 3×10⁸ m/s)
🔴 ① 3.1 eV
🟢 ② 4.97 eV
🟡 ③ 1.55 eV
🔵 ④ 0.55 eV
🟢 उत्तर: ① 3.1 eV
🎯 कठिनाई: JEE Main
🚀 प्रश्न 41 से 50 (JEE Advanced-स्तर)
🔵 प्रश्न 41:
यदि किसी हाइड्रोजन परमाणु में इलेक्ट्रॉन n = 3 से n = 2 कक्षा में गिरता है, तो उत्सर्जित फोटॉन की ऊर्जा (eV में) कितनी होगी?
🔴 ① 1.51 eV
🟢 ② 1.89 eV
🟡 ③ 3.4 eV
🔵 ④ 10.2 eV
🟢 उत्तर: ② 1.89 eV
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 42:
किसी हाइड्रोजन सदृश आयन में इलेक्ट्रॉन की ऊर्जा −54.4 eV है। उसका परमाणु क्रमांक क्या होगा?
(सूत्र: E = −13.6Z²/n² eV, n = 1)
🔴 ① 2
🟢 ② 3
🟡 ③ 4
🔵 ④ 5
🟢 उत्तर: ② 3
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 43:
यदि हाइड्रोजन परमाणु के n = 4 स्तर का त्रिज्या 0.85 Å है, तो n = 1 स्तर का त्रिज्या होगा —
🔴 ① 0.85 Å
🟢 ② 0.2125 Å
🟡 ③ 0.85 × 4 Å
🔵 ④ 0.053 Å
🟢 उत्तर: ④ 0.053 Å
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 44:
किसी हाइड्रोजन परमाणु में n = 5 से n = 2 संक्रमण पर उत्सर्जित तरंगदैर्घ्य ज्ञात करने का सूत्र है —
🔴 ① 1/λ = R(1/n₁² − 1/n₂²)
🟢 ② 1/λ = R(1/n₂² − 1/n₁²)
🟡 ③ λ = R(1/n₁² − 1/n₂²)
🔵 ④ λ = cR/n
🟢 उत्तर: ① 1/λ = R(1/n₁² − 1/n₂²)
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 45:
एक इलेक्ट्रॉन 3.28×10⁷ m/s की चाल से चल रहा है। उसकी डी-ब्रॉइ तरंगदैर्घ्य क्या होगी? (h = 6.63×10⁻³⁴, m = 9.1×10⁻³¹)
🔴 ① 2.2×10⁻¹⁰ m
🟢 ② 1.0×10⁻¹⁰ m
🟡 ③ 0.5×10⁻¹⁰ m
🔵 ④ 6.6×10⁻¹⁰ m
🟢 उत्तर: ① 2.2×10⁻¹⁰ m
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 46:
किसी परमाणु के लिए अधिकतम इलेक्ट्रॉनों की संख्या जो n और l के मान से निर्धारित होती है, उसका सूत्र —
🔴 ① 4l + 2
🟢 ② 2(2l + 1)
🟡 ③ 2l²
🔵 ④ n²
🟢 उत्तर: ② 2(2l + 1)
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 47:
यदि किसी परमाणु में क्वांटम संख्या n = 4, l = 1 हो, तो कितने m मान सम्भव हैं?
🔴 ① 1
🟢 ② 3
🟡 ③ 5
🔵 ④ 7
🟢 उत्तर: ② 3
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 48:
किसी हाइड्रोजन परमाणु में इलेक्ट्रॉन n = 2 से n = 1 कक्षा में गिरता है। उत्सर्जित फोटॉन की आवृत्ति होगी —
🔴 ① 6.17×10¹⁴ Hz
🟢 ② 2.47×10¹⁵ Hz
🟡 ③ 4.56×10¹⁴ Hz
🔵 ④ 3.29×10¹⁵ Hz
🟢 उत्तर: ② 2.47×10¹⁵ Hz
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 49:
यदि n = 3 के लिए कक्षा का त्रिज्या r₃ = 4.77×10⁻¹⁰ m है, तो n = 1 के लिए r₁ होगा —
🔴 ① 4.77×10⁻¹⁰ m
🟢 ② 0.53×10⁻¹⁰ m
🟡 ③ 1.59×10⁻¹⁰ m
🔵 ④ 0.85×10⁻¹⁰ m
🟢 उत्तर: ② 0.53×10⁻¹⁰ m
🎯 कठिनाई: JEE Advanced
🔵 प्रश्न 50:
हाइड्रोजन परमाणु के लिए 5वें ऊर्जा स्तर में इलेक्ट्रॉनों की अधिकतम संख्या —
🔴 ① 18
🟢 ② 32
🟡 ③ 50
🔵 ④ 72
🟢 उत्तर: ③ 50
🎯 कठिनाई: JEE Advanced
————————————————————————————————————————————————————————————————————————————
