Class 10 : Science (In Hindi) – Lesson 3. धातु एवं अधातु
पाठ का विश्लेषण एवं विवेचन
🔵 व्याख्या (Explanation ~1700 शब्द)
🌿 परिचय:
धातु एवं अधातु हमारे दैनिक जीवन में अत्यंत उपयोगी तत्व हैं। ये पृथ्वी की परतों में स्वाभाविक रूप से पाए जाते हैं। धातु प्रायः ठोस, चमकीले, ऊष्मा और विद्युत के सुचालक होते हैं जबकि अधातु इसके विपरीत गुण रखते हैं।
🟢 1. भौतिक गुण (Physical Properties):
🔵 (a) चमक (Lustre): धातुओं में प्राकृतिक चमक होती है, जैसे — ताँबा, सोना, चाँदी आदि।
💡 अधातुओं में चमक नहीं होती, जैसे — गंधक, फॉस्फोरस।
🔵 (b) तन्यता (Malleability): धातुओं को पीटकर पतली चादरें बनाई जा सकती हैं।
➡️ उदाहरण: सोने व एल्युमिनियम की पत्तियाँ।
✏️ अधातु भंगुर होती हैं, पीटने पर टूट जाती हैं।
🔵 (c) नलिक्यता (Ductility): धातुओं को खींचकर पतले तारों में बदला जा सकता है।
➡️ उदाहरण: ताँबे व एल्युमिनियम के तार।
🔵 (d) ऊष्मा व विद्युत चालकता: धातु ऊष्मा और विद्युत की अच्छे चालक होती हैं।
➡️ चाँदी (Ag) और ताँबा (Cu) सबसे उत्तम चालक हैं।
💡 अधातु जैसे गंधक, फॉस्फोरस विद्युत के कुचालक हैं।
🔵 (e) ध्वनि उत्पादन (Sonority): धातु को ठोकने पर मधुर ध्वनि उत्पन्न होती है।
➡️ उदाहरण: घंटी, काँसा।
🔵 (f) गलनांक और क्वथनांक: धातुओं का गलनांक व क्वथनांक अधिक होता है, जबकि अधातुओं का कम।
➡️ पारा (Hg) एकमात्र धातु है जो द्रव अवस्था में होती है।
🟡 2. रासायनिक गुण (Chemical Properties):
🔵 (a) वायु के साथ अभिक्रिया: कुछ धातुएँ वायु में ऑक्सीजन से अभिक्रिया कर ऑक्साइड बनाती हैं।
➡️ 4Na + O₂ → 2Na₂O
➡️ 2Mg + O₂ → 2MgO
💡 सोडियम और पोटैशियम अत्यधिक अभिक्रियाशील होते हैं, अतः इन्हें मिट्टी के तेल में रखा जाता है।
🔵 (b) जल के साथ अभिक्रिया: अलग-अलग धातुओं की जल के साथ क्रिया की दर भिन्न होती है।
➡️ 2Na + 2H₂O → 2NaOH + H₂↑
➡️ Ca + 2H₂O → Ca(OH)₂ + H₂↑
➡️ Mg + H₂O (गर्म जल) → Mg(OH)₂ + H₂↑
💡 सोडियम की क्रिया अत्यधिक ऊष्माक्षेपी होती है।
🔵 (c) अम्लों के साथ अभिक्रिया:
धातु + अम्ल → लवण + हाइड्रोजन गैस
➡️ Zn + 2HCl → ZnCl₂ + H₂↑
➡️ Fe + H₂SO₄ → FeSO₄ + H₂↑
💡 हाइड्रोजन गैस की पहचान: जलती हुई तीली पर “पॉप” ध्वनि।
🔵 (d) अधातुओं के साथ अभिक्रिया:
धातु अधातु से संयोजित होकर लवण बनाती हैं।
➡️ 2Na + Cl₂ → 2NaCl
➡️ 2Mg + O₂ → 2MgO
🔴 3. अभिक्रियाशीलता श्रेणी (Reactivity Series):
🧠 यह धातुओं को उनकी अभिक्रियाशीलता के घटते क्रम में दर्शाती है —
➡️ K > Na > Ca > Mg > Al > Zn > Fe > Pb > H > Cu > Hg > Ag > Au
💡 पोटैशियम और सोडियम सबसे अधिक अभिक्रियाशील हैं जबकि सोना और चाँदी सबसे कम।
✔️ यह श्रृंखला बताती है कि कौन-सी धातु किसी अन्य को उसके लवण से विस्थापित कर सकती है।
🟢 4. विस्थापन अभिक्रिया (Displacement Reaction):
✏️ परिभाषा: जब कोई अधिक अभिक्रियाशील धातु किसी कम अभिक्रियाशील धातु को उसके लवण से विस्थापित करती है, उसे विस्थापन अभिक्रिया कहते हैं।
➡️ Zn + CuSO₄ → ZnSO₄ + Cu
💡 यहाँ जस्ता (Zn) ने ताँबे (Cu) को उसके लवण से विस्थापित किया।
🟡 5. धातुओं की संक्षारण (Corrosion):
💡 जब धातु वायु की नमी व ऑक्सीजन के संपर्क में आती है तो वह धीरे-धीरे नष्ट होने लगती है।
➡️ Fe + H₂O + O₂ → Fe₂O₃·xH₂O (जंग)
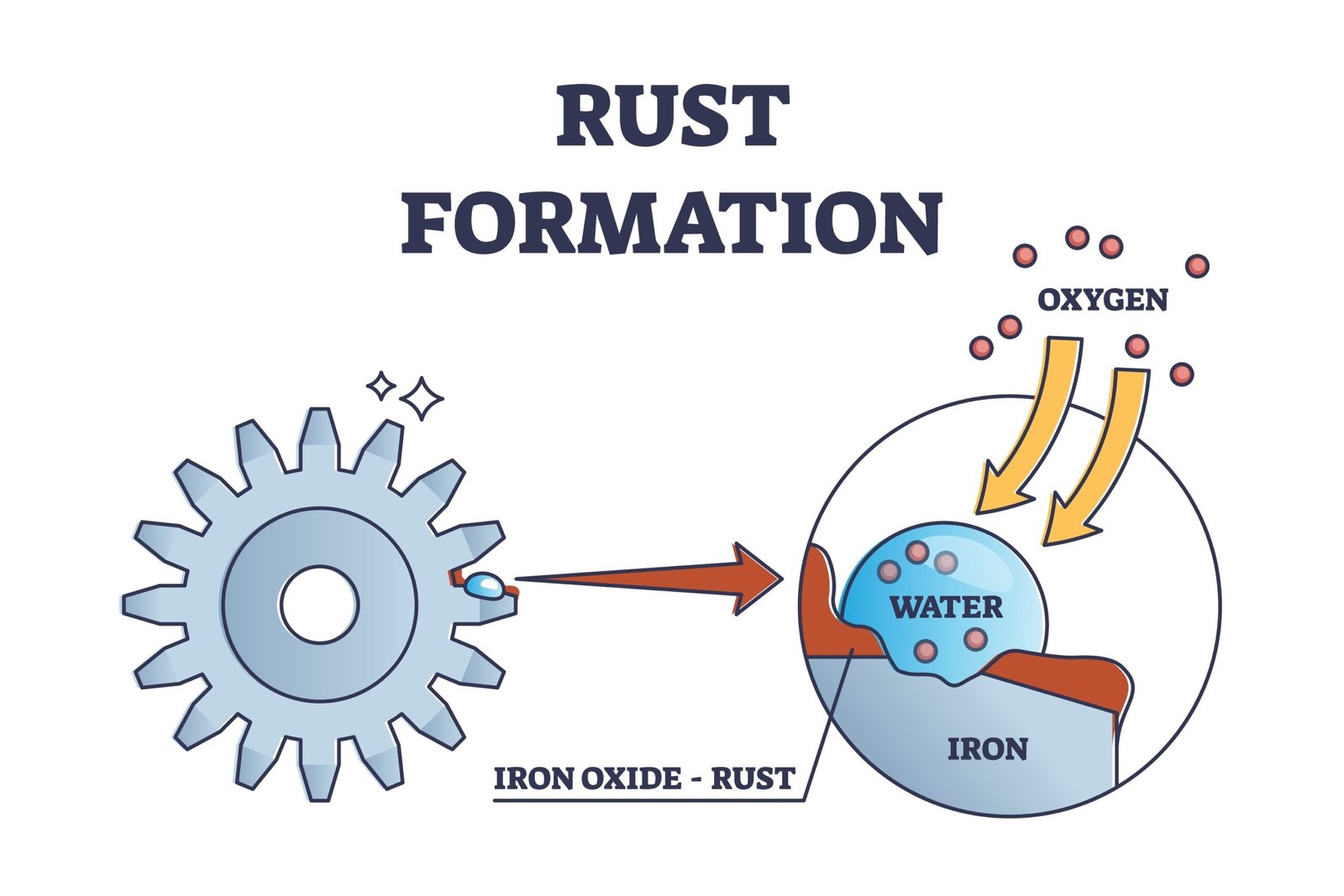
🟢 रोकथाम के उपाय:
🔹 तेल/ग्रीस की परत चढ़ाना
🔹 रंग व वार्निश लगाना
🔹 गैल्वनाइजेशन (Zn की परत चढ़ाना)
🔹 टिन-चढ़ाना
✔️ उदाहरण: लोहे में जंग लगने से मजबूती घटती है।
🔵 6. अधातुओं के गुण (Properties of Non-Metals):
🟢 अधातु के सामान्य गुण:
🔹 ये चमकहीन होती हैं।
🔹 ऊष्मा व विद्युत की कुचालक होती हैं।
🔹 भंगुर होती हैं।
🔹 अम्लों के साथ प्रतिक्रिया नहीं करतीं।
🔹 वायु के साथ मिलकर ऑक्साइड बनाती हैं (अधिकतर अम्लीय प्रकृति के)।
💡 उदाहरण:
➡️ S + O₂ → SO₂
➡️ C + O₂ → CO₂
🟡 7. धातु और अधातु के उपयोग:
🔹 धातुएँ:
➡️ ताँबा — विद्युत तारों में
➡️ एल्युमिनियम — हवाई जहाज के पुर्जों में
➡️ सोना — आभूषणों में
➡️ लोहा — भवन निर्माण में
🔹 अधातुएँ:
➡️ ऑक्सीजन — श्वसन में
➡️ नाइट्रोजन — उर्वरकों में
➡️ क्लोरीन — कीटाणुनाशक में
➡️ सल्फर — औषधियों में
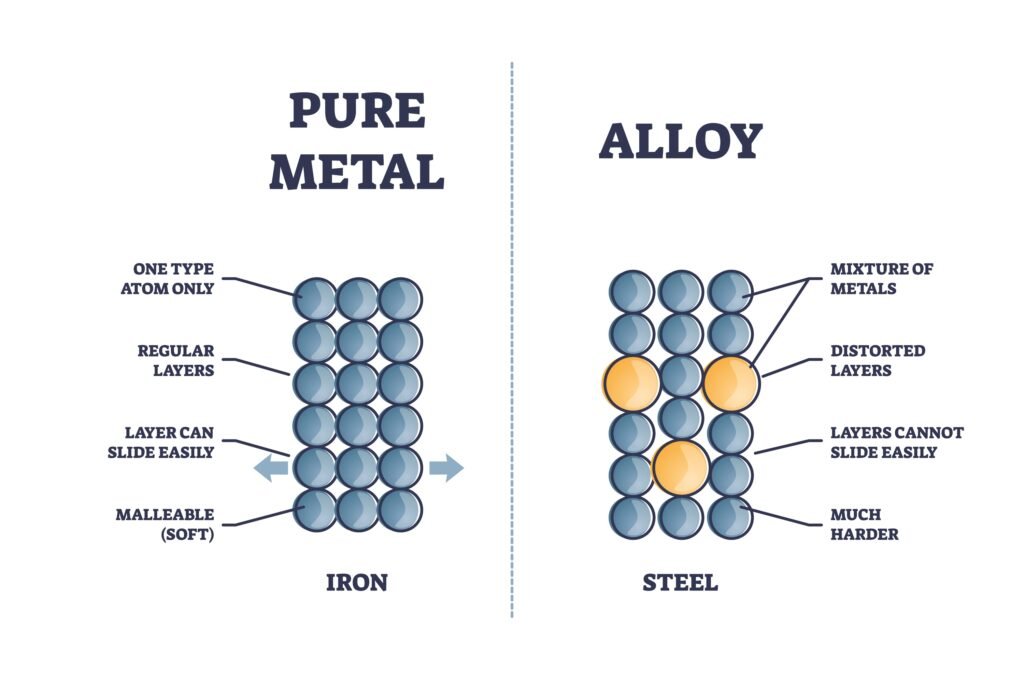
🔴 8. मिश्रधातु (Alloys):
💡 दो या दो से अधिक धातुओं का मिश्रण जिसे विशेष गुणों के लिए तैयार किया जाता है, उसे मिश्रधातु कहते हैं।
🟢 उदाहरण:
🔹 पीतल = ताँबा + जस्ता
🔹 कांसा = ताँबा + टिन
🔹 स्टील = लोहा + कार्बन
🔹 स्टेनलेस स्टील = लोहा + क्रोमियम + निकेल
✔️ मिश्रधातु के लाभ:
🔸 संक्षारण से सुरक्षा
🔸 कठोरता और दीर्घायु में वृद्धि
🟢 9. धातुओं का परिशोधन (Refining of Metals):
✏️ परिभाषा: धातु को उसकी अशुद्धियों से मुक्त करने की प्रक्रिया।
💡 प्रकार:
🔹 विद्युत अपघटन विधि: शुद्ध धातु कैथोड पर जमा होती है। उदाहरण: ताँबे का परिशोधन।
🔹 रासायनिक विधि: कुछ रासायनिक अभिक्रियाओं द्वारा शुद्धिकरण।
🟡 10. अधातुओं का जैविक महत्व:
💡 अधातुएँ जीवन के लिए अत्यावश्यक हैं —
🔹 ऑक्सीजन – श्वसन के लिए
🔹 नाइट्रोजन – प्रोटीन व डी.एन.ए. में
🔹 फॉस्फोरस – हड्डियों के लिए
🔹 सल्फर – अमीनो अम्लों में
✔️ निष्कर्ष: जीवन की मूल संरचना अधातुओं पर आधारित है।
🔵 11. धातु और अधातु का व्यवहार लवणों के साथ:
➡️ Zn + CuSO₄ → ZnSO₄ + Cu (विस्थापन)
➡️ Cl₂ + 2NaBr → 2NaCl + Br₂ (अधातु द्वारा विस्थापन)
💡 अधातुएँ भी अपने से कम सक्रिय अधातुओं को विस्थापित कर सकती हैं।
🟢 12. अभिक्रियाशीलता की परीक्षा:
🔹 Zn की पट्टी को CuSO₄ विलयन में डुबोने पर लाल-भूरे रंग का Cu जमा होता है।
🔹 Cu की पट्टी को ZnSO₄ में डालने पर कोई परिवर्तन नहीं होता।
✔️ यह प्रमाण है कि Zn अधिक अभिक्रियाशील है।
🌟 सारांश (Summary ~300 शब्द)
🔹 धातुएँ ऊष्मा व विद्युत की सुचालक, तन्य, नलिक्य व चमकीली होती हैं।
🔹 अधातुएँ इन गुणों के विपरीत होती हैं।
🔹 धातुएँ जल, अम्ल व ऑक्सीजन के साथ अभिक्रिया करके लवण व गैस बनाती हैं।
🔹 अभिक्रियाशीलता श्रृंखला धातुओं की क्रियाशीलता का क्रम दर्शाती है।
🔹 अधिक सक्रिय धातु कम सक्रिय धातु को उसके लवण से विस्थापित करती है।
🔹 धातुओं में जंग लगने की प्रक्रिया को संक्षारण कहते हैं।
🔹 अधातु अम्लीय ऑक्साइड बनाती हैं जबकि धातु मूलकीय ऑक्साइड।
🔹 धातुएँ व अधातुएँ मानव जीवन में अत्यंत उपयोगी हैं — औद्योगिक, औषधीय, कृषि व दैनिक जीवन में।
🔹 मिश्रधातुएँ विशेष प्रयोजनों के लिए बनाई जाती हैं जैसे स्टील, पीतल, कांसा।
✔️ निष्कर्ष: धातु एवं अधातु का अध्ययन पदार्थों के रासायनिक स्वभाव को समझने की पहली सीढ़ी है।
————————————————————————————————————————————————————————————————————————————
पाठ्यपुस्तक के प्रश्न
🔵 Question 1:
निम्नलिखित में कौन-सा युग्म विस्थापन अभिक्रिया प्रदर्शित करता है—
(a) NaCl विलयन एवं ताँबा धातु
(b) MgCl₂ विलयन एवं एल्यूमिनियम धातु
(c) FeSO₄ विलयन एवं जस्ता धातु
(d) AgNO₃ विलयन एवं ताँबा धातु
🟢 Answer:
💡 विस्थापन अभिक्रिया में अधिक अभिक्रियाशील धातु, कम अभिक्रियाशील धातु को उसके यौगिक से विस्थापित करती है।
➡️ Cu + 2AgNO₃ → Cu(NO₃)₂ + 2Ag
✔️ अतः सही उत्तर है (d) AgNO₃ विलयन एवं ताँबा धातु।
🔵 Question 2:
लोहे के फ्राइंग पैन को जंग से बचाने के लिए निम्नलिखित में से कौन-सी विधि उपयुक्त है—
(a) ग्रीस लगाकर
(b) पेंट लगाकर
(c) जिंक की परत चढ़ाकर
(d) उपर्युक्त सभी
🟢 Answer:
💡 वायु और नमी के संपर्क से लोहे पर जंग लगती है।
🔹 ग्रीस, पेंट या जस्ता की परत धातु की सतह को वायु व नमी से अलग करती है।
✔️ अतः सही उत्तर है (d) उपर्युक्त सभी।
🔵 Question 3:
कोई धातु ऑक्सीजन के साथ अभिक्रिया कर उच्च गलनांक वाला यौगिक निर्मित करती है। यह यौगिक जल में घुलनशील है। यह तत्व क्या हो सकता है?
(a) कैल्शियम
(b) कार्बन
(c) सिलिकॉन
(d) लोहा
🟢 Answer:
💡 कैल्शियम ऑक्सीजन के साथ अभिक्रिया कर कैल्शियम ऑक्साइड (CaO) बनाता है।
➡️ 2Ca + O₂ → 2CaO
✔️ यह जल में घुलकर कैल्शियम हाइड्रॉक्साइड (Ca(OH)₂) बनाता है।
✔️ सही उत्तर: (a) कैल्शियम
🔵 Question 4:
खाद्य पदार्थों के डिब्बों पर जिंक की बजाय टिन का लेप होता है, क्योंकि—
(a) टिन की अपेक्षा जिंक सस्ता है।
(b) टिन की अपेक्षा जिंक का गलनांक अधिक है।
(c) टिन की अपेक्षा जिंक अधिक अभिक्रियाशील है।
(d) टिन की अपेक्षा जिंक कम अभिक्रियाशील है।
🟢 Answer:
💡 जिंक अधिक अभिक्रियाशील होने से खाद्य पदार्थों से अभिक्रिया कर सकता है।
🔹 जबकि टिन (Sn) कम अभिक्रियाशील होता है और सुरक्षित परत बनाता है।
✔️ सही उत्तर: (d) टिन की अपेक्षा जिंक कम अभिक्रियाशील है।
🔵 Question 5:
आपको एक हर्षे, बैटरी, बल्ब, तार एवं स्विच दिया गया है—
(a) इनका उपयोग कर धातुओं एवं अधातुओं के नमूनों के बीच आप भेद कैसे कर सकते हैं?
(b) धातुओं एवं अधातुओं में विभेदन के लिए इन परीक्षणों की उपयोगिता का आकलन कीजिए।
🟢 Answer:
💡 (a) प्रयोग:
🔹 परिपथ बनाकर अलग-अलग नमूनों को जोड़ें।
🔹 यदि बल्ब जलता है → नमूना चालक (धातु) है।
🔹 यदि बल्ब नहीं जलता → नमूना कुचालक (अधातु) है।
💡 (b) उपयोगिता:
✔️ यह परीक्षण बताता है कि धातुएँ विद्युत की सुचालक और अधातुएँ कुचालक होती हैं।
🔵 Question 6:
उष्माक्षेपी ऑक्साइड क्या होते हैं? दो उदाहरण दीजिए।
🟢 Answer:
💡 वे ऑक्साइड जो जल में घुलने पर ऊष्मा छोड़ते हैं, उष्माक्षेपी ऑक्साइड कहलाते हैं।
🟢 उदाहरण:
➡️ CaO + H₂O → Ca(OH)₂ + ऊष्मा
➡️ Na₂O + H₂O → 2NaOH + ऊष्मा
✔️ निष्कर्ष: इन अभिक्रियाओं में ऊष्मा उत्पन्न होती है।
🔵 Question 7:
दो धातुओं के नाम बताइए जो जल अथवा हाइड्रोक्लोरिक अम्ल के साथ अभिक्रिया कर हाइड्रोजन गैस उत्पन्न करती हैं।
🟢 Answer:
💡 धातुएँ जैसे सोडियम (Na) और जस्ता (Zn) अम्ल या जल से अभिक्रिया कर हाइड्रोजन उत्पन्न करती हैं।
➡️ 2Na + 2H₂O → 2NaOH + H₂↑
➡️ Zn + 2HCl → ZnCl₂ + H₂↑
✔️ निष्कर्ष: ये धातुएँ अम्लीय माध्यम में हाइड्रोजन उत्पन्न करती हैं।
🔵 Question 8:
किसी धातु M के विद्युत अपघटन अभिक्रिया में यदि M का एनोड, कैथोड एवं विलयन उपयुक्त लवण का हो तो क्या परिणाम होगा?
🟢 Answer:
💡 जब समान धातु का एनोड और कैथोड लिया जाए तो विद्युत प्रवाह से धातु के आयन कैथोड पर जमते हैं।
➡️ M²⁺ + 2e⁻ → M (कैथोड पर)
➡️ M → M²⁺ + 2e⁻ (एनोड पर)
✔️ निष्कर्ष: धातु शुद्ध हो जाती है — यह धातु परिशोधन (Refining) कहलाता है।
🔵 Question 9
प्रदीप ने मैग्नीशियम चूर्ण को टेस्ट ट्यूब में लेकर उसे गर्म किया। चित्र के अनुसार एक पर्कलिप से उसने टेस्ट ट्यूब को उल्टा करके उसमें उत्पन्न गैस को एकत्र किया।
(a) गैस की क्रिया क्या होगी—
(i) गीले लाल लिटमस पत्र पर?
(ii) गीले नीले लिटमस पत्र पर?
(b) ऊपर की अभिक्रियाओं के लिए संतुलित रासायनिक अभिक्रिया लिखिए।
🟢 Answer
💡 चरणवार समझें:
🔵 जब मैग्नीशियम (Mg) को गर्म किया जाता है तो वह ऑक्सीजन के साथ अभिक्रिया कर मैग्नीशियम ऑक्साइड (MgO) बनाता है।
➡️ 2Mg + O₂ → 2MgO
🟡 (a)(i) गीला लाल लिटमस पत्र:
✔️ मैग्नीशियम ऑक्साइड (MgO) जल के साथ अभिक्रिया कर क्षारीय हाइड्रॉक्साइड बनाता है।
➡️ MgO + H₂O → Mg(OH)₂
✔️ Mg(OH)₂ क्षारीय होता है, अतः लाल लिटमस पत्र को नीला कर देगा।
🟡 (a)(ii) गीला नीला लिटमस पत्र:
✔️ चूँकि यह क्षारीय प्रकृति का है, नीला लिटमस पत्र नीला ही बना रहेगा (कोई परिवर्तन नहीं)।
🟢 (b) ऊपर की अभिक्रियाओं के संतुलित रासायनिक समीकरण:
🔵 चरण 1: मैग्नीशियम का वायु में जलना
➡️ 2Mg + O₂ → 2MgO
🔵 चरण 2: बने हुए ऑक्साइड का जल के साथ अभिक्रिया करना
➡️ MgO + H₂O → Mg(OH)₂
✔️ निष्कर्ष: उत्पन्न पदार्थ क्षारीय प्रकृति का है, इसलिए लाल लिटमस पत्र को नीला करता है।
🔵 Question 10
लोहे को जंग से बचाने के लिए दो तरीके बताइए।
🟢 Answer
💡 जंग लगना = लोहा + वायु की नमी + ऑक्सीजन → भूरा जंग (Fe₂O₃·xH₂O)
🟢 तरीके:
🔵 तरीका 1: जस्ता की परत चढ़ाना (गैल्वनाइजेशन)
➡️ जस्ता की परत लोहा और वायु/जल के सीधा संपर्क को रोकती है।
🔵 तरीका 2: पेंट / ग्रीस / तेल लेप
➡️ सतह पर लेप करने से नमी और ऑक्सीजन धातु तक नहीं पहुँचती।
✔️ निष्कर्ष: धातु को वातावरण से अलग रखकर संक्षारण रोका जा सकता है।
🔵 Question 11
ऑक्सीजन के साथ संयुक्त होकर अधातुएँ कैसा ऑक्साइड बनाती हैं? कारण बताइए।
🟢 Answer
💡 अधातुएँ ऑक्सीजन के साथ मिलकर सामान्यतः अम्लीय ऑक्साइड बनाती हैं।
🔵 उदाहरण 1:
➡️ S + O₂ → SO₂
➡️ SO₂ + H₂O → H₂SO₃ (एक अम्लीय विलयन)
🔵 उदाहरण 2:
➡️ C + O₂ → CO₂
➡️ CO₂ + H₂O → H₂CO₃
🟢 कारण:
🔴 बने हुए ऑक्साइड जल में घुलकर अम्ल (H⁺ उत्पन्न करने वाले विलयन) बनाते हैं और ये नीले लिटमस को लाल कर सकते हैं।
✔️ निष्कर्ष: इसलिए अधातुओं के ऑक्साइड को अम्लीय ऑक्साइड कहा जाता है।
🔵 Question 12
कारण बताइए—
(a) प्लैटिनम, सोना एवं चाँदी का उपयोग आभूषण बनाने के लिए किया जाता है।
(b) सोडियम, पोटैशियम एवं कैल्शियम को तेल के अंदर सुरक्षित किया जाता है।
(c) एल्यूमिनियम अत्यधिक अभिक्रियाशील धातु है, फिर भी इसका उपयोग खाना बनाने वाले बर्तन बनाने के लिए किया जाता है।
(d) निम्नलिखित अभिक्रिया में कार्बोनेट एवं बाइकार्बोनेट आयन ऑक्साइड में परिवर्तित किए जाते हैं।
🟢 Answer
💡 (a) प्लैटिनम, सोना और चाँदी आभूषणों में क्यों?
🔵 ये धातुएँ अत्यंत कम अभिक्रियाशील हैं।
🔵 वायु, नमी, पसीने आदि से तुरंत नहीं बिगड़तीं।
🔵 इनकी चमक लंबे समय तक बनी रहती है।
✔️ इसलिए ये शरीर पर पहनने के लिए उपयुक्त हैं।
💡 (b) सोडियम, पोटैशियम, कैल्शियम तेल के अंदर क्यों रखे जाते हैं?
🔵 ये धातुएँ बहुत अधिक अभिक्रियाशील हैं।
🔵 ये वायुमंडलीय नमी और ऑक्सीजन के साथ तुरंत तीव्र अभिक्रिया कर लेती हैं और यहाँ तक कि आग पकड़ सकती हैं।
✔️ इसलिए इन्हें हवा से दूर, तेल के भीतर डुबोकर सुरक्षित रखा जाता है।
💡 (c) एल्यूमिनियम बर्तन के लिए सुरक्षित क्यों माना जाता है जबकि यह सक्रिय धातु है?
🔵 एल्यूमिनियम की सतह पर बहुत पतली, सघन और कठोर Al₂O₃ (एल्यूमिनियम ऑक्साइड) की परत बन जाती है।
🔵 यह परत आगे की अभिक्रिया को रोकती है और धातु को भोजन के साथ सीधी अभिक्रिया से बचाती है।
✔️ इसलिए एल्यूमिनियम रसोई में उपयोग के लिए उपयुक्त है।
💡 (d) कार्बोनेट और हाइड्रोजन कार्बोनेट से ऑक्साइड में जाना कैसे होता है?
🔵 जब कार्बोनेट या हाइड्रोजन कार्बोनेट गरम किए जाते हैं तो ये कार्बन डाइऑक्साइड गैस छोड़ते हैं और ऑक्साइड में बदलते हैं।
➡️ MCO₃ → MO + CO₂↑
➡️ MHCO₃ → MO + CO₂↑ + H₂O
(यहाँ M किसी धातु के लिए सामान्य प्रतीक है)
✔️ निष्कर्ष: ऊष्मा देने पर कार्बोनेट और हाइड्रोजन कार्बोनेट धात्विक ऑक्साइड में परिवर्तित हो जाते हैं।
🔵 Question 13
अपने दाँतों के इनेमल तथा ताँबे एवं लोहे से बनी जल आपूर्ति पाइपों में क्या समान कारण होता है कि दोनों को समय-समय पर साफ रखना अत्यंत ज़रूरी होता है? यह देखें तथा एक कारण सहित साफ रखने का महत्व बताइए।
🟢 Answer
💡 दाँतों की ऊपरी परत (इनेमल) तथा धातु की पाइप — दोनों की सतह पर जमाव (डिपॉज़िट) बनता है।
🔵 दाँतों पर:
🔹 भोजन के अवशेष व अम्लीय अपशिष्ट बैक्टीरिया द्वारा अम्ल में बदलते हैं।
🔹 यह अम्ल इनेमल (कैल्शियम आधारित परत) को धीरे-धीरे घोलता है।
✔️ परिणाम: दाँत कमजोर और क्षयग्रस्त हो सकते हैं।
🔵 पाइपों पर:
🔹 पानी के खनिज लवण जमकर परत बना लेते हैं।
🔹 जंग भी लग सकती है (विशेषकर लोहे में)।
✔️ परिणाम: पानी दूषित हो सकता है और प्रवाह कम हो सकता है।
🟢 समानता:
दोनों में सतह पर अवांछित जमाव बनता है जो हानिकारक है — इसलिए नियमित सफाई आवश्यक है।
✔️ निष्कर्ष: सतह की परत सुरक्षित रखने के लिए समय-समय पर जमाव हटाना अनिवार्य है।
🔵 Question 14
अभिक्रियाशीलता के आधार पर धातुओं एवं अधातुओं में विभेदन कीजिए।
🟢 Answer
💡 धातुएँ और अधातुएँ रासायनिक रूप से भिन्न व्यवहार दिखाती हैं।
🟢 धातुएँ:
🔵 इलेक्ट्रॉन छोड़ती हैं और धनायन बनती हैं (धनात्मक आवेशित आयन)।
🔵 प्रायः अम्लों के साथ अभिक्रिया कर हाइड्रोजन गैस देती हैं।
➡️ Zn + 2HCl → ZnCl₂ + H₂↑
🔵 जल और ऑक्सीजन से आसानी से क्रिया कर सकती हैं (विशेषकर सक्रिय धातुएँ जैसे Na, K)।
🟢 अधातुएँ:
🔴 इलेक्ट्रॉन ग्रहण करती हैं और ऋणायन बनती हैं (ऋणात्मक आयन)।
🔴 अधातु के ऑक्साइड अधिकतर अम्लीय होते हैं और जल में घुलकर अम्ल बनाते हैं।
➡️ SO₂ + H₂O → H₂SO₃
🔴 अधिकांश अधातुएँ अम्लों के साथ प्रत्यक्ष क्रिया कर हाइड्रोजन गैस नहीं बनातीं।
✔️ निष्कर्ष: धातु आमतौर पर अपचायक (इलेक्ट्रॉन देने वाली) तथा अधातु आमतौर पर ऑक्सीकारक (इलेक्ट्रॉन लेने वाली) प्रकृति की होती हैं।
🔵 Question 15
कुछ विशेष परिस्थितियों में, धातुएँ भी अम्लों के साथ अभिक्रिया नहीं करतीं तथा कुछ अधातुएँ धातुओं जैसी क्रिया दर्शाती हैं। उदाहरण देकर समझाइए कि “अभिक्रियाशीलता केवल धातु बनाम अधातु” के साधारण नियम से पूरी तरह निर्धारित क्यों नहीं होती।
🟢 Answer
💡 सामान्य नियम:
🔵 धातु + अम्ल → लवण + H₂↑
लेकिन इसके अपवाद हैं।
🟢 उदाहरण 1 (धातु जो अम्ल से नहीं क्रिया करती):
🔵 सोना (Au), प्लैटिनम (Pt) जैसे बहुत कम अभिक्रियाशील धातु, सधारण अम्ल (जैसे HCl) से क्रिया नहीं करते।
✔️ यह दर्शाता है कि सभी धातुएँ अम्ल के साथ आसानी से क्रिया नहीं करतीं।
🟢 उदाहरण 2 (अधातु जो धातु-जैसा व्यवहार करती है):
🔵 क्लोरीन (Cl₂) जैसे कुछ अधातु धातुओं से इलेक्ट्रॉन खींचकर धातु को उसके यौगिक से विस्थापित कर सकती है।
➡️ 2NaBr + Cl₂ → 2NaCl + Br₂
✔️ यहाँ क्लोरीन ने ब्रोमाइड आयन को विस्थापित किया, जैसे कोई अधिक सक्रिय धातु कम सक्रिय धातु को विस्थापित करती है।
🟡 तात्पर्य:
अभिक्रियाशीलता का व्यवहार धातु या अधातु होने से आगे भी निर्भर करता है — जैसे इलेक्ट्रॉन आकर्षण क्षमता, परत की सुरक्षा, क्रिया की दशा (ताप, दाब)।
✔️ निष्कर्ष: अभिक्रियाशीलता एक प्रवृत्ति है जो तत्व विशेष और परिस्थिति विशेष पर निर्भर करती है।
🔵 Question 16
अमलगम क्या है? दाँत भरने में इसका उपयोग क्यों होता है, परंतु इस्पात (लोहे की मिश्रधातु) का नहीं? इसका कारण बताइए।
🟢 Answer
💡 अमलगम = पारे (Hg) के साथ किसी धातु का मिश्रण।
🔵 चाँदी का अमलगम दाँत भरने में उपयोग किया जाता है क्योंकि:
🔹 यह दाँत की गुहा में भरने पर सख्त हो जाता है।
🔹 यह रासायनिक रूप से बहुत स्थिर रहता है और शीघ्र नष्ट नहीं होता।
🔹 यह चबाने के दबाव को सह सकता है।
🔴 इस्पात क्यों नहीं?
🔹 इस्पात लोहे पर आधारित मिश्रधातु है।
🔹 लोहे में जंग लगने की प्रवृत्ति होती है (Fe₂O₃·xH₂O बनता है)।
🔹 मुँह के नमी वाले वातावरण में यह ऑक्सीकरण होकर क्षरण कर सकता है।
✔️ निष्कर्ष: अमलगम सुरक्षित, मजबूत और अपेक्षाकृत स्थायी है, जबकि इस्पात जैविक रूप से उतना सुरक्षित नहीं माना जाता।
————————————————————————————————————————————————————————————————————————————
अन्य महत्वपूर्ण प्रश्न
(CBSE MODEL प्रश्न पत्र)
सिर्फ इसी पाठ से निर्मित CBSE MODEL प्रश्न पत्र
🔵 SECTION A (प्रश्न 1–6 : 1 अंक वाले बहुत लघु उत्तर प्रश्न)
🔵 Question 1:
कौन-सी धातु विद्युत की सर्वश्रेष्ठ चालक होती है?
🟢 Answer:
✔️ चाँदी (Ag) विद्युत की सबसे अच्छी चालक धातु है।
🔵 Question 2:
किस धातु को मिट्टी के तेल में रखा जाता है और क्यों?
🟢 Answer:
💡 सोडियम (Na) और पोटैशियम (K) अत्यधिक अभिक्रियाशील होती हैं।
✔️ इन्हें मिट्टी के तेल में रखा जाता है ताकि ये वायु और नमी के संपर्क में न आएँ।
🔵 Question 3:
कौन-सी एकमात्र धातु द्रव अवस्था में पाई जाती है?
🟢 Answer:
✔️ पारा (Hg) एकमात्र द्रव धातु है।
🔵 Question 4:
धातुओं की पहचान के दो भौतिक गुण लिखिए।
🟢 Answer:
🔹 धातुएँ चमकीली होती हैं।
🔹 धातुएँ ऊष्मा और विद्युत की सुचालक होती हैं।
🔵 Question 5:
लोहा वायु और नमी के संपर्क में आने पर क्या बनाता है?
🟢 Answer:
💡 लोहा (Fe) ऑक्सीजन और जल वाष्प से अभिक्रिया कर जंग (Fe₂O₃·xH₂O) बनाता है।
🔵 Question 6:
कौन-सा अधातु ठोस नहीं होता?
🟢 Answer:
✔️ ब्रोमीन (Br₂) एकमात्र द्रव अधातु है।
🟢 SECTION B (प्रश्न 7–12 : 2 अंक वाले लघु उत्तर प्रश्न)
🔵 Question 7:
धातुएँ विद्युत की अच्छी चालक क्यों होती हैं जबकि अधातुएँ नहीं?
🟢 Answer:
💡 धातुओं में मुक्त इलेक्ट्रॉन होते हैं जो विद्युत प्रवाह कराते हैं।
🔴 अधातुओं में इलेक्ट्रॉन बंधे होते हैं, इसलिए वे कुचालक होती हैं।
🔵 Question 8:
जस्ते (Zn) और ताँबे (Cu) के बीच विस्थापन अभिक्रिया का समीकरण लिखिए।
🟢 Answer:
➡️ Zn + CuSO₄ → ZnSO₄ + Cu
💡 जस्ता ताँबे को उसके लवण से विस्थापित करता है क्योंकि Zn अधिक अभिक्रियाशील है।
🔵 Question 9:
किसी धातु का नाम लिखिए जो जल के साथ अभिक्रिया कर हाइड्रोजन गैस उत्पन्न करती है।
🟢 Answer:
➡️ 2Na + 2H₂O → 2NaOH + H₂↑
✔️ सोडियम (Na) जल से अभिक्रिया कर हाइड्रोजन गैस उत्पन्न करता है।
🔵 Question 10:
गैल्वनाइजेशन क्या है?
🟢 Answer:
💡 लोहे की वस्तु पर जस्ता (Zn) की पतली परत चढ़ाने की प्रक्रिया को गैल्वनाइजेशन कहते हैं।
✔️ इसका उद्देश्य लोहे को जंग लगने से बचाना है।
🔵 Question 11:
अभिक्रियाशीलता श्रेणी में कौन सबसे ऊपर और कौन सबसे नीचे है?
🟢 Answer:
🔹 सबसे ऊपर → पोटैशियम (K)
🔹 सबसे नीचे → सोना (Au)
🔵 Question 12:
अधातुओं के दो उपयोग बताइए।
🟢 Answer:
🔹 ऑक्सीजन – श्वसन प्रक्रिया में।
🔹 नाइट्रोजन – उर्वरक निर्माण में।
🟡 SECTION C (प्रश्न 13–22 : 3 अंक वाले मध्यम उत्तर प्रश्न)
🔵 Question 13:
जब सोडियम धातु को जल में डाला जाता है तो क्या होता है? अभिक्रिया का समीकरण लिखिए।
🟢 Answer:
💡 सोडियम अत्यधिक अभिक्रियाशील धातु है। यह जल के साथ तीव्रता से अभिक्रिया करता है और हाइड्रोजन गैस उत्पन्न होती है।
➡️ 2Na + 2H₂O → 2NaOH + H₂↑
💡 यह अभिक्रिया ऊष्माक्षेपी होती है और गैस के साथ लौ उत्पन्न होती है।
✔️ निष्कर्ष: सोडियम जल से अभिक्रिया कर क्षारीय विलयन (NaOH) और हाइड्रोजन गैस बनाता है।
🔵 Question 14:
धातुओं की अभिक्रियाशीलता श्रेणी का क्या अर्थ है? इसका एक उपयोग लिखिए।
🟢 Answer:
💡 अभिक्रियाशीलता श्रेणी वह क्रम है जिसमें धातुएँ उनकी रासायनिक सक्रियता के अनुसार व्यवस्थित की जाती हैं।
➡️ K > Na > Ca > Mg > Al > Zn > Fe > Pb > H > Cu > Hg > Ag > Au
💡 उपयोग: किसी धातु की अभिक्रिया से यह ज्ञात किया जा सकता है कि कौन-सी धातु दूसरी को उसके लवण से विस्थापित कर सकती है।
✔️ उदाहरण: Zn + CuSO₄ → ZnSO₄ + Cu
🔵 Question 15:
धातु अम्लों के साथ कैसे अभिक्रिया करती हैं? उदाहरण सहित समझाइए।
🟢 Answer:
💡 धातु + अम्ल → लवण + हाइड्रोजन गैस
➡️ Zn + 2HCl → ZnCl₂ + H₂↑
💡 विकसित हाइड्रोजन गैस जलती हुई तीली के पास ले जाने पर “पॉप” ध्वनि के साथ जलती है।
✔️ निष्कर्ष: अम्लों के साथ धातु की अभिक्रिया से हमेशा हाइड्रोजन गैस उत्पन्न होती है।
🔵 Question 16:
किसी प्रयोग द्वारा सिद्ध कीजिए कि अधिक अभिक्रियाशील धातु कम अभिक्रियाशील धातु को उसके लवण से विस्थापित कर सकती है।
🟢 Answer:
💡 प्रयोग:
🔹 Zn की पट्टी को CuSO₄ विलयन में डालें।
🔹 कुछ समय बाद लाल-भूरे रंग का Cu Zn की सतह पर जम जाता है।
➡️ Zn + CuSO₄ → ZnSO₄ + Cu
✔️ निष्कर्ष: Zn, Cu से अधिक अभिक्रियाशील है।
🔵 Question 17:
धातुओं में जंग लगने की प्रक्रिया क्या कहलाती है? इसे रोकने के दो उपाय लिखिए।
🟢 Answer:
💡 वायु की नमी और ऑक्सीजन से धातु के धीरे-धीरे नष्ट होने की प्रक्रिया को संक्षारण (Corrosion) कहते हैं।
➡️ Fe + H₂O + O₂ → Fe₂O₃·xH₂O
🟢 रोकथाम के उपाय:
🔹 गैल्वनाइजेशन (Zn की परत चढ़ाना)
🔹 पेंट या वार्निश लगाना
✔️ निष्कर्ष: जंग से धातु की मजबूती घटती है, अतः इसे रोकना आवश्यक है।
🔵 Question 18:
अधातुओं के दो भौतिक तथा दो रासायनिक गुण लिखिए।
🟢 Answer:
💡 भौतिक गुण:
🔹 ये चमकहीन व भंगुर होती हैं।
🔹 ऊष्मा और विद्युत की कुचालक होती हैं।
💡 रासायनिक गुण:
🔹 वायु में जलने पर अम्लीय ऑक्साइड बनाती हैं।
➡️ S + O₂ → SO₂
🔹 धातुओं के साथ लवण बनाती हैं।
✔️ निष्कर्ष: अधातुओं में विद्युत प्रवाह नहीं होता और वे गैसीय या ठोस अवस्था में पाई जाती हैं।
🔵 Question 19:
धातुएँ और अधातुएँ जल के साथ कैसे अभिक्रिया करती हैं? उदाहरण सहित लिखिए।
🟢 Answer:
💡 धातु:
➡️ 2Na + 2H₂O → 2NaOH + H₂↑
💡 अधातु:
अधिकांश अधातुएँ जल के साथ सीधे अभिक्रिया नहीं करतीं।
✔️ निष्कर्ष: धातुएँ जल से अभिक्रिया कर क्षारक बनाती हैं जबकि अधातुएँ नहीं।
🔵 Question 20 (OR):
(a) अम्लीय ऑक्साइड क्या है?
(b) दो उदाहरण दीजिए।
🟢 Answer:
(a) अम्लीय ऑक्साइड वे होते हैं जो जल में घुलकर अम्ल बनाते हैं।
(b)
➡️ SO₂ + H₂O → H₂SO₃
➡️ CO₂ + H₂O → H₂CO₃
✔️ निष्कर्ष: अधातुओं के ऑक्साइड सामान्यतः अम्लीय होते हैं।
🔵 Question 21:
पारा धातु अन्य धातुओं से किस प्रकार भिन्न है?
🟢 Answer:
💡 पारा एकमात्र धातु है जो द्रव अवस्था में पाया जाता है।
🔹 यह विद्युत का सुचालक है परन्तु ऊष्मा का कमजोर चालक।
🔹 अत्यधिक ठंड में यह ठोस रूप ले लेता है।
✔️ निष्कर्ष: पारा धातु अपने भौतिक गुणों में अन्य धातुओं से भिन्न है।
🔵 Question 22:
अधातुओं का जीवों के लिए क्या महत्व है?
🟢 Answer:
💡 अधातुएँ जीवन के लिए अत्यंत आवश्यक हैं —
🔹 ऑक्सीजन (O₂): श्वसन प्रक्रिया के लिए।
🔹 नाइट्रोजन (N₂): प्रोटीन एवं डीएनए निर्माण में।
🔹 फॉस्फोरस (P): हड्डियों की मजबूती के लिए।
✔️ निष्कर्ष: अधातुएँ जीवन के रासायनिक चक्र में अपरिहार्य भूमिका निभाती हैं।
🔴 SECTION D (प्रश्न 23–30 : 4 अंक वाले दीर्घ एवं अनुप्रयोगात्मक प्रश्न)
🔵 Question 23:
अभिक्रियाशीलता श्रेणी के आधार पर बताइए कि—
(a) कौन-सी धातुएँ जल और अम्लों के साथ अभिक्रिया करती हैं?
(b) कौन-सी नहीं करतीं?
उदाहरण सहित समझाइए।
🟢 Answer:
💡 अभिक्रियाशीलता श्रेणी के अनुसार धातुओं का क्रम उनकी रासायनिक सक्रियता पर निर्भर करता है।
🔹 (a) जल और अम्लों के साथ अभिक्रिया करने वाली धातुएँ:
➡️ सोडियम (Na), पोटैशियम (K), कैल्शियम (Ca), जस्ता (Zn), लोहा (Fe)
✔️ उदाहरण: 2Na + 2H₂O → 2NaOH + H₂↑
✔️ Zn + 2HCl → ZnCl₂ + H₂↑
🔹 (b) जल और अम्लों के साथ अभिक्रिया न करने वाली धातुएँ:
➡️ ताँबा (Cu), चाँदी (Ag), सोना (Au)
💡 ये अभिक्रियाशीलता श्रेणी में हाइड्रोजन के नीचे आती हैं, इसलिए अम्लों से हाइड्रोजन नहीं निकाल सकतीं।
✔️ निष्कर्ष: जितनी ऊपर धातु श्रेणी में होगी, उसकी अभिक्रियाशीलता उतनी अधिक होगी।
🔵 Question 24:
जंग लगने की प्रक्रिया को समझाइए और इसे रोकने के उपाय लिखिए।
🟢 Answer:
💡 जंग लगना (Rusting): जब लोहा वायु के ऑक्सीजन और नमी के संपर्क में आता है तो धीरे-धीरे ऑक्सीकरण होकर भूरा परत बनाता है।
➡️ Fe + O₂ + H₂O → Fe₂O₃·xH₂O (भूरा परत = जंग)
💡 रोकथाम के उपाय:
🔹 गैल्वनाइजेशन: Zn की पतली परत चढ़ाना।
🔹 पेंटिंग / वार्निशिंग: वायु व नमी का संपर्क रोकना।
🔹 एलॉय बनाना: लोहा + Cr + Ni → स्टेनलेस स्टील।
🔹 कैथोडिक संरक्षण: लोहे को अधिक सक्रिय धातु के साथ जोड़ देना।
✔️ निष्कर्ष: जंग लगने से धातु की मजबूती घटती है, इसलिए इसका संरक्षण आवश्यक है।
🔵 Question 25:
अमलगम क्या होता है? इसके दो उपयोग लिखिए।
🟢 Answer:
💡 जब कोई धातु पारे (Hg) के साथ घुलकर मिश्रण बनाती है, उसे अमलगम कहते हैं।
🟢 उपयोग:
🔹 दाँत भरने में (चाँदी का अमलगम)।
🔹 विद्युत उपकरणों में संपर्क सामग्री के रूप में।
✔️ निष्कर्ष: पारा अन्य धातुओं के साथ अमलगम बनाकर उनके उपयोग बढ़ा देता है।
🔵 Question 26:
मिश्रधातु क्या होती है? मिश्रधातु बनाने के दो कारण बताइए।
🟢 Answer:
💡 दो या अधिक धातुओं (या धातु + अधातु) का समांग मिश्रण मिश्रधातु (Alloy) कहलाता है।
💡 मिश्रधातु बनाने के कारण:
🔹 धातु की कठोरता व मजबूती बढ़ाने हेतु।
🔹 संक्षारण-प्रतिरोध बढ़ाने हेतु।
🟢 उदाहरण:
➡️ पीतल (Brass) = Cu + Zn
➡️ कांसा (Bronze) = Cu + Sn
➡️ स्टेनलेस स्टील = Fe + Cr + Ni
✔️ निष्कर्ष: मिश्रधातु धातुओं को अधिक उपयोगी बनाती है।
🔵 Question 27 (OR):
धातुओं की व अधातुओं की अभिक्रियाशीलता की तुलना उचित उदाहरणों सहित कीजिए।
🟢 Answer:
💡 धातु:
🔹 इलेक्ट्रॉन छोड़ती हैं और धनायन बनाती हैं।
🔹 जल व अम्लों से अभिक्रिया कर हाइड्रोजन गैस उत्पन्न करती हैं।
➡️ Zn + 2HCl → ZnCl₂ + H₂↑
💡 अधातु:
🔹 इलेक्ट्रॉन ग्रहण करती हैं और ऋणायन बनाती हैं।
🔹 अम्लीय ऑक्साइड बनाती हैं।
➡️ S + O₂ → SO₂
✔️ निष्कर्ष: धातु अपचायक होती हैं जबकि अधातु ऑक्सीकारक।
🔵 Question 28:
किसी एक प्रयोग द्वारा सिद्ध कीजिए कि धातुएँ विद्युत की चालक होती हैं।
🟢 Answer:
💡 प्रयोग:
🔹 बैटरी, बल्ब और ताँबे के तार से परिपथ बनाइए।
🔹 तारों के बीच लोहे की कील लगाएँ।
✔️ बल्ब जल उठेगा → यह सिद्ध करता है कि धातु विद्युत की चालक है।
💡 निष्कर्ष: धातुओं में मुक्त इलेक्ट्रॉन होते हैं जो विद्युत प्रवाह कराते हैं।
🔵 Question 29:
लवण क्या होता है? धातुओं व अधातुओं से बनने वाले दो लवणों के उदाहरण लिखिए।
🟢 Answer:
💡 अम्ल और क्षारक की अभिक्रिया से बनने वाला यौगिक लवण कहलाता है।
➡️ अम्ल + क्षारक → लवण + जल
🟢 उदाहरण:
🔹 NaOH + HCl → NaCl + H₂O
🔹 CuO + H₂SO₄ → CuSO₄ + H₂O
✔️ निष्कर्ष: लवण विद्युत अपघट्य होते हैं और जल में घुलनशील भी हो सकते हैं।
🔵 Question 30:
धातुओं की अभिक्रियाशीलता का क्रम निर्धारण करने के लिए प्रयोगात्मक विधि समझाइए।
🟢 Answer:
💡 प्रयोग:
🔹 तीन टेस्ट ट्यूबों में ZnSO₄, CuSO₄, FeSO₄ के विलयन लें।
🔹 इनमें अलग-अलग धातु की पट्टियाँ डालें।
🔹 जहाँ रंग परिवर्तन हो, वहाँ विस्थापन हुआ है।
🟢 अवलोकन:
➡️ Zn + CuSO₄ → ZnSO₄ + Cu
➡️ Fe + CuSO₄ → FeSO₄ + Cu
➡️ Cu + ZnSO₄ → कोई परिवर्तन नहीं।
💡 निष्कर्ष: Zn > Fe > Cu
✔️ अतः Zn सबसे अभिक्रियाशील तथा Cu सबसे कम अभिक्रियाशील है।
——————————————————————————————————————————————————————————————–
दृश्य सामग्री
———————————————————————————————————————————————————————————————————-
