Class : 9 – Science (Hindi) : Lesson 4. परमाणु की संरचना
पाठ का विश्लेषण एवं विवेचन
परमाणु रसायन विज्ञान का मूल आधार है। प्रारंभ में यह माना जाता था कि परमाणु अविभाज्य है, जैसा कि डाल्टन के परमाणु सिद्धांत में वर्णित है। लेकिन समय के साथ वैज्ञानिकों ने यह पाया कि परमाणु भी और अधिक सूक्ष्म कणों – इलेक्ट्रॉन, प्रोटॉन, और न्यूट्रॉन – से बना होता है। इन कणों की खोज और अध्ययन ने हमें परमाणु की संरचना को समझने में मदद की।
इलेक्ट्रॉन की खोज – जे. जे. थॉमसन
सन 1897 में जे. जे. थॉमसन ने कैथोड किरण नलिका प्रयोग द्वारा इलेक्ट्रॉन की खोज की।
प्रयोग का निष्कर्ष:
कैथोड किरणें नकारात्मक रूप से आवेशित होती हैं।
ये किरणें विद्युत और चुम्बकीय क्षेत्र में विक्षेपित होती हैं।
इससे यह सिद्ध हुआ कि परमाणु में एक नकारात्मक कण होता है, जिसे उन्होंने इलेक्ट्रॉन नाम दिया।
प्रोटॉन की खोज – गोल्डस्टीन
प्रोटॉन, जो धनावेशित होता है, की खोज गोल्डस्टीन ने एनोड किरण नलिका प्रयोग से की।
विशेषताएँ:
प्रोटॉन का द्रव्यमान इलेक्ट्रॉन से लगभग 1836 गुना अधिक होता है।
यह धनावेशित होता है।
न्यूट्रॉन की खोज – जेम्स चैडविक
न्यूट्रॉन की खोज सन 1932 में जेम्स चैडविक ने की।
विशेषताएँ:
इसका कोई आवेश नहीं होता (तटस्थ)।
यह प्रोटॉन के बराबर द्रव्यमान वाला होता है।
यह परमाणु के द्रव्यमान का महत्वपूर्ण भाग है।

थॉमसन का मॉडल (Plum Pudding Model)
जे. जे. थॉमसन ने यह प्रस्तावित किया कि:
परमाणु धनावेशित द्रव्य की एक गोला है।
इसमें इलेक्ट्रॉन “प्लम” की तरह बिखरे होते हैं।
सीमाएँ:
यह मॉडल यह नहीं बता सका कि इलेक्ट्रॉन स्थायी रूप से परमाणु में कैसे टिके रहते हैं।
यह परमाणु की स्थिरता और ऊर्जा स्तरों को स्पष्ट नहीं कर सका।
रदरफोर्ड का परमाणु मॉडल (1911)
अर्नेस्ट रदरफोर्ड ने स्वर्ण पत्तर प्रयोग (Gold Foil Experiment) करके परमाणु की संरचना का नया मॉडल प्रस्तुत किया।
प्रयोग:
उन्होंने अल्फा कणों को एक पतली स्वर्ण पन्नी पर डाला।
अधिकांश कण सीधे निकल गए, कुछ मुड़े और कुछ वापस लौटे।
निष्कर्ष:
परमाणु का अधिकांश भाग रिक्त होता है।
परमाणु के केंद्र में एक धनावेशित घना क्षेत्र होता है जिसे नाभिक (nucleus) कहते हैं।
इलेक्ट्रॉन नाभिक के चारों ओर परिक्रमा करते हैं।
सीमाएँ:
इलेक्ट्रॉन नाभिक के चारों ओर घूमते समय ऊर्जा खोते, जिससे वे नाभिक में गिर जाते।
यह मॉडल स्थायित्व की व्याख्या नहीं कर सका।
नील्स बोहर का परमाणु मॉडल (1913)
नील्स बोहर ने रदरफोर्ड के मॉडल की कमियों को दूर किया और एक नया परमाणु मॉडल दिया।
मुख्य विशेषताएँ:
इलेक्ट्रॉन नाभिक के चारों ओर विशिष्ट गोल पथों (ऊर्जा स्तरों) में परिक्रमा करते हैं।
प्रत्येक ऊर्जा स्तर का निश्चित ऊर्जा मान होता है।
जब इलेक्ट्रॉन एक ऊर्जा स्तर से दूसरे में जाते हैं, तो वे ऊर्जा का उत्सर्जन या अवशोषण करते हैं।
ऊर्जा स्तरों को K, L, M, N आदि नामों से दर्शाया गया।
यह मॉडल हाइड्रोजन जैसे सरल तत्वों के लिए बहुत उपयुक्त सिद्ध हुआ।
इलेक्ट्रॉनों का विन्यास (Electronic Configuration)
इलेक्ट्रॉनों का नाभिक के चारों ओर ऊर्जा स्तरों में विशेष नियमों से वितरण होता है:
बोर-बरी नियम:
पहले कोश में अधिकतम 2n² इलेक्ट्रॉन हो सकते हैं, जहाँ n उस कोश की संख्या है।
जैसे:
K (n=1): 2
L (n=2): 8
M (n=3): 18
अंतिम कोश में अधिकतम 8 इलेक्ट्रॉन होते हैं।
उदाहरण:
कार्बन (Z=6) → 2, 4
ऑक्सीजन (Z=8) → 2, 6
सोडियम (Z=11) → 2, 8, 1
परमाणु संख्या (Atomic Number) और द्रव्यमान संख्या (Mass Number)
परमाणु संख्या (Z):
नाभिक में उपस्थित प्रोटॉनों की संख्या।
द्रव्यमान संख्या (A):
प्रोटॉनों और न्यूट्रॉनों का कुल योग।
सूत्र: A = Z + n (जहाँ n = न्यूट्रॉन की संख्या)
उदाहरण:
ऑक्सीजन
Z = 8, n = 8 ⇒ A = 8 + 8 = 16
समस्थानिक (Isotopes)
एक ही तत्व के वे परमाणु जिनकी परमाणु संख्या समान लेकिन द्रव्यमान संख्या भिन्न होती है, उन्हें समस्थानिक कहते हैं।
उदाहरण:
हाइड्रोजन के समस्थानिक –
प्रोटियम (¹H),
ड्यूटेरियम (²H),
ट्रिटियम (³H)
प्रयोग:
कोबाल्ट-60 कैंसर उपचार में।
आयोडीन-131 थायरॉइड रोग में।
समभारक (Isobars)
वे परमाणु जिनकी द्रव्यमान संख्या समान लेकिन परमाणु संख्या भिन्न होती है, उन्हें समभारक कहते हैं।
उदाहरण:
⁴⁰Ar और ⁴⁰Ca
नाभिकीय कणों की तुलना
कण आवेश द्रव्यमान (amu में) स्थिति
इलेक्ट्रॉन -1 लगभग 0.0005 नाभिक के बाहर, कक्षा में
प्रोटॉन +1 1 नाभिक में
न्यूट्रॉन 0 1 नाभिक में
निष्कर्ष
परमाणु की संरचना का अध्ययन हमें यह समझने में मदद करता है कि पदार्थ के सूक्ष्मतम कण कैसे व्यवस्थित होते हैं। थॉमसन, रदरफोर्ड और बोहर जैसे वैज्ञानिकों के प्रयासों से हम आज परमाणु के अंदर के कणों और उनके व्यवहार को समझ सके हैं। यह समझ आगे चलकर रासायनिक बंध, आवर्त सारणी, तथा रासायनिक अभिक्रियाओं की गहराई में जाने का मार्ग प्रशस्त करती है।
यह अध्याय विज्ञान की आधारशिला है, जिसे समझना प्रत्येक छात्र के लिए आवश्यक है।
————————————————————————————————————————————————————————————————————————————
पाठ्यपुस्तक के प्रश्न
1. इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन के गुणों की तुलना कीजिए।
उत्तर:
तीनों कणों के गुण निम्नलिखित हैं:
गुण इलेक्ट्रॉन प्रोटॉन न्यूट्रॉन
आवेश ऋणात्मक (-1) धनात्मक (+1) शून्य (न्यूट्रल)
द्रव्यमान बहुत कम (प्रोटॉन का 1/2000) 1 a.m.u. 1 a.m.u.
स्थिति नाभिक के बाहर, कक्षाओं में नाभिक के अंदर नाभिक के अंदर
खोजकर्ता जे.जे. थॉमसन ई. गोल्डस्टीन जेम्स चैडविक
2. जे.जे. थॉमसन के परमाणु मॉडल की सीमाएँ क्या थीं?
उत्तर:
यह मॉडल रदरफोर्ड के प्रायोगिक निष्कर्षों को नहीं समझा सका।
यह नहीं बता सका कि अधिकांश अल्फा कण बिना विक्षेपित हुए क्यों निकल जाते हैं।
यह परमाणु के स्थायित्व को नहीं समझा सका।
इसमें नाभिक की संकल्पना नहीं थी।
3. रदरफोर्ड के परमाणु मॉडल की सीमाएँ क्या थीं?
उत्तर:
क्लासिकल भौतिकी के अनुसार, घूमता हुआ इलेक्ट्रॉन ऊर्जा खोता और नाभिक में गिर जाता, जिससे परमाणु अस्थिर हो जाता।
यह परमाणु के स्थायित्व को स्पष्ट नहीं कर सका।
4. बोहर के परमाणु मॉडल का वर्णन कीजिए।
उत्तर:
इलेक्ट्रॉन नाभिक के चारों ओर निश्चित कक्षाओं (ऊर्जा स्तरों) में घूमते हैं।
ये कक्षाएँ K, L, M, N (या n=1,2,3,4) कहलाती हैं।
इलेक्ट्रॉन इन कक्षाओं में घूमते समय ऊर्जा का उत्सर्जन या अवशोषण नहीं करते।
ऊर्जा का उत्सर्जन या अवशोषण केवल एक कक्षा से दूसरी में जाने पर होता है।
नाभिक में परमाणु का सारा धनात्मक आवेश और द्रव्यमान केंद्रित होता है।
5. इस अध्याय में दिए गए सभी परमाणु मॉडल की तुलना कीजिए।
उत्तर:
विशेषता थॉमसन मॉडल रदरफोर्ड मॉडल बोहर मॉडल
धनात्मक आवेश पूरे परमाणु में फैला नाभिक में केंद्रित नाभिक में केंद्रित
ऋणात्मक आवेश धनात्मक क्षेत्र में बिखरे नाभिक के चारों ओर घूमते निश्चित कक्षाओं में घूमते
मुख्य सीमा प्रायोगिक पुष्टि नहीं स्थायित्व नहीं समझा सका स्थायित्व समझाया
मुख्य योगदान उपपरमाण्विक कणों का सुझाव नाभिक की खोज क्वांटम ऊर्जा स्तर
6. पहले 18 तत्वों के लिए इलेक्ट्रॉनों के वितरण के नियम संक्षेप में लिखिए।
उत्तर:
किसी कक्षा में अधिकतम इलेक्ट्रॉन = 2n² (n = कक्षा संख्या)
K (n=1): 2 × 1² = 2
L (n=2): 2 × 2² = 8
M (n=3): 2 × 3² = 18
बाह्यतम कक्षा में अधिकतम 8 इलेक्ट्रॉन हो सकते हैं।
पहले भीतरी कक्षाएँ पूरी भरती हैं, फिर बाहरी कक्षाएँ भरती हैं।
7. सिलिकॉन और ऑक्सीजन के उदाहरण द्वारा संयोजकता (वैलेंसी) को परिभाषित कीजिए।
उत्तर:
संयोजकता वह संख्या है, जो दर्शाती है कि कोई परमाणु कितने इलेक्ट्रॉन ग्रहण, खो या साझा कर सकता है।
सिलिकॉन (परमाणु संख्या 14):
इलेक्ट्रॉन विन्यास: K=2, L=8, M=4
बाहरी कक्षा में 4 इलेक्ट्रॉन, अतः संयोजकता = 4
ऑक्सीजन (परमाणु संख्या 8):
इलेक्ट्रॉन विन्यास: K=2, L=6
बाहरी कक्षा में 6 इलेक्ट्रॉन, अतः संयोजकता = 8-6 = 2
8. उदाहरण सहित (i) परमाणु संख्या, (ii) द्रव्यमान संख्या, (iii) समस्थानिक, (iv) समभारक को समझाइए। समस्थानिकों के दो उपयोग लिखिए।
उत्तर:
(i) परमाणु संख्या: नाभिक में उपस्थित प्रोटॉनों की संख्या।
उदाहरण: ऑक्सीजन की परमाणु संख्या 8 है।
(ii) द्रव्यमान संख्या: प्रोटॉन और न्यूट्रॉन की कुल संख्या।
उदाहरण: सोडियम (Na) में प्रोटॉन = 11, न्यूट्रॉन = 12, द्रव्यमान संख्या = 23
(iii) समस्थानिक: एक ही तत्व के वे परमाणु जिनकी परमाणु संख्या समान, परंतु द्रव्यमान संख्या भिन्न होती है।
उदाहरण: ₆C¹² और ₆C¹⁴
(iv) समभारक: वे परमाणु जिनकी द्रव्यमान संख्या समान, परंतु परमाणु संख्या भिन्न होती है।
उदाहरण: ₂₀Ca⁴⁰ और ₁₈Ar⁴⁰
समस्थानिकों के दो उपयोग:
यूरेनियम समस्थानिक का उपयोग परमाणु रिएक्टर में ईंधन के रूप में
कोबाल्ट समस्थानिक का उपयोग कैंसर के इलाज में
9. Na⁺ आयन में K और L कक्षाएँ पूरी तरह भरी होती हैं, स्पष्ट कीजिए।
उत्तर:
Na (परमाणु संख्या 11): K=2, L=8, M=1
Na⁺ बनने पर एक इलेक्ट्रॉन निकल जाता है: K=2, L=8
K और L दोनों कक्षाएँ पूरी तरह भरी हैं।
10. यदि ब्रोमीन दो समस्थानिकों के रूप में उपलब्ध है: ⁷⁹₃₅Br (49.7%) और ⁸¹₃₅Br (50.3%), तो ब्रोमीन का औसत परमाणु द्रव्यमान ज्ञात कीजिए।
उत्तर:
औसत परमाणु द्रव्यमान = (79 × 49.7 + 81 × 50.3)/100
= (3926.3 + 4074.3)/100
= 8000.6/100
= 80.006 u ≈ 80 u
11. किसी तत्व X का औसत परमाणु द्रव्यमान 16.2 u है। ¹⁶₈X और ¹⁸₈X समस्थानिकों का प्रतिशत ज्ञात कीजिए।
उत्तर:
मान लीजिए ¹⁶₈X = x%, तो ¹⁸₈X = (100-x)%
16.2 = (16x + 18(100-x))/100
1620 = 16x + 1800 – 18x
1620 = 1800 – 2x
2x = 180
x = 90%
तो, ¹⁶₈X = 90%, ¹⁸₈X = 10%
12. यदि Z = 3 है, तो तत्व की संयोजकता क्या होगी? तत्व का नाम बताइए।
उत्तर:
Z = 3 (लिथियम), इलेक्ट्रॉन विन्यास: K=2, L=1
बाहरी कक्षा में 1 इलेक्ट्रॉन, अतः संयोजकता = 1
तत्व का नाम: लिथियम (Li)
13. दो परमाणु प्रजातियों X और Y के नाभिक की संरचना:
X: प्रोटॉन = 6, न्यूट्रॉन = 6
Y: प्रोटॉन = 6, न्यूट्रॉन = 8
उत्तर:
X का द्रव्यमान संख्या = 6+6 = 12
Y का द्रव्यमान संख्या = 6+8 = 14
दोनों की परमाणु संख्या समान (6), अतः ये कार्बन के समस्थानिक हैं।
14. निम्न कथनों के लिए सत्य (T) या असत्य (F) लिखिए:
(a) जे.जे. थॉमसन ने प्रस्तावित किया कि परमाणु के नाभिक में केवल न्यूक्लिओन होते हैं।
उत्तर: असत्य (F)
(b) न्यूट्रॉन इलेक्ट्रॉन और प्रोटॉन के संयोजन से बनता है, इसलिए यह तटस्थ है।
उत्तर: असत्य (F)
(c) इलेक्ट्रॉन का द्रव्यमान प्रोटॉन के द्रव्यमान का लगभग 1/2000 है।
उत्तर: सत्य (T)
(d) आयोडीन का एक समस्थानिक टिंचर आयोडीन (औषधि) बनाने में प्रयुक्त होता है।
उत्तर: सत्य (T)
15. रदरफोर्ड के अल्फा-कण प्रकीर्णन प्रयोग से किसकी खोज हुई?
(a) परमाणु नाभिक (b) इलेक्ट्रॉन (c) प्रोटॉन (d) न्यूट्रॉन
उत्तर: (a) परमाणु नाभिक
16. किसी तत्व के समस्थानिकों में:
(a) समान भौतिक गुण (b) भिन्न रासायनिक गुण (c) न्यूट्रॉन की संख्या भिन्न (d) परमाणु संख्या भिन्न
उत्तर: (c) न्यूट्रॉन की संख्या भिन्न
17. Cl⁻ आयन में संयोजक इलेक्ट्रॉनों की संख्या है:
(a) 16 (b) 8 (c) 17 (d) 18
उत्तर: (b) 8
18. सोडियम का सही इलेक्ट्रॉन विन्यास कौन-सा है?
(a) 2,8 (b) 8,2,1 (c) 2,1,8 (d) 2,8,1
उत्तर: (d) 2,8,1
————————————————————————————————————————————————————————————————————————————
अन्य महत्वपूर्ण प्रश्न
🔵 बहुविकल्पीय प्रश्न (10 MCQ)
1. रदरफोर्ड के प्रयोग में अधिकांश अल्फा कण सीधे क्यों निकल गए?
A) वे हल्के होते हैं
B) परमाणु ठोस होता है
C) परमाणु का अधिकांश भाग रिक्त होता है
D) वे बहुत तेज गति से चलते हैं
उत्तर: C) परमाणु का अधिकांश भाग रिक्त होता है
2. म्नलिखित में से किस वैज्ञानिक ने परमाणु में न्यूट्रॉन की खोज की थी?
A) बोहर
B) चैडविक
C) थॉमसन
D) रदरफोर्ड
उत्तर: B) चैडविक
3. इलेक्ट्रॉन की खोज किसने की थी?
A) डाल्टन
B) रदरफोर्ड
C) थॉमसन
D) नील्स बोहर
उत्तर: C) थॉमसन
4. बोहर मॉडल के अनुसार, इलेक्ट्रॉन ऊर्जा का उत्सर्जन या अवशोषण कब करता है?
A) जब वह नाभिक के बहुत पास आ जाए
B) जब वह स्थिर कक्षा में रहे
C) जब वह एक कक्षा से दूसरी कक्षा में जाए
D) जब वह घूमना बंद कर दे
उत्तर: C) जब वह एक कक्षा से दूसरी कक्षा में जाए
5. यदि किसी तत्व की परमाणु संख्या 17 है, तो उसके परमाणु में कितने प्रोटॉन होंगे?
A) 17 B) 8 C) 18 D) 34
उत्तर: A) 17
6. एक परमाणु के बाह्यतम कक्षा में अधिकतम कितने इलेक्ट्रॉन हो सकते हैं?
A) 2 B) 8 C) 10 D) 18
उत्तर: B) 8
7. समस्थानिकों की रासायनिक विशेषताएँ क्यों समान होती हैं?
A) क्योंकि उनके न्यूट्रॉन समान होते हैं
B) क्योंकि उनका द्रव्यमान समान होता है
C) क्योंकि उनके प्रोटॉन समान होते हैं
D) क्योंकि उनकी परमाणु संख्या समान होती है
उत्तर: D) क्योंकि उनकी परमाणु संख्या समान होती है
8. कैल्शियम (Ca) और आर्गन (Ar) का द्रव्यमान संख्या 40 है, फिर भी वे भिन्न हैं। यह उदाहरण किसका है?
A) समस्थानिक
B) समभारक
C) सममूल्यक
D) समचालक
उत्तर: B) समभारक
9. K कक्षा में अधिकतम कितने इलेक्ट्रॉन हो सकते हैं?
A) 8 B) 18 C) 2 D) 4
उत्तर: C) 2
10. यदि किसी परमाणु की द्रव्यमान संख्या 23 और परमाणु संख्या 11 है, तो उसमें न्यूट्रॉन की संख्या होगी:
A) 12 B) 11 C) 10 D) 23
उत्तर: A) 12
🟡 रिक्त स्थान भरें (3 Fill in the Blanks)
11. बोहर मॉडल के अनुसार, इलेक्ट्रॉन _ कक्षाओं में रहते हैं।
उत्तर: निश्चित ऊर्जा वाली
12. प्रोटॉन और न्यूट्रॉन परमाणु के _ में स्थित होते हैं।
उत्तर: नाभिक
13. समस्थानिकों की परमाणु संख्या समान होती है पर _ संख्या भिन्न होती है।
उत्तर: द्रव्यमान
🟠 Assertion and Reason Questions (3 प्रश्न)
(सही उत्तर चुनें: A, B, C, D)
14.
Assertion (A): समस्थानिकों की रासायनिक क्रियाशीलता समान होती है।
Reason (R): समस्थानिकों की परमाणु संख्या समान होती है।
A) A और R दोनों सही हैं और R, A की सही व्याख्या है।
B) A और R दोनों सही हैं लेकिन R, A की सही व्याख्या नहीं है।
C) A सही है लेकिन R गलत है।
D) A गलत है लेकिन R सही है।
उत्तर: A
15.
Assertion (A): रदरफोर्ड का मॉडल परमाणु की स्थिरता को सही ढंग से नहीं समझा सका।
Reason (R): इलेक्ट्रॉन घूमते समय ऊर्जा का उत्सर्जन कर नाभिक में गिर जाते।
उत्तर: A
16.
Assertion (A): परमाणु का द्रव्यमान मुख्यतः प्रोटॉन और न्यूट्रॉन पर निर्भर करता है।
Reason (R): इलेक्ट्रॉन का द्रव्यमान नगण्य होता है।
उत्तर: A
🔴 सही या गलत चुनें (2 Questions)
इलेक्ट्रॉन का आवेश धनात्मक होता है।
उत्तर: ❌ गलत
थॉमसन मॉडल में परमाणु को धनावेशित गोले के रूप में माना गया था।
उत्तर: ✅ सही
🔵 लघु उत्तरीय प्रश्न (5 प्रश्न)
(30–50 शब्दों में उत्तर)
1. रदरफोर्ड के स्वर्ण पत्तिका प्रयोग से परमाणु की कौन-सी विशेषताएँ स्पष्ट हुईं?
उत्तर: परमाणु का अधिकांश भाग रिक्त होता है, इसका केंद्र में एक घना और धनावेशित नाभिक होता है, तथा इलेक्ट्रॉन नाभिक के चारों ओर घूमते हैं।
2. न्यूट्रॉन की खोज क्यों महत्वपूर्ण मानी जाती है?
उत्तर: न्यूट्रॉन के कारण परमाणु का द्रव्यमान बढ़ता है और यह नाभिक में स्थिरता बनाए रखता है। इसके बिना परमाणु में केवल आवेशित कण होते जिससे अस्थिरता आती।
3. समस्थानिक और समभारक में अंतर स्पष्ट कीजिए।
उत्तर: समस्थानिक – एक ही तत्व के परमाणु जिनकी परमाणु संख्या समान पर द्रव्यमान भिन्न हो।
समभारक – दो तत्व जिनकी द्रव्यमान संख्या समान हो पर परमाणु संख्या अलग हो।
4. परमाणु संख्या और द्रव्यमान संख्या में क्या अंतर है?
उत्तर: परमाणु संख्या प्रोटॉनों की संख्या होती है, जबकि द्रव्यमान संख्या = प्रोटॉन + न्यूट्रॉन।
5. बोहर मॉडल ने रदरफोर्ड मॉडल की कौन-सी समस्या हल की?
उत्तर: बोहर मॉडल ने यह स्पष्ट किया कि इलेक्ट्रॉन विशेष कक्षाओं में रहते हैं और जब तक वे अपनी कक्षा में रहते हैं, ऊर्जा का उत्सर्जन नहीं करते, जिससे परमाणु स्थिर रहता है।
🟣 दीर्घ उत्तरीय प्रश्न (2 प्रश्न)
(80–120 शब्दों में उत्तर)
1. बोहर का परमाणु मॉडल क्या था? इसकी मुख्य विशेषताएँ लिखिए।
उत्तर:
बोहर के अनुसार,
(1) इलेक्ट्रॉन परमाणु के नाभिक के चारों ओर विशेष ऊर्जा स्तरों (K, L, M…) में परिक्रमा करते हैं।
(2) वे स्थिर कक्षा में ऊर्जा का उत्सर्जन या अवशोषण नहीं करते।
(3) जब वे एक कक्षा से दूसरी में जाते हैं, तब ऊर्जा अवशोषित या उत्सर्जित करते हैं।
इस मॉडल ने परमाणु की स्थिरता और स्पेक्ट्रा की व्याख्या की।
2. रदरफोर्ड के परमाणु मॉडल का वर्णन कीजिए तथा उसकी सीमाएँ लिखिए।
उत्तर:
रदरफोर्ड ने बताया कि
(1) परमाणु में एक घना नाभिक होता है जिसमें प्रोटॉन होते हैं।
(2) इलेक्ट्रॉन नाभिक के चारों ओर घूमते हैं।
(3) परमाणु का अधिकांश भाग रिक्त होता है।
सीमाएँ:
इलेक्ट्रॉन ऊर्जा खोकर नाभिक में गिरते तो परमाणु अस्थिर होता।
यह इलेक्ट्रॉन के ऊर्जा स्तर नहीं समझा सका।
————————————————————————————————————————————————————————————————————————————
एक पृष्ठ में दोहरान
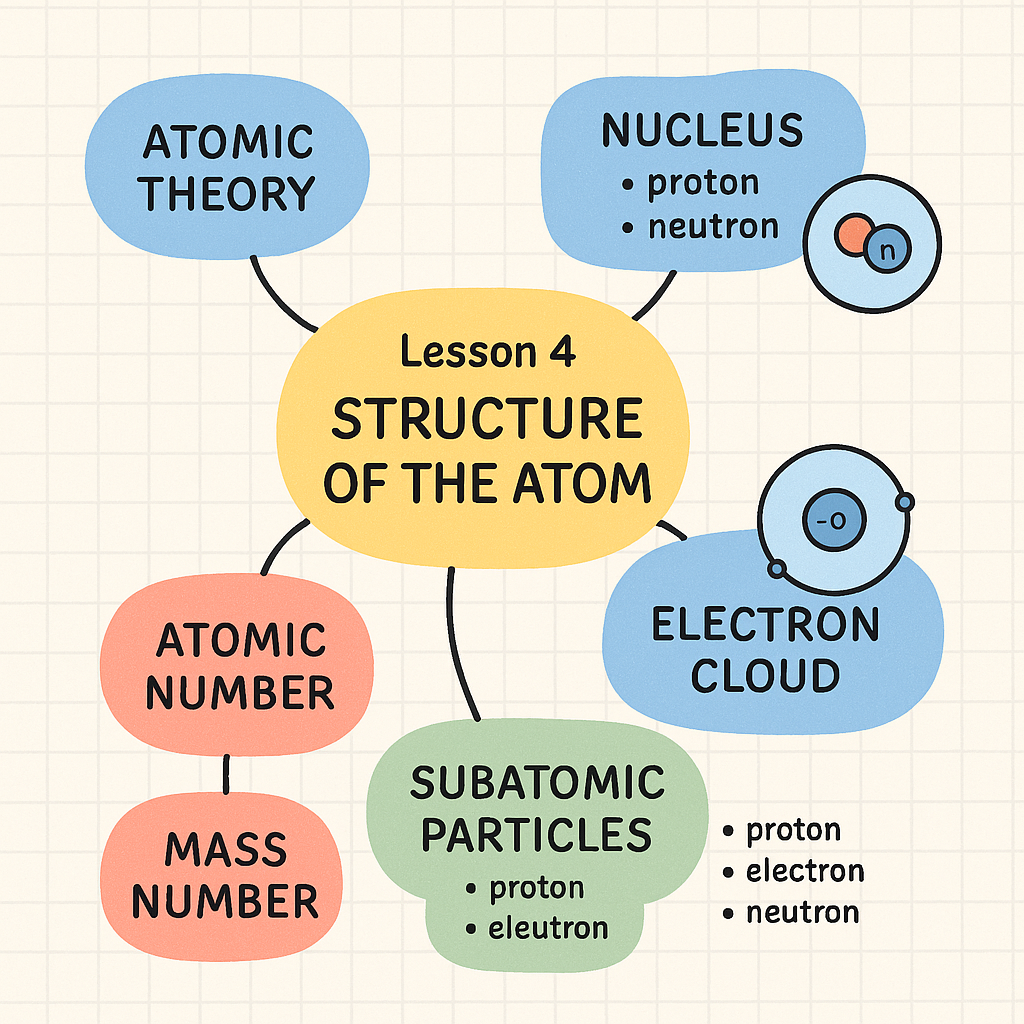
परमाणु के दो मुख्य भाग होते हैं: नाभिक (nucleus) और परमाणु मंडल (shells)।
नाभिक में प्रोटॉन (धनावेशित) और न्यूट्रॉन (निरावेशित) होते हैं।
प्रोटॉन का आवेश +1 और न्यूट्रॉन का कोई आवेश नहीं होता।
इलेक्ट्रॉन (ऋणावेशित कण) नाभिक के चारों ओर कक्षाओं में घूमते हैं।
इलेक्ट्रॉन का आवेश -1 होता है।
परमाणु का अधिकतर द्रव्यमान नाभिक में केंद्रित होता है।
परमाणु में प्रोटॉन की संख्या परमाणु क्रमांक (Atomic Number) कहलाती है।
प्रोटॉन और न्यूट्रॉन की कुल संख्या द्रव्यमान संख्या (Mass Number) कहलाती है।
इलेक्ट्रॉन की संख्या सामान्य परमाणु में प्रोटॉन के बराबर होती है।
रदरफोर्ड और बोहर ने परमाणु संरचना के महत्वपूर्ण मॉडल प्रस्तुत किए।

————————————————————————————————————————————————————————————————————————————
मस्तिष्क मानचित्र
————————————————————————————————————————————————————————————————————————————
